В связи с постарением населения распространенность хронической сердечной недостаточности (ХСН) в современном мире достигла масштабов эпидемии, причем ХСН с сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ) встречается по меньшей мере в 50% всех случаев [1]. Прогноз ХСН с сохраненной ФВ ЛЖ несколько лучше, чем при ХСН со сниженной ФВ ЛЖ [2—4]. Между тем эффективное лечение больных с ХСН с сохраненной ФВ ЛЖ не разработано [5] и проводится по принципу коррекции факторов, способствующих ее прогрессированию [6, 7].
Повышенная частота сердечных сокращений (ЧСС) ассоциируется с увеличением риска смерти и повторной госпитализации пациентов с ХСН [8]. Поэтому представляется логичным назначение больным с ХСН препаратов, урежающих ритм сердца. Однако β-адреноблокаторы, снижая ЧСС, не улучшали диастолическую функцию ЛЖ, не обеспечивали клинических преимуществ пациентам с ХСН и сохраненной ФВ ЛЖ [9], что может быть связано с сопутствующими эффектами этих препаратов [10]. Ингибитор If-каналов ивабрадин может рассматриваться в качестве альтернативы β-адреноблокаторам при лечении больных с ХСН со сниженной ФВ ЛЖ [11, 12]. При этом эффективность терапии ивабрадином у больных с ХСН и сохраненной ФВ ЛЖ остается малоизученной.
Цель настоящего исследования — сравнение эффективности бисопролола и ивабрадина при длительном лечении ХСН с сохраненной ФВ ЛЖ у больных с гипертонической болезнью и ишемической болезнью сердца (ИБС).
Материал и методы
В исследовании участвовали 126 больных в возрасте от 51 до 70 лет с ХСН II—III функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца и сохраненной ФВ ЛЖ на фоне гипертонической болезни III стадии и ИБС со стенокардией напряжения I—II ФК по классификации Канадского сердечно-сосудистого общества.
Критерии включения в исследование: артериальная гипертензия (АГ) в анамнезе; ИБС со стенокардией не выше II ФК в анамнезе; одышка, утомляемость, сердцебиение при физической нагрузке; ФВ ЛЖ 50% и более; синусовый ритм с частотой в покое 70 уд/мин и более; 1-й тип диастолической дисфункции ЛЖ (с замедленной релаксацией); подписанное информированное согласие.
Наличие у пациентов диастолической дисфункции ЛЖ констатировали в соответствии с критериями Европейского общества кардиологов [13] и с учетом рекомендаций Американского общества эхокардиографии и Европейской ассоциации эхокардиографии [14].
В исследование не включали больных с гемодинамически значимым поражением клапанов сердца; кардиомиопатиями; перенесенным острым коронарным синдромом или инсультом; синдромом слабости синусного узла; фибрилляцией предсердий; атриовентрикулярной блокадой II—III степени; вторичной АГ; индексом массы тела более 30 кг/м2; заболеваниями органов дыхания с дыхательной недостаточностью; анемией (уровень гемоглобина ниже 130 г/л у мужчин и 120 г/л у женщин); нарушениями функции печени или почек; сахарным диабетом, при котором требовалась инсулинотерапия.
Получено одобрение локального Комитета по этике на проведение исследования.
Лечение АГ проводили, переводя пациентов на прием фиксированной комбинации периндоприл/амлодипин (престанс, «Servier», Франция), титруя дозу от 5/5 до 10/5, 5/10 и 10/10 мг 1 раз в сутки до достижения и поддержания офисного артериального давления ниже 140 и 90 мм рт.ст. После рандомизации больные получали один из вариантов терапии, урежающей частоту синусового ритма: бисопролол (конкор, «Merck», Германия) с титрованием дозы от 1,25 до 10 мг 1 раз в сутки или ивабрадин (кораксан, «Servier», Франция) — от 2,5 до 7,5 мг 2 раза в сутки до достижения ЧCC в покое 55—60 уд/мин.
Комплексное обследование больных проводили исходно и через 12 мес подобранной терапии; кроме общеклинического исследования, обследование включало электрокардиографию в 12 отведениях; тест с 6-минутной ходьбой (ТШХ); тредмил-тест в соответствии с модифицированным протоколом Bruce; оценку клинического состояния по шкале ШОКС в модификации В.Ю. Мареева, оценку качества жизни с использованием Миннесотского опросника (MLHFQ); определение концентрации N-концевого предшественника мозгового натрий-уретического пептида (NT-proBNP) в крови на анализаторе СOBAS H 232, эхокардиографию (ЭхоКГ).
ЭхоКГ (в М- и В-режиме, импульсноволновую, в том числе тканевую, допплерографию) выполняли по стандартным рекомендациям [14, 15] с использованием ультразвуковой системы Aloka Alpha 7 и векторного датчика с частотой 2,5 МГц. Размер и объем ЛЖ определяли по методу Simpson. Рассчитывали объем левого предсердия (ЛП), ФВ ЛЖ в автоматическом режиме с помощью интегрированного программного обеспечения, массу миокарда ЛЖ по формуле R.B. Devereux.
Для оценки диастолической функции ЛЖ использовали максимальные скорости раннего диастолического наполнения (Е) и наполнения в систолу предсердий (А), их соотношение (Е/А), время изоволюмического расслабления ЛЖ (IVRT), время замедления кровотока раннего диастолического наполнения (DТ). Показатели Е, А и DT оценивали из апикального доступа в проекции четырехкамерного сечения с помощью импульсноволновой допплерографии, размещая контрольный объем между концами створок митрального клапана. Максимальную скорость диастолического подъема основания ЛЖ в раннюю диастолу (e’) определяли при помощи импульсноволновой тканевой допплерографии из апикального доступа, устанавливая контрольный объем на митральное кольцо в области межжелудочковой перегородки и боковой стенки ЛЖ. Величину е’ получали путем усреднения скоростей из области межжелудочковой перегородки и боковой стенки ЛЖ. Значения отношения E/е’ усредняли из 3 последовательных сердечных циклов.
В статистическую обработку включали только результаты обследования пациентов, полностью выполнивших протокол исследования. Применяли пакет прикладных программ Statistica 6.1. Образовавшиеся группы проверяли на нормальность распределения с помощью одностороннего теста Колмогорова—Смирнова. Все данные представлены в виде средней арифметической (М), стандартного отклонения средней арифметической (SD). Достоверность различий показателей по количественным признакам определяли по критерию t Стьюдента, по качественным — с использованием критерия χ2, признавая их статистически значимыми при р<0,05.
Результаты
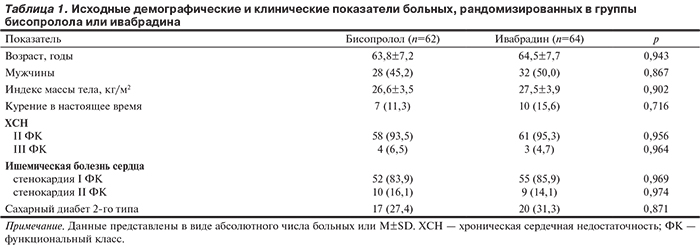
Сформированные 2 группы пациентов оказались хорошо сбалансированными по ряду показателей (табл. 1).
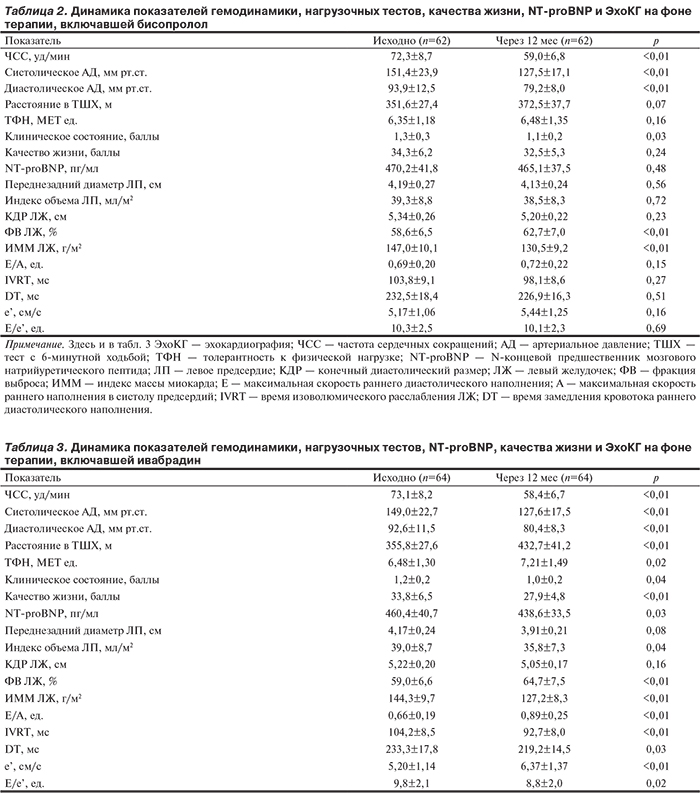
Изменения некоторых показателей гемодинамики, нагрузочных тестов, биохимического исследования крови, качества жизни и ЭхоКГ в процессе длительной терапии, включавшей бисопролол или ивабрадин, представлены в табл. 2 и 3.
Наличие у обследованных диастолической дисфункции ЛЖ 1-го типа подтверждалось величиной E/A менее 0,8 (с учетом возраста), IVRT более 100 мс и DT более 200 мс, дилатацией ЛП. При этом отношение Е/е’ не превышало 15, что позволяло констатировать отсутствие явного повышения конечного диастолического давления в ЛЖ в покое, характерного для более тяжелого 2-го типа диастолической дисфункции ЛЖ.
В обеих группах удавалось обеспечить желаемое урежение ЧСС под действием средней дозы бисопролола 6,3±3,4 мг/сут, ивабрадина — 13,5±1,6 мг/сут. Для достижения целевого уровня артериального давления в большинстве случаев применяли периндоприл/амлодипин в начальной дозе 5/5 мг/сут (66,1 и 57,8% случаев в группах бисопролола и ивабрадина соответственно; р>0,05). Среднее расстояние, пройденное в ТШХ, и толерантность к физической нагрузке (ТФН) существенно увеличивались только при лечении ивабрадином. Кроме того, только в группе ивабрадина повышалось качество жизни пациентов, снижались уровень NT-proBNP и индекс объема ЛП. В обеих группах при длительной терапии происходило увеличение ФВ ЛЖ и значительное уменьшение его гипертрофии. При этом важнейшие показатели диастолической функции ЛЖ улучшались только в группе ивабрадина.
Обсуждение
За прошедшие годы XXI века снизилась доля исследований у пациентов с ХСН, которые завершились позитивным результатом. Последний чаще достигался в небольших проектах с высокой пропорцией так называемых суррогатных конечных точек [16]. На этом фоне обращают внимание полученные в исследовании SHIFT доказательства снижения риска смерти от сердечно-сосудистых заболеваний и госпитализации по поводу ХСН при назначении ивабрадина больным со сниженной ФВ ЛЖ и частотой синусового ритма 70 уд/мин и более, которые, как полагают, нельзя объяснить лишь урежением ЧСС [17, 18]. Ивабрадин оказался эффективным в лечении пациентов с ХСН и разнообразной сочетанной патологией (АГ, перенесенные инсульт или инфаркт миокарда, атеросклероз периферических артерий, сахарный диабет, хроническая обструктивная болезнь легких, нарушенная функция почек, анемия) [19].
Лишь в 5,8% из 154 современных исследований у больных с ХСН все участники имели сохраненную ФВ ЛЖ [16]. Первые результаты применения ивабрадина у пациентов с ХСН и сохраненной ФВ ЛЖ оказались противоречивыми [20, 21]. В нашей работе ивабрадин в отличие от бисопролола увеличивал среднее расстояние, пройденное в ТШХ, и ТФН, улучшая качество жизни больных. Эти данные согласуются с представлениями о снижении переносимости нагрузки при ХСН с сохраненной ФВ ЛЖ вследствие нарушения адренергической активации [22]. Отрицательные инотропный и люситропный эффекты β-адреноблокаторов способны напрямую увеличивать жесткость кардиомиоцитов [23]. В нашем исследовании только в группе лечения ивабрадином отмечалось улучшение активного расслабления и податливости ЛЖ, на что указывала динамика эхокардиографических показателей. Недавно U. Fischer-Rasokat и соавт. [24] показали, что перевод 24 больных ИБС с приема β-адреноблокаторов на ивабрадин приводит к снижению давления наполнения ЛЖ и улучшению ответа ударного объема на физическую нагрузку в подгруппе (n=13) с Е/е' больше 8, что согласуется с полученными нами данными.
В нашей работе ивабрадин снижал уровень NT-proBNP и индекс объема ЛП. Имеют ли практическое значение эти результаты? По результатам мета-анализа индивидуальных данных участников рандомизированных исследований (n=2137), терапия с учетом динамики уровня NT-proBNP снижает смертность и частоту госпитализаций по поводу ХСН у больных со сниженной, но не с сохраненной ФВ ЛЖ [25]. В то же время в исследовании I-PRESERVE у пациентов с ХСН и сохраненной ФВ ЛЖ повышение уровня NT-proBNP было связано с увеличением риска сердечно-сосудистой смерти или госпитализации с ХСН, а снижение — с тенденцией к уменьшению их частоты [26]. По мнению авторов работы, уровень NT-proBNP может являться предиктором прогноза для больных с ХСН и сохраненной ФВ ЛЖ. Кроме того, в исследовании TOPCAT уменьшение объема ЛП ассоциировалось со снижением риска наступления первичной комбинированной конечной точки (сердечно-сосудистая смерть, госпитализация из-за ХСН и успешная реанимация при остановке сердца) у пациентов с ХСН и сохраненной ФВ ЛЖ [27].
Лечение больных с ХСН и сохраненной ФВ ЛЖ остается в значительной степени эмпирическим, проводится практически в отсутствие общепризнанных стандартов. Слабые результаты (или их отсутствие) при лечении больных с ХСН и сохраненной ФВ ЛЖ препаратами, улучшающими прогноз при сниженной ФВ ЛЖ, по мнению A.M. Katz и E.L. Rolett, объясняются различиями в молекулярных сигналах, которые инициируют дилатацию и концентрическую гипертрофию ЛЖ [28]. Ивабрадину присущи эффекты, способные позитивно влиять при различной патологии [29], в том числе ХСН с сохраненной ФВ ЛЖ. Среди них ускорение релаксации миокарда путем повышения фосфорилирования фосфоламбана и последующего стимулирования кальциевой аденозинтрифосфатазы саркоплазматической сети, увеличение податливости миокарда благодаря уменьшению экспрессии изоформы N2B тайтина и образования коллагена в миокарде, уменьшение жесткости артериальной стенки и улучшение функции эндотелия [30—32]. Нарушение последней, в том числе на уровне микроциркуляции, выявляется у пациентов с ХСН и сохраненной ФВ ЛЖ [33, 34]. Кардиопротективное действие ивабрадина при ишемии миокарда в эксперименте реализуется даже в условиях устранения его отрицательного хронотропного эффекта благодаря увеличению производства АТФ как в митохондриях, так и вне митохондрий, улучшению способности удержания кальция [35]. Между тем в клиническом исследовании SIGNIFY не удалось улучшить клинические исходы у больных со стабильной ИБС без клинических проявлений ХСН [36], что могло быть связано с применением нерекомендованной дозы ивабрадина 10 мг 2 раза в день в дополнение к β-адреноблокаторам. Европейское медицинское агентство уточнило, что ивабрадин может использоваться в дозах 2,5—7,5 мг 2 раза в день для облегчения симптомов у пациентов со стабильной ИБС [37].
Два современных препарата (LCZ696 и ивабрадин) рассматриваются в качестве перспективных у пациентов с ХСН и сохраненной ФВ ЛЖ [38]. Первый из них в настоящее время изучается при данной патологии в крупном рандомизированном проекте PARAGON-HF, результаты которого планируется получить в 2019 г. Однако уже очевидна проблема лечения с помощью LCZ696. Стоимость терапии одного пациента составляет 12,5 долларов США в сутки и примерно 4500 долларов в год. В другое многоцентровое исследование планируется включить около 400 пациентов с ХСН и сохраненной ФВ ЛЖ, у которых будет оцениваться влияние ивабрадина на диастолическую функцию ЛЖ, уровень NT-proBNP и ТФН (www.clinicaltrialsregister.eu-EUCTR2012-002742-20-DE).
Таким образом, лечение больных с ХСН и сохраненной ФВ ЛЖ на фоне гипертонической болезни и ИБС ивабрадином, но не бисопрололом, существенно повышает ТФН и качество жизни пациентов. В отличие от бисопролола ивабрадин улучшает эхокардиографические показатели активного расслабления и податливости ЛЖ у данного контингента больных.



