В настоящее время не менее 6% взрослого населения в большинстве стран мира имеют хроническую обструктивную болезнь легких (ХОБЛ) [1]. Наличие ХОБЛ у больного повышает риск развития сердечно-сосудистых заболеваний (ССЗ) в 2—3 раза [2].
В настоящее время ХОБЛ рассматривают как независимый фактор риска развития сердечно-сосудистых осложнений (ССО), включая смерть [3]. Крупные эпидемиологические исследования продемонстрировали, что ведущей причиной смерти больных ХОБЛ является не дыхательная недостаточность, как традиционно принято считать, а ССО [4, 5]. Анализ данных литературы свидетельствует о высокой распространенности ишемической болезни сердца (ИБС) у больных ХОБЛ: от 21 до 61,7% [6, 7]. Около 30% пациентов с ХОБЛ имеют различную степень тяжести хронической сердечной недостаточности (ХСН) [8, 9]. У пациентов с ХОБЛ заболеваемость фибрилляцией предсердий (ФП) выше, чем у лиц без ХОБЛ [10, 11].
Распространенность артериальной гипертензии (АГ) у пациентов с ХОБЛ варьируется от 6,8 до 76,3%, составляя в среднем 35% [12].
К основным «сложностям» терапии ССЗ у пациентов с сопутствующей ХОБЛ относят:
- необходимость учета взаимодействия лекарственных средств базисной терапии ССЗ и ХОБЛ;
- низкое качество жизни и приверженности лечению у больных ССЗ и ХОБЛ;
- возможность ухудшения течения одного из сопутствующих заболеваний при назначении «стандарта» лечения (например, β-адреноблокаторов для терапии ХСН и агонистов β-рецепторов у пациентов с ХОБЛ).
 Результаты исследования ССР (COOPERATIVE CARDIOVASCULAR PROJECT, 2000) показывают, что риск смерти в течение 2 лет у больных ХОБЛ, перенесших острый инфаркт миокарда (ОИМ), без терапии β-адреноблокаторами составляет 27,8%, а на фоне лечения β-адреноблокаторами — всего 16,8%. Снижение риска смерти таких больных на фоне терапии β-адреноблокаторами составляет 40%! Эти цифры заставляют задуматься над тем, всегда ли обоснованно врачи избегают назначения β-адреноблокаторов больным ХОБЛ?
Результаты исследования ССР (COOPERATIVE CARDIOVASCULAR PROJECT, 2000) показывают, что риск смерти в течение 2 лет у больных ХОБЛ, перенесших острый инфаркт миокарда (ОИМ), без терапии β-адреноблокаторами составляет 27,8%, а на фоне лечения β-адреноблокаторами — всего 16,8%. Снижение риска смерти таких больных на фоне терапии β-адреноблокаторами составляет 40%! Эти цифры заставляют задуматься над тем, всегда ли обоснованно врачи избегают назначения β-адреноблокаторов больным ХОБЛ?
Основная проблема при выборе препарата из группы β-адреноблокаторов — наличие обструкции бронхов, лимитирующей, а то и просто служащей противопоказанием к их назначению [13].
Большое значение для клиники имеет степень кардиоселективности, т.е. влияние на β1- и β2-рецепторы: у метопролола это соотношение составляет 1:20, у атенолола — 1:35, у бисопролола — 1:75 [14]. Небиволол превосходит бисопролол по кардиоселективности в 3,5 раза. Кардиоселективность β-адреноблокаторов снижается или полностью исчезает при применении высоких доз препаратов [15].
В 2002 г. были опубликованы результаты мета-анализа 19 плацебо-контролируемых исследований, в которых использовали атенолол, метопролол, бисопролол, практолол, целипролол и ацебутолол [16]. Было установлено, что применение этих β-адреноблокаторов не отличается от плацебо по влиянию на вентиляционные и дыхательные симптомы при применении β2-агонистов. Это позволило авторам сделать вывод о том, что кардиоселективные β-адреноблокаторы не ухудшают дыхательную функцию и безопасны к применению у больных ХОБЛ [17].
Эксперты GOLD (Global Initiative for Chronic Obstructive Lung Disease; 2013) считают, что преимущества применения кардиоселективных β-адреноблокаторов при ИБС превышают потенциальные риски, связанные с лечением, даже у пациентов с тяжелой ХОБЛ.
Большинству пациентов со стенокардией либо после перенесенного ОИМ показаны β-адреноблокаторы. Главная проблема при выборе препарата из группы β-адреноблокаторов — наличие обструкции бронхов [18, 19].
Помимо кардиоселективности β-адреноблокаторы различаются по наличию дополнительных свойств, а также по продолжительности действия [20]. Бисопролол удачно сочетает достоинства жиро- и водорастворимых β-адреноблокаторов: высокую эффективность, длительный период полувыведения и небольшое число побочных эффектов [21, 22]. Бисопролол выводится двумя путями, что позволяет назначать его при нарушениях функции как печени, так и почек.
Лечение ХСН у пациентов с ХОБЛ должно проводиться в соответствии с национальными и международными рекомендациями, так как нет доказательств того, что при ХОБЛ медикаментозная терапия требует коррекции. Лечение кардиоселективными β-адреноблокаторами считается безопасным для пациентов с ХСН, которые также имеют ХОБЛ [23].
Лечение бисопрололом при ХСН с сопутствующей ХОБЛ приводит к незначительному снижению объема форсированного выдоха за 1-ю секунду (ОФВ1), но без вредного воздействия на симптомы и качество жизни [24].
При лечении ФП у пациентов с ХОБЛ необходимо руководствоваться общими принципами ведения больных с ФП, так как нет доказательств того, что пациенты с ХОБЛ нуждаются в особом подходе к терапии. Если есть потребность в использовании β-адреноблокаторов, то предподчтение отдается кардиоселективным препаратам [25].
Согласно Национальным рекомендациям по диагностике и лечению АГ, у больных ХОБЛ возможно назначение небольших доз метопролола сукцината замедленного высвобождения, бисопролола, небиволола и карведилола [26].
Кардиоселективные β-адреноблокаторы следует назначать больным ХОБЛ с АГ в малых дозах под контролем электрокардиограммы и проходимости бронхов. Для измерения степени ограничения скорости воздушного потока всем больным ХОБЛ рекомендовано исследование функции внешнего дыхания (ФВД) с применением спирометрии. При появлении клинических симптомов ухудшения проходимости бронхов и неблагоприятном влиянии на показатели ФВД дозу β-адреноблокаторов следует уменьшить, а при сохранении снижения ФВД — отменить [25].
Каковы преимущества высокоселективных β-адреноблокаторов перед другими группами антигипертензивных препаратов первого ряда?
Во-первых, кардиоселективные БАБ не влияют на клиренс мокроты, в то время как диуретики могут ухудшать течение ХОБЛ за счет сгущения мокроты и затруднения ее отхождения.
Во-вторых, кардиоселективные β-адреноблокаторы не оказывают прокашлевого действия. Следует помнить, что одним из побочных эффектов ингибиторов ангиотензинпревращающего фермента является сухой кашель (до 10% случаев) за счет накопления брадикинина, субстанции Р и увеличения продукции оксида азота в дыхательных путях, что также может стимулировать кашлевой рефлекс и бронхоспазм у больного ХОБЛ [16].

Таким образом, в настоящее время получены данные о безопасности и эффективности применения кардиоселективных β-адреноблокаторов у больных АГ, ССЗ и ХОБЛ, но работы, посвященные оценке клинической эффективности и безопасности применения бисопролола по сравнению с метопрололом сукцинатом замедленного высвобождения у больных АГ, ССЗ в сочетании с ХОБЛ единичны.
Цель исследования: оценить эффективность и безопасность применения бисопролола (бипрол, ООО «Штада Маркетинг», Россия) по сравнению с метопрололом сукцинатом замедленного высвобождения у больных АГ в сочетании с ССЗ и ХОБЛ.
Материал и методы
Проведено открытое проспективное рандомизированное сравнительное 12-недельное исследование по изучению влияния бисопролола и метопролола сукцината замедленного высвобождения в процессе 12-недельной базисной терапии на клинико-демографические показатели, суточный профиль артериального давления (АД), морфофункциональные параметры сердца и показатели ФВД у больных АГ в сочетании с ССЗ и ХОБЛ. В исследование были включены 60 пациентов в возрасте 45—70 лет с АГ II—III стадии по классификации Всероссийского научного общества кардиологов (ВНОК, 2008), сопутствующими ССЗ, ХОБЛ I—III степени тяжести по классификации GOLD (2013).
В 1-ю (основную) группу вошли 30 пациентов, получавших бисопролол 1 раз в сутки перорально. Во 2-ю (контрольную) группу вошли 30 пациентов, которые получали метопролола сукцинат замедленного высвобождения 1 раз в сутки перорально. При необходимости добавляли ингибиторы ангиотензинпревращающего фермента, антиагрегант, статин, антагонисты кальция, нитраты, антагонисты альдостерона и диуретики.
Группы больных были сопоставимы по возрасту, полу, тяжести заболевания. Характеристика больных представлена в табл. 1.
Анализ нарушений ритма сердца проводили при регистрации электрокардиограммы (ЭКГ) в 12 отведениях и при проведении холтеровского мониторирования ЭКГ в течение 24 ч на аппарате ИКАР. Изучение суточного профиля АД выполняли методом суточного мониторирования АД (СМАД) аппаратом ABPM. Оценку морфофункционального состояния сердца проводили с помощью эхокардиографии по общепринятой методике на аппарате SIЕMENS SONOLINE G50 с допплеровским датчиком, позволяющим работать в М- и В-режимах, а также имеющим энергетический допплеровский датчик, дающий возможность определять в импульсноволновом режиме диастолическую функцию левого желудочка (ЛЖ) в соответствии с общепринятыми рекомендациями. ФВД изучали по общепринятой методике на аппарате SPIROSIFT FUKUDA 3000 (Япония). Определяли ОФВ1, форсированную жизненную емкость легких (ФЖЕЛ), индекс Генслера (ОФВ1/ФЖЕЛ), мгновенную объемную скорость в момент выдоха 25% ФЖЕЛ (МОС25), 50% ФЖЕЛ (МОС50), 75% ФЖЕЛ (МОС75). С помощью пикфлоуметра Пульмотест (Россия) оценивали пиковую объемную скорость выдоха (ПОС выд., л/мин). Рассчитывали индекс курящего человека (ИКЧ). Всем больным определяли насыщение крови кислородом на пульсоксиметре МР 110. Выраженность одышки оценивали по модифицированной шкале Borg, визуальной аналоговой шкале (ВАШ) и модифицированной шкале mMRС (Medical Research Council Dyspnоea Scale).
Контроль безопасности терапии. Оценивали эффективность лечения, наличие или отсутствие побочных эффектов и осложнений терапии. При необходимости выполняли ее коррекцию. Регистрация нежелательных явлений в период лечения осуществлялась пациентом в «Дневнике самоконтроля». Во время визитов исследователь проводил анализ нежелательных явлений с использования метода открытого стандартного вопроса. Кроме того, выполнялся мониторинг лабораторных и инструментальных показателей, которые могли бы свидетельствовать о развитии нежелательных лекарственных реакций.

Статистическую обработку данных исследования проводили методами параметрического и непараметрического анализов. Статистически значимыми считали различия при р<0,05.
Результаты и обсуждение
Через 12 нед терапии бисопрололом достоверно уменьшилось число пациентов с регистрируемыми желудочковыми экстрасистолами (ЖЭ) по ЭКГ или холтеровскому мониторированию ЭКГ: ∆%=-16,7 (табл. 2). В группе больных, получавших метопролола сукцинат замедленного высвобождения, также отмечено снижение частоты регистрации ЖЭ (∆%=-10), но различия не достигли статистической значимости. В обеих группах уменьшилось число пациентов с наджелудочковыми экстрасистолами — НЖЭ (∆%=-26,7 в 1-й группе против ∆%=-16,7 во 2-й группе; p<0,01). На фоне 12-недельной терапии β-адреноблокаторами улучшились показатели StO2 в обеих группах (∆%=0,6 в основной и ∆%=0,5 в контрольной).
Отмечено статистически значимое снижение уровней офисного систолического АД (САД) и диастолического АД (ДАД): 127,2±2,3 мм рт. ст. через 12 нед терапии бисопрололом против 136,7±3,8 мм рт.ст. исходно, ∆%=-6,9; 77,9±1,0 мм рт.ст. через 12 нед терапии бисопрололом против 83,0±1,9 мм рт.ст. исходно, ∆%=-6,1 соответственно и 122,5±2,7 мм рт.ст. через 12 нед терапии метопрололом сукцинатом замедленного высвобождения против 130,0±2,6 мм рт.ст. исходно, ∆%=-5,8; 80,0±1,1 мм рт.ст. через 12 нед терапии метопрололом сукцинатом замедленного высвобождения против 85,0±1,8 мм рт.ст. исходно, ∆ %=-5,9 соответственно.
По данным оценки влияния бисопролола и метопролола сукцината замедленного высвобождения на показатели СМАД у пациентов с АГ, ССЗ и ХОБЛ, получены следующие результаты (табл. 3).
Установлено статистически значимое снижение САД среднее и ДАД среднее за 1 сут на 8,6 и 10,3% соответственно в группе больных, получавших бисопролол, и на 8,2 и 9,8% соответственно — в группе больных, получавших метопролола сукцинат замедленного высвобождения. Достоверно снизилась частота сердечных сокращений (ЧСС) в обеих группах (на 11,9% в основной и на 10,7% в контрольной).
Через 12 нед терапии отмечено незначительное улучшение систолической функции сердца — увеличение фракции выброса (ФВ) левого желудочка (ЛЖ), более выраженное в группе больных, получавших бисопролол, по сравнению с группой больных, получавших метопролола сукцинат замедленного высвобождения (∆%=2,8 и ∆%=0,4 соответственно; табл. 4). Уменьшился индекс массы миокарда ЛЖ (ИММЛЖ) на 1,6% в основной группе и на 1% – в контрольной группе. У всех больных в обеих группах отмечена диастолическая дисфункция (ДД) I стадии, которая сохранялась на фоне терапии β-адреноблокаторами.
Прогностически наиболее неблагоприятным типом ремоделирования ЛЖ считается концентрическая гипертрофия (КГ) ЛЖ. Через 12 нед терапии бисопрололом отмечена тенденция к уменьшению числа пациентов с КГЛЖ на 16,6% (с 83,3% исходно против 66,7% через 12 нед терапии; р<0,1) за счет уменьшения относительной толщины стенки (ОТС) ЛЖ и увеличения числа пациентов с более благоприятным типом ремоделирования ЛЖ — эксцентрической гипертрофией (ЭГ) ЛЖ (табл. 5). В группе пациентов, получавших метопролола сукцинат замедленного высвобождения, статистически значимых изменений при распределении их по типу ремоделирования ЛЖ не обнаружено (см. табл. 5).
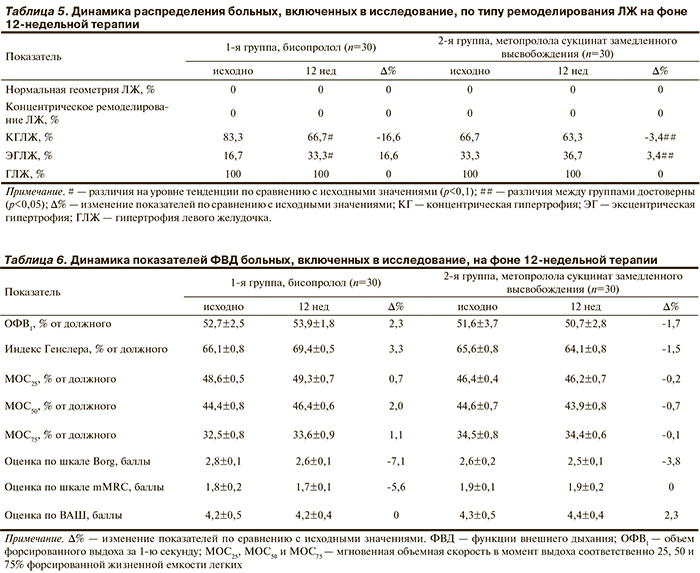
Через 12 нед терапии бисопрололом отмечено некоторое улучшение показателей ФВД (табл. 6): увеличение ОФВ1 и индекса Генслера (на 2,3 и 3,3% соответственно), улучшение проходимости на уровне мелких, средних и крупных бронхов (∆%=0,7, ∆%=2,0, ∆%=1,1 для МОС25, МОС50 и МОС75 соответственно). Кроме того, в основной группе уменьшилась выраженность одышки, по результатам оценки по шкалам Borg и mMRC (∆%=-7,1 и ∆%=-5,6 соответственно). Иная ситуация сложилась во 2-й группе: 12-недельная терапия метопрололом сукцинатом замедленного высвобождения привела к незначительному снижению отношения ОФВ1 на 1,7% и ОФВ1/ФЖЕЛ на 1,5% с одновременным незначительным ростом сопротивления дыхательных путей на периферии (∆%=-0,2, ∆%=-0,7 и ∆%=-0,1 соответственно для МОС25, МОС50, МОС75).
В контрольной группе отмечено менее выраженное снижение выраженности одышки по шкале Borg (на 3,8%) и даже незначительный рост ее при оценке по ВАШ на 2,3%.
Выводы
Результаты исследования свидетельствуют о высокой антигипертензивной эффективности и хорошей переносимости терапии бисопрололом (бипролом) и метопрололом сукцинатом замедленного высвобождения у больных артериальной гипертензией в сочетании с сердечно-сосудистыми заболеваниями и хронической обструктивной болезнью легких. Двенадцатинедельная терапия бисопрололом и метопрололом сукцинатом замедленного высвобождения у больных артериальной гипертензией, сердечно-сосудистыми заболеваниями и хронической обструктивной болезнью легких достоверно улучшает параметры суточного мониторирования артериального давления: уменьшает среднее систолическое артериальное давление и среднее диастолическое артериальное давление, а также нагрузку давлением в течение суток, хорошо контролирует частоту сердечных сокращений.
Статистически значимо снижается частота нарушений ритма сердца (наджелудочковых и желудочковых экстрасистол) на фоне 12-недельного лечения бисопрололом у больных артериальной гипертензией в сочетании с сердечно-сосудистыми заболеваниями и хронической обструктивной болезнью легких. По сравнению с метопрололом сукцинатом замедленного высвобождения бисопролол более эффективен в уменьшении числа желудочковых экстрасистол у больных артериальной гипертензией в сочетании с сердечно-сосудистыми заболеваниями и хронической обструктивной болезниью легких.
Через 12 нед терапии бисопрололом отмечена тенденция к уменьшению числа пациентов с концетрической гипертрофией левого желудочка на 16,6% (с 83,3% исходно против 66,7% через 12 нед терапии; р<0,1).
Бисопролол не ухудшает основные параметры функции внешнего дыхания: объем форсированного выдоха за 1-ю секунду, индекс Генслера, мгновенную объемную скорость в момент выдоха 25, 50 и 75% форсированной жизненной емкости легких, не усиливает степень выраженности одышки у больных АГ в сочетании с сердечно-сосудистыми заболеваниями и хронической обструктивной болезнью легких. Несмотря на то что выявленные изменения в функции внешнего дыхания в обеих группах не достигли критерия достоверности, бисопролол по сравнению с метопрололом сукцинатом замедленного высвобождения в меньшей степени влиял на показатели функции внешнего дыхания и в большей степени — на уменьшение выраженности одышки, по результатам оценки шкал Borg и mMRC (∆%=-7,1 в основной vs ∆%=-3,8 – в контрольной группах и ∆%=-5,6 vs ∆%=0 соответственно) у больных артериальной гипертензией, сердечно-сосудистыми заболеваниями и хронической обструктивной болезнью легких.



