Ишемическая болезнь сердца (ИБС), инсульт, хроническая обструктивная болезнь легких (ХОБЛ), респираторные инфекции нижних дыхательных путей и рак легких в настоящее время являются пятью основными причинами смерти в мире [1], обусловливая суммарно около 22 млн смертей в год. ХОБЛ является частым коморбидным состоянием у больных ИБС [2] и вышла на четвертое место среди всех причин смерти в мире [3].
В последнее время широко обсуждаются механизмы тесной ассоциации ХОБЛ и ИБС, а также их взаимное влияние. Крупные эпидемиологические исследования продемонстрировали, что ведущей причиной смертности больных ХОБЛ легкого и среднетяжелого течения является не дыхательная недостаточность, а сердечно-сосудистые заболевания — ИБС и сердечная недостаточность [4, 5].
 Ангиопластика и стентирование коронарных артерий (КА) как методы лечения острого инфаркта миокарда (ИМ) и стабильной стенокардии напряжения получили широкое распространение в наши дни, и факторы, влияющие на ближайший и отдаленный прогнозы при этих вмешательствах, изучались во многих крупных исследованиях. В качестве сопутствующих патологий, влияние которых на прогноз обычно обсуждается, выступают сахарный диабет (СД) и хроническая болезнь почек. Во многом это объясняется возможностью ретроспективного использования данных, которые легко получить в ходе обычного обследования пациентов в клинике, при анализе регистров (такие параметры, как уровень креатинина и глюкозы в плазме крови определяют практически всегда). В то же время выполнение спирографии и бронходилатационных проб не является обязательным для коронарных больных, которым предполагается проведение чрескожных коронарных вмешательств (ЧКВ). Поэтому при анализе регистров используют данные анамнеза, далеко не во всех случаях верно отражающих ситуацию с наличием и тяжестью ХОБЛ у каждого пациента. Проспективные исследования, нацеленные на изучение прогноза после проведения ЧКВ с участием больных, у которых диагноз ХОБЛ был бы строго верифицирован, практически отсутствуют, что обосновывает актуальность нашего исследования.
Ангиопластика и стентирование коронарных артерий (КА) как методы лечения острого инфаркта миокарда (ИМ) и стабильной стенокардии напряжения получили широкое распространение в наши дни, и факторы, влияющие на ближайший и отдаленный прогнозы при этих вмешательствах, изучались во многих крупных исследованиях. В качестве сопутствующих патологий, влияние которых на прогноз обычно обсуждается, выступают сахарный диабет (СД) и хроническая болезнь почек. Во многом это объясняется возможностью ретроспективного использования данных, которые легко получить в ходе обычного обследования пациентов в клинике, при анализе регистров (такие параметры, как уровень креатинина и глюкозы в плазме крови определяют практически всегда). В то же время выполнение спирографии и бронходилатационных проб не является обязательным для коронарных больных, которым предполагается проведение чрескожных коронарных вмешательств (ЧКВ). Поэтому при анализе регистров используют данные анамнеза, далеко не во всех случаях верно отражающих ситуацию с наличием и тяжестью ХОБЛ у каждого пациента. Проспективные исследования, нацеленные на изучение прогноза после проведения ЧКВ с участием больных, у которых диагноз ХОБЛ был бы строго верифицирован, практически отсутствуют, что обосновывает актуальность нашего исследования.
Цель исследования: изучить отдаленные исходы ЧКВ с имплантацией стентов в зависимости от наличия ХОБЛ.
Материал и методы
В проспективное когортное исследование с параллельными группами были включены 346 больных ИБС, которым в 2012—2013 гг. в Центре грудной хирургии Краснодара было выполнено ЧКВ с имплантацией стентов. Критерии включения в основную группу: возраст 40 лет и старше; курение на момент поступления либо прекращение курения не более чем за 1 год до момента госпитализации; анамнез курения не менее 10 пачко-лет; наличие ИБС — стабильной стенокардии напряжения либо острого коронарного синдрома (ОКС) с окончательным диагнозом «ИМ» или «нестабильная стенокардия»; имплантация одного коронарного стента или более (голометаллических либо с лекарственным покрытием) с полным восстановлением кровотока в инфаркт-связанной артерии без ангиографических признаков остаточного стеноза, диссекции или дистальной эмболизации; ХОБЛ, диагностированная в соответствии со спирографическими критериями GOLD (2011), согласно которым постбронходилатационное значение объема формированного выдоха за 1-ю секунду (ОФВ1), отнесенное к величине форсированной жизненной емкости легких (ФЖЕЛ), должно быть менее 0,70, а степень тяжести заболевания определяется исходя из значения ОФВ1.
 Критерии исключения: фракция выброса (ФВ) левого желудочка (ЛЖ) менее 35%; пороки сердца при наличии показаний к их хирургической коррекции; бронхиальная астма; активный туберкулез; интерстициальные заболевания легких; идиопатическая легочная артериальная гипертензия; легочная тромбоэмболическая болезнь; системные заболевания соединительной ткани; злокачественные новообразования; торакотомия с резекцией легкого в анамнезе; реваскуляризация миокарда в анамнезе; развитие осложнений при выполнении ЧКВ: диссекция, перфорация либо разрыв КА, феномен «no-reflow». Контрольная группа была сформирована исходя из тех же критериев включения, что и основная, кроме наличия ХОБЛ, которая была исключена на основании данных спирографии. Критерии исключения были те же, что и для основной группы. Поскольку число больных, удовлетворявших критериям включения в контрольную группу, многократно превышало число больных, соответствующих критериям включения в основную группу, с целью уменьшения дисбаланса в численности групп включение пациентов в контрольную группу проводилось по таблице случайных чисел из числа подходящих кандидатов.
Критерии исключения: фракция выброса (ФВ) левого желудочка (ЛЖ) менее 35%; пороки сердца при наличии показаний к их хирургической коррекции; бронхиальная астма; активный туберкулез; интерстициальные заболевания легких; идиопатическая легочная артериальная гипертензия; легочная тромбоэмболическая болезнь; системные заболевания соединительной ткани; злокачественные новообразования; торакотомия с резекцией легкого в анамнезе; реваскуляризация миокарда в анамнезе; развитие осложнений при выполнении ЧКВ: диссекция, перфорация либо разрыв КА, феномен «no-reflow». Контрольная группа была сформирована исходя из тех же критериев включения, что и основная, кроме наличия ХОБЛ, которая была исключена на основании данных спирографии. Критерии исключения были те же, что и для основной группы. Поскольку число больных, удовлетворявших критериям включения в контрольную группу, многократно превышало число больных, соответствующих критериям включения в основную группу, с целью уменьшения дисбаланса в численности групп включение пациентов в контрольную группу проводилось по таблице случайных чисел из числа подходящих кандидатов.
Оценку клинического состояния больных проводили исходно и в динамике с использованием общепринятых методов (опрос, осмотр, физическое исследование).
Для оценки исходного состояния всем пациентам выполняли спирографию, согласно рекомендациям Американского торакального общества (2005), а при наличии обструктивных нарушений — бронходилатационный тест с сальбутамолом в дозе 400 мкг. Кроме того, всем пациентам выполняли тест с 6-минутной ходьбой (ТШХ), электрокардиографию, эхокардиографию по общепринятой стандартной методике в М- и В-режимах (измерение размеров полостей сердца, толщины стенок, ФВ ЛЖ и др.) в соответствии с рекомендациями Американского общества эхокардиографии (2005). Всем больным выполняли плановую, а при ОКС — ургентную коронарографию.
 Диагноз стабильной стенокардии устанавливали по общепринятым критериям на основании клинических признаков и результатов неинвазивных нагрузочных тестов под контролем электрокардиограммы, либо однофотонной эмиссионной компьютерной томографии миокарда с технецием-99m. Диагноз острого ИМ и нестабильной стенокардии устанавливали согласно критериям Европейского общества кардиологов (2011). Диагноз инсульта в качестве одного из регистрируемых исходов при наличии соответствующих клинических симптомов верифицировали с помощью компьютерной томографии головного мозга. Биохимическое исследование крови включало ряд показателей, определяемых в общепринятом порядке при поступлении больных в Центр грудной хирургии Краснодара (липидограмма, коагулограмма, тропонин I, глюкоза, креатинин, мочевина, трансаминазы, билирубин, электролиты и др.). Всем пациентам при выписке была назначена терапия статинами, антиагрегантами (ацетилсалициловая кислота и клопидогрел), ингибиторами ангиотензинпревращающего фермента (АПФ) или антагонистами рецепторов ангиотензина II (АРА II), по показаниям — β-адреноблокаторами. Необходимость приема каждого из лекарственных препаратов и режим дозирования были тщательно разъяснены пациентам.
Диагноз стабильной стенокардии устанавливали по общепринятым критериям на основании клинических признаков и результатов неинвазивных нагрузочных тестов под контролем электрокардиограммы, либо однофотонной эмиссионной компьютерной томографии миокарда с технецием-99m. Диагноз острого ИМ и нестабильной стенокардии устанавливали согласно критериям Европейского общества кардиологов (2011). Диагноз инсульта в качестве одного из регистрируемых исходов при наличии соответствующих клинических симптомов верифицировали с помощью компьютерной томографии головного мозга. Биохимическое исследование крови включало ряд показателей, определяемых в общепринятом порядке при поступлении больных в Центр грудной хирургии Краснодара (липидограмма, коагулограмма, тропонин I, глюкоза, креатинин, мочевина, трансаминазы, билирубин, электролиты и др.). Всем пациентам при выписке была назначена терапия статинами, антиагрегантами (ацетилсалициловая кислота и клопидогрел), ингибиторами ангиотензинпревращающего фермента (АПФ) или антагонистами рецепторов ангиотензина II (АРА II), по показаниям — β-адреноблокаторами. Необходимость приема каждого из лекарственных препаратов и режим дозирования были тщательно разъяснены пациентам.
Медиана длительности наблюдения составила 18 мес. Наблюдение за пациентами включало телефонные контакты с рядом стандартных вопросов, призванных предварительно оценить наступление регистрируемых клинических исходов, статус курения и комплаентность в отношении принимаемых лекарственных препаратов, способных влиять на сердечно-сосудистый прогноз, а также плановый визит в клинику через 6 мес либо внеплановый — при наступлении регистрируемого клинического исхода для его клинико-инструментального подтверждения. Пациенты были предупреждены о необходимости сообщать по телефону о предполагаемом случае наступления регистрируемого исхода. В настоящее время наблюдение за пациентами продолжается. Регистрировали следующие исходы: ИМ, инсульт, смерть вследствие сердечно-сосудистых причин, реваскуляризация миокарда (ЧКВ или аортокоронарное шунтирование — АКШ), а также определяли время до наступления исхода в месяцах.
Статистический анализ проводили с помощью программы Statistica 10.0. Данные представлены в виде среднего значения (M) и стандартного отклонения (SD); для описания долей использовали проценты. Для оценки различий между группами использовали непараметрический критерий Манна—Уитни. При сравнении долей применяли точный критерий Фишера и χ2-критерий. Для изучения времени до наступления исхода проводилось построение кривых Каплана—Мейера. С целью сравнения выживаемости в группах использовали критерий Гехана. Различия считали статистически значимыми при p<0,05.
Результаты
Клиническая характеристика больных представлена в табл. 1.
 По степени тяжести исходной патологии группы были сопоставимы, за исключением более низкой расчетной скорости клубочковой фильтрации (СКФ) в группе больных ХОБЛ. Меньшие расстояния в ТШХ в группе ХОБЛ были ожидаемыми за счет основного симптома ХОБЛ — одышки. Группы не различались по числу установленных стентов, а также по их характеристике: среднее число стентов на одного больного в основной группе составило 1,4, в контрольной — 1,3; стенты с лекарственным покрытием были установлены у 26 (25%) больных в основной группе и у 58 (24%) в контрольной. Через 6 мес от начала наблюдения в основной группе статины принимали 75%, двухкомпонентную антитромбоцитарную терапию — 86%, ингибиторы АПФ или АРА II — 78%, β-адреноблокаторы — 63%; в контрольной группе — 83%, 84, 72 и 71% соответственно (различия статистически незначимы).
По степени тяжести исходной патологии группы были сопоставимы, за исключением более низкой расчетной скорости клубочковой фильтрации (СКФ) в группе больных ХОБЛ. Меньшие расстояния в ТШХ в группе ХОБЛ были ожидаемыми за счет основного симптома ХОБЛ — одышки. Группы не различались по числу установленных стентов, а также по их характеристике: среднее число стентов на одного больного в основной группе составило 1,4, в контрольной — 1,3; стенты с лекарственным покрытием были установлены у 26 (25%) больных в основной группе и у 58 (24%) в контрольной. Через 6 мес от начала наблюдения в основной группе статины принимали 75%, двухкомпонентную антитромбоцитарную терапию — 86%, ингибиторы АПФ или АРА II — 78%, β-адреноблокаторы — 63%; в контрольной группе — 83%, 84, 72 и 71% соответственно (различия статистически незначимы).
Медиана длительности наблюдения была 17 мес в основной группе и 18 мес в контрольной. Сердечно-сосудистые осложнения (ССО), которые развились за время наблюдения, представлены в табл. 2. У 2 пациентов произошел ранний тромбоз стента (через 3 и 16 дней после выписки), который мы связали с достоверным прекращением приема антиагрегантов вопреки предписанию врача, поэтому данные исходы не были учтены в качестве отдаленных. Кроме того, не была зарегистрирована как наступление конечной точки смерть 3 пациентов, у 2 из которых причиной смерти явились злокачественные новообразования, а у 1 — дорожная травма.
У 4 больных за время наблюдения последовательно возникли 2 исхода из числа регистрируемых в соответствии с протоколом исследования: в группе ХОБЛ 1 больной первоначально перенес инсульт, а впоследствии был подвергнут АКШ, другому больному было проведено повторное ЧКВ в связи с рецидивом стенокардии, в дальнейшем этот пациент умер внезапно; в контрольной группе пациент перенес ИМ, а затем ему в плановом порядке было выполнено АКШ, другому пациенту было выполнено повторное ЧКВ в связи с рецидивом стенокардии, а в дальнейшем он перенес ИМ.
Относительный риск наступления комбинированной конечной точки (кардиальная смерть+ИМ+инсульт+АКШ+ЧКВ) для группы с сочетанием ИБС и ХОБЛ составил 1,33 (при 95% доверительном интервале от 0,85 до 2,10), т.е. эффект статистически незначим, однако продолжительность наблюдения на текущий момент не столь велика и наблюдение пациентов продолжается. Хотя различия по частоте развития исходов не достигли уровня статистической значимости, сравнение кривых выживаемости (время до наступления события) показало существенные различия — неблагоприятные исходы возникали раньше в группе больных, имевших ХОБЛ в качест-ве сопутствующей патологии (см. рисунок). Сам факт более раннего наступления исходов в основной группе при сохранении данной тенденции ожидаемо приведет с течением времени и к более высокой частоте самих исходов.
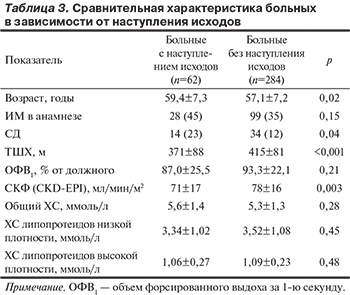
Были проанализированы клинико-функциональные особенности больных, у которых наступили ССО, по сравнению с теми, у кого за время наблюдения таких исходов не было. Результаты представлены в табл. 3.
Не было обнаружено статистической связи между наличием ИМ в анамнезе, значением ОФВ1, уровнями общего холестерина и его фракций и наступлением неблагоприятного исхода. В то же время такая связь была выявлена между возрастом, наличием СД, более низкой СКФ и меньшим расстоянием в ТШХ.
Обсуждение
Возраст, СД, сниженная СКФ являются известными факторами, увеличивающими риск развития ССО после ЧКВ, что подтвердили наши данные. ИМ в анамнезе также является известным фактором, отягощающим прогноз, однако в нашей выборке такой связи обнаружено не было, вероятнее всего, потому, что эта характеристика учитывала ИМ в прошлом, до поступления в клинику. В то же время почти 50% больных, включенных в наше исследование, были госпитализированы и подвергнуты ЧКВ в связи с развившимся ОКС, и они в большинстве своем не числились среди имевших ИМ в анамнезе. Показатели липидного обмена не имели связи с развитием ССО, по-видимому, потому, что многие пациенты принимали статины на момент поступления в клинику, остальным же статины были назначены либо в период госпитализации, либо на момент выписки. Результаты ТШХ имели наибольшую силу статистической связи с наступлением неблагоприятных исходов. Толерантность к физической нагрузке является интегральной характеристикой функционального состояния больного в целом и не только испытывает на себе влияние кардиопульмональной патологии, но и зависит от возраста, пола, индекса массы тела, патологии артерий нижних конечностей, степени тренированности и многих других факторов. У больных ХОБЛ расстояние в ТШХ оказалось значительно меньше, чем у больных ИБС без ХОБЛ (328±80 м против 440±60 м; p<0,001). Не было обнаружено связи между ОФВ1, являющегося важнейшей характеристикой тяжести ХОБЛ, и наступлением неблагоприятных исходов при анализе всей выборки целиком. Возможным объяснением служит нивелирующее влияние нормальных ОФВ1 у больных без ХОБЛ, поскольку в отсутствие бронхолегочной патологии ОФВ1 в пределах нормы не является фактором прогноза. Однако в группе больных ХОБЛ, рассматриваемой отдельно, несмотря на ее сравнительно небольшую численность, ОФВ1 у больных с ССО был меньше, чем у пациентов с благоприятным прогнозом (62±23% против 73±25%; p=0,07). Наиболее вероятное объяснение неблагоприятного влияния низкого ОФВ1 на прогноз состоит в обнаруженной в ряде работ связи между низкими ОФВ1 и выраженностью системного воспаления при ХОБЛ, что может ускорять течение атеросклеротического процесса и способствовать развитию нестабильности атеросклеротических бляшек [6, 7].
Накоплено достаточно информации для констатации того, что ИБС и ХОБЛ, сочетающиеся у одного больного, не являются независимо сосуществующими заболеваниями, развившимися в результате воздействия некоторых общих факторов риска. Признается, что ХОБЛ способна существенно изменять течение ИБС и наоборот [8, 9].
Среди наиболее обсуждаемых причин высокой частоты развития ССО у больных ХОБЛ такие патофизиологические феномены, как окислительный стресс, системный воспалительный ответ, гипоксемия, ремоделирование миокарда и др. [10]. Хроническое системное воспаление воздействует как на паренхиму дыхательных путей, так и на эндотелий сосудов [11]. Само системное воспаление инициируется и постоянно поддерживается общим триггером ИБС и ХОБЛ — курением [12, 13]. Поскольку одним из аргументов, часто используемых для объяснения неблагоприятного прогноза у больных с сочетанием ИБС и ХОБЛ, является более высокая частота курения у больных ХОБЛ, для исключения данного фактора в наше исследование были включены только курящие пациенты с длительным анамнезом курения. Системные эффекты хронического воспаления связаны с воздействием на сосудистую систему целого ряда факторов, задействованных в патогенезе ХОБЛ. Это провоспалительные цитокины — интерлейкин-1β, интерлейкин-6, интерлейкин-8, фактор некроза опухоли α и др., обнаруживаемые в крови, а также окислительный стресс. Кроме того, определенную роль в повреждающем воздействии на сосудистую стенку могут играть гипоксемия, снижение периферической чувствительности к инсулину и ряд других системных факторов [14, 15]. Имеются также данные о высокой реактивности тромбоцитов у пациентов с ХОБЛ, подвергшихся ЧКВ по поводу острого ИМ [16]. Для такой популяции пациентов особенно актуальна приверженность длительной адекватной антитромбоцитарной терапии.
В связи с этим ХОБЛ предстает не столько как сопутствующая патология, сколько в роли фактора, серьезно отягощающего прогноз при заболеваниях, связанных с атеросклерозом, прежде всего, за счет увеличения риска развития ССО, во многом снижая размер ожидаемого эффекта от реваскуляризации миокарда.
Заключение
Хроническая обструктивная болезнь легких является клинически значимым фактором неблагоприятного отдаленного прогноза у больных ишемической болезнью сердца, подвергнутых операции ЧКВ, и оказывает влияние независимо от курения. Больные ишемической болезнью сердца в сочетании с хронической обструктивной болезнью легких после проведения чрескожной коронарной васкуляризации характеризуются более ранним развитием сердечно-сосудистых осложнений: смерти вследствие сердечно-сосудистых причин, инфаркта миокарда, инсульта, необходимости проведения повторной реваскуляризация миокарда.



