Сердечно-сосудистые заболевания (ССЗ) продолжают лидировать среди причин инвалидности и смертности взрослого населения экономически развитых стран мира [1]. При этом ведущая роль принадлежит атеросклеротическому поражению сосудов, что ведет к развитию ишемической болезни сердца (ИБС) и цереброваскулярной патологии [2]. Несмотря на достигнутые успехи в лечении фатальных проявлений атеросклероза [3], дальнейшее снижение заболеваемости и смертности от ССЗ возможно лишь при условии повсеместной активной первичной и вторичной профилактики, направленной на коррекцию факторов риска [2].
Статины, в основе действия которых лежит ингибирование ГМГ-КоА-редуктазы, превращающей ГМГ-КоА в мевалоновую кислоту — предшественник стероидов, включая холестерин (ХС), являются в настоящее время наиболее эффективной группой лекарственных препаратов, гиполипидемическая и антиатерогенная активность которых подтверждена результатами многочисленных многоцентровых клинических исследований [4, 5], доказавших способность этих препаратов уменьшать вероятность фатальных сердечно-сосудистых осложнений, улучшать качество и продолжительность жизни [6, 7].
Для вторичной и особенно первичной профилактики атеросклероза особое значение придается сохранению функции сосудистого эндотелия [8], эластических свойств сосудистой стенки [9] и активности воспалительных процессов в ней, а ряд параметров, характеризующих морфологию (толщина комплекса интима—медиа – ТИМ) и жесткость сосудистой стенки, вошли в современные рекомендации как субклинические критерии поражения органов-мишеней [10].
Одним из эффективных статинов, обладающих указанными плейотропными свойствами, является аторвастатин, препарат третьего поколения статинов (первым статином, нашедшим клиническое применение, стал выделенный из Aspergillus terreus ловастатин, зарегистрированный в США в 1987 г.) [11]. Наряду с оригинальным препаратом (брендом), известным под названием липримар, имеющим огромную доказательную базу антиатеросклеротической эффективности, в мире производится целый ряд дженерических препаратов, содержащих аторвастатин. Несмотря на сложившееся в прежние годы недоверие к качеству и эффективности дженерических препаратов, отдельные дженерики показывают свою эффективность, которая сочетается с более низкой, в отличие от бренда, ценой, и потому их часто назначают кардиологи и терапевты. Одним из таких препаратов, содержащих аторвастатин, является торвакард (зентива, группа «Санофи»). Однако в настоящее время существует мало работ по оценке плейотропной эффективности дженерических препаратов, в связи с чем и было выполнено настоящее исследование.
 Цель работы: оценить плейотропные эффекты дженерического препарата, содержащего аторвастатин, — торвакарда у больных с хронической формой ишемической болезни сердца (ИБС) с легкой и умеренной гиперхолестеринемией.
Цель работы: оценить плейотропные эффекты дженерического препарата, содержащего аторвастатин, — торвакарда у больных с хронической формой ишемической болезни сердца (ИБС) с легкой и умеренной гиперхолестеринемией.
Материал и методы
Исследование выполнено в двух рандомизированных (рандомизация по критериям: уровень ХС и возраст) группах больных ИБС, со стабильной стенокардией напряжения II—III функционального класса (ФК), с хронической сердечной недостаточностью (ХСН) I—IIА стадии в сочетании с гиперхолестеринемией, в возрасте 53—65 лет (58,2±6,5 года). У 46 больных наблюдалась артериальная гипертония легкой либо средней степени тяжести. Критерии включения в исследование: стабильная стенокардия напряжения II—III ФК, верифицирована клинически и по результатам суточного мониторирования электрокардиограммы; наличие легкой и средней гиперхолестеринемии; отсутствие систематического приема статинов не менее 3 мес до включения в исследование, отсутствие противопоказаний к терапии статинами; наличие информированного согласия пациента. Из исследования исключали лиц с выраженной патологией дыхательной, гепаторенальной, пищеварительной, эндокринной систем; наследственной гиперлипидемией, ХСН более IIА стадии.
 После включения в исследование обе группы получали стандартную терапию (кардиоселективный β-адреноблокатор бисопролол 2,5—5 мг/сут; ингибитор ангиотензинпревращающего фермента периндоприл 10 мг/сут; блокатор кальциевых каналов амлодипин 2,5—5 мг/сут; ацетилсалициловая кислота — 75 мг/сут), при необходимости лечение дополняли пролонгированными нитратами (изосорбид-мононитрат 30—40 мг/сут). В течение 12 нед 20 пациентов с уровнем ОХС от 5,0 до 6,5 ммоль/л получали аторвастатин в дозе 10 мг/сут, 32 пациента с уровнем ОХС от 6,51 до 8,0 ммоль/л принимали аторвастатин 20 мг/сут. В отсутствие в течение первых 3 мес достижения целевых уровней ХС и ХС липопротеидов низкой плотности (ЛНП) дозу статинов увеличивали. В качестве препарата, содержащего аторвастатин, использовался торвакард (зентива).
После включения в исследование обе группы получали стандартную терапию (кардиоселективный β-адреноблокатор бисопролол 2,5—5 мг/сут; ингибитор ангиотензинпревращающего фермента периндоприл 10 мг/сут; блокатор кальциевых каналов амлодипин 2,5—5 мг/сут; ацетилсалициловая кислота — 75 мг/сут), при необходимости лечение дополняли пролонгированными нитратами (изосорбид-мононитрат 30—40 мг/сут). В течение 12 нед 20 пациентов с уровнем ОХС от 5,0 до 6,5 ммоль/л получали аторвастатин в дозе 10 мг/сут, 32 пациента с уровнем ОХС от 6,51 до 8,0 ммоль/л принимали аторвастатин 20 мг/сут. В отсутствие в течение первых 3 мес достижения целевых уровней ХС и ХС липопротеидов низкой плотности (ЛНП) дозу статинов увеличивали. В качестве препарата, содержащего аторвастатин, использовался торвакард (зентива).
Ежемесячно определяли липиды сыворотки крови — ОХС, триглицериды (ТГ), ХС ЛНП, ХС липопротеидов высокой плотности (ЛВП) прямым ферментативным методом (CHOD-PAP) при D500—550 нм с использованием реагентов Analitycon.
Уровень С-реактивного белка (СРБ) определяли количественно высокочувствительным иммунотурбидиметрическим методом на автоматическом биохимическом анализаторе с использованием многоточечной калибровки, набором Analiticon при D340 нм. Оценка уровня эндотелина-1 (ЭТ-1) в крови выполнена методом твердофазного иммуноферментного анализа с применением набора Biomedica на анализаторе Tecan при D405 нм. Референтные значения — 0,3—7,0 пг/мл. Для оценки дисфункции сосудистого эндотелия (ДЭ) исходно и через 3 мес терапии статинами проводили пробу с реактивной гиперемией (РГ) путем регистрации эндотелийзависимой вазодилатации (ЭЗВД) плечевой артерии (ПА) [12] методом цветового допплеровского картирования потока ультразвуковым сканером с исследованием линейного датчика 7 МГц в триплексном режиме с определением изменения диаметра (D) ПА в процессе РГ при максимальной скорости кровотока с расчетом коэффициента ДЭ [13].
Изменения D сосуда и скорости кровотока при РГ оценивали в процентах от исходной величины (ЭЗВД в норме составляет 10% и более, при ДЭ снижается). ТИМ определяли путем ультразвукового дуплексного сканирования общей сонной артерии — ОСА с использованием линейного датчика 7 МГц. ТИМ ОСА определяли в положении больного лежа при незначительном отклонении головы в противоположную сторону, на 1—1,5 см проксимальнее бифуркации ОСА по ее задней стенке.
Статистическую обработку данных проводили с использованием программы Statistica 6,0 и расчетом критерия t Стьюдента.
Результаты
У включенных в исследование больных средний уровень ОХС в сыворотке крови превышал норму и соответствовал легкой или умеренной степени гиперхолестеринемии. Отмечался повышенный уровень СРБ (высокочувствительный СРБ >3 мг/л), ЭТ-1 в сыворотке крови, а также пограничные значения ТИМ с обеих сторон ОСА. Из-за отсутствия различий между ТИМ слева и справа результаты были усреднены.
 При оценке ЭЗВД в пробе с РГ значения D0 ПА не различались между группами, а степень дилатации ∆ D02 ПА обследуемых больных составляла менее 10%, среди всех пациентов преобладали лица со степенью дилатации ПА в манжеточной пробе 7,5—3%. Средние исходные значения ∆ D02 в группах пациентов, принимавших аторвастатин по 10 и 20 мг/сут, составили 6,8 и 5,4% соответственно.
При оценке ЭЗВД в пробе с РГ значения D0 ПА не различались между группами, а степень дилатации ∆ D02 ПА обследуемых больных составляла менее 10%, среди всех пациентов преобладали лица со степенью дилатации ПА в манжеточной пробе 7,5—3%. Средние исходные значения ∆ D02 в группах пациентов, принимавших аторвастатин по 10 и 20 мг/сут, составили 6,8 и 5,4% соответственно.
Отсутствие статистически значимых различий между большинством значений основных исходных показателей в указанных рандомизированных группах, наличие единых критериев включения больных в исследование позволяют считать эти группы сопоставимыми.
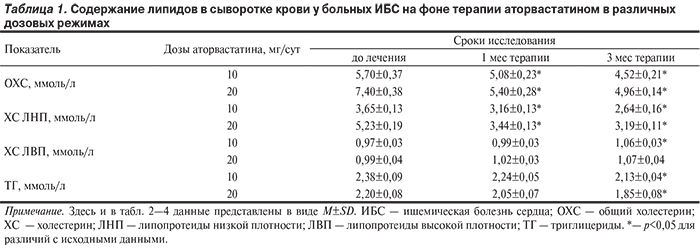
Применение аторвастатина сопровождалось позитивным изменением липидного состава крови, однако при использовании препарата не все параметры достигали целевого уровня (табл. 1, рис. 1), в связи с чем через 3 мес лечения и завершения исследования доза аторвастатина была увеличена.
При оценке концентрации СРБ в сыворотке крови у больных стабильной стенокардией напряжения на фоне лечения аторвастатином установлено, что через 1 мес приема аторвастатина 10 мг/сут уровень СРБ уменьшился на 25,3%, а через 3 мес терапии – на 45,5% (p<0,05) от исходных значений. У пациентов, принимавших аторвастатин 20 мг/сут, уровни СPБ сократились на 17,3 и 44,1% (p<0,05) через 1 и 3 мес лечения соответственно (табл. 2).
 При проведении пробы с РГ через 3 мес терапии аторвастатином 10 мг/сут достоверного увеличения диаметра ПА не выявлено, наблюдалось расширение ПА на 9,7% в группе пациентов, принимавших препарат в дозе 20 мг/сут. Прирост линейной скорости кровотока (∆V02) через 3 мес лечения аторвастатином 20 мг/сут составил 49,1%, прироста скорости кровотока на фоне терапии препаратом в дозе 10 мг/сут не выявлено (табл. 3).
При проведении пробы с РГ через 3 мес терапии аторвастатином 10 мг/сут достоверного увеличения диаметра ПА не выявлено, наблюдалось расширение ПА на 9,7% в группе пациентов, принимавших препарат в дозе 20 мг/сут. Прирост линейной скорости кровотока (∆V02) через 3 мес лечения аторвастатином 20 мг/сут составил 49,1%, прироста скорости кровотока на фоне терапии препаратом в дозе 10 мг/сут не выявлено (табл. 3).
Средние исходные значения ∆D02 в группах пациентов, получавших аторвастатин (10 и 20 мг/сут), составили 6,8 и 5,4% соответственно. Через 3 мес приема препарата 20 мг/сут прирост ∆ D02 ПА в пробе с РГ составил 46,3% (p<0,05). Прироста ∆ D02 ПА на фоне терапии аторвастатином 10 мг/сут не наблюдалось.
При сравнении степени изменения напряжения сдвига кровотока на эндотелии (τ, дин/см2) с его исходным значением (от 315,12 до 397,44 дин/см2 в покое (τ 0) и от 355,88 до 443,46 дин/см2 после РГ (τ 2) установлено, что терапия аторвастатином в двух дозовых режимах не влияла на уровень напряжения сдвига в покое. В пробе с РГ на фоне 3-месячной терапии препаратом 20 мг/сут отмечалось снижение τ 2 на 12,2% (p<0,05). При приеме препарата 10 мг/сут изменений τ 2 не зарегистрировано (табл. 4).
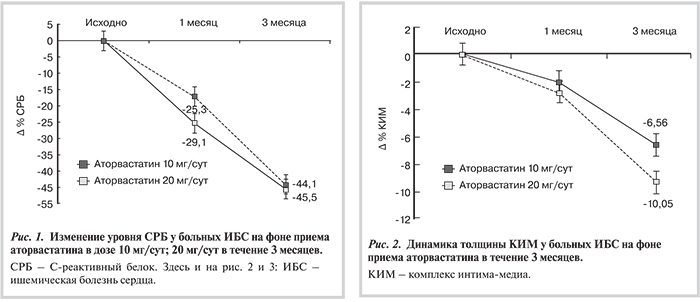
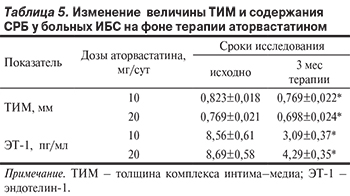
При лечении аторвастатином в двух дозовых режимах через 1 мес терапии ТИМ не изменилась, однако через 3 мес терапии ТИМ снизилась на 6,56% (p<0,05) у пациентов при лечении препаратом 10 мг/сут и на 9,23% (p<0,05) при лечении препаратом 20 мг/сут (табл. 5, рис.2).
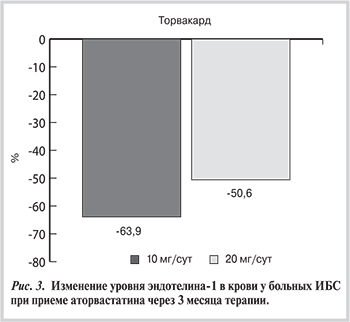
При оценке уровня ЭТ-1 в крови на фоне гиполипидемической терапии статинами, средняя исходная его концентрация составляла 8,56 и 8,69 пг/мл в группах пациентов, принимавших аторвастатин 10 и 20 мг/сут, соответственно. В ходе исследования установлено, что через 3 мес терапии данным препаратом 10 мг/сут уровень ЭТ-1 снизился на 63,9% (p<0,05), при лечении аторвастатином 20 мг/сут — на 50,6% (p<0,05) по сравнению с исходными значениями (табл.5).
На фоне курсового лечения аторвастатином (10 и 20 мг/сут) отмечена хорошая переносимость препаратов. В течение всего периода наблюдения при ежемесячной оценке в крови уровня –]печеночных трансаминаз активность аланинамино- и аспартатаминотрансферазы не превышали верхней границы нормы более чем в 2 раза, уровни креатинфосфокиназы и креатинина также находились в пределах нормы (рис.3).
Обсуждение
Таким образом, применение невысоких доз аторвастатина у больных с хронической формой ИБС сопровождалось снижением уровня СРБ, ЭТ-1, ТИМ, улучшением параметров ЭЗВД, что свидетельствует о позитивном влиянии препарата на морфофункциональные параметры сосудистой стенки.
Обращает внимание, что в невысоких дозовых режимах снижение уровня СРБ не зависит от дозового режима, в то время как изменения концентрации ЭТ-1, ТИМ и степень ЭЗВД связаны с дозой препарата.
В связи с широкой распространенностью нелипидных факторов риска [14], характеризующих степень поражения сосудистой стенки, их прогностическую роль в прогрессировании атеросклероза [15], полученные нами результаты свидетельствуют о возможности эффективной коррекции указанных факторов с целью первичной и вторичной профилактики атеросклероза путем использования аторвастатина, в частности его дженерика торвакарда, за счет его плейотропных эффектов, наличие которых подтверждено в настоящем исследовании, а его гиполипидемические свойства подтверждены ранее [16, 17]. Указанные эффекты аторвастатина (торвакарда) свидетельствуют о возможности широко использовать препарат у больных с высоким риском развития ССО, подбирая индивидуальные дозовые режимы, позволяющие как достичь целевых уровней ХС [18], так и скорректировать за счет плейотропных эффектов препарата ряд сосудистых проатерогенных факторов.



