Повышенная частота сердечных сокращений (ЧСС) имеет значение на всех уровнях сердечно-сосудистого континуума и поэтому рассматривается в качестве маркера риска и терапевтической мишени в профилактике и лечении сердечно-сосудистых заболеваний, прежде всего у пациентов с ишемической болезнью сердца (ИБС) и хронической сердечной недостаточностью (ХСН) [1, 2]. Антиангинальная и антиишемическая активность селективного ингибитора If-тока синоатриального узла ивабрадина доказана как при монотерапии, так и в комбинации с β-блокаторами у пациентов со стенокардией напряжения [3—6]. Недавние исследования продемонстрировали, что патофизиологические предпосылки антиишемической эффективности ивабрадина не только связаны со снижением ЧСС, но и реализуются через дополнительные плейотропные механизмы, влияющие на структуру и функцию коронарных артерий (КА) и миокарда [7, 8]. В данном обзоре мы попытались суммировать результаты исследований, иллюстрирующих многоплановость механизмов влияния на коронарный кровоток и функцию левого желудочка (ЛЖ) у пациентов с ИБС.
Влияние на ЧСС и другие биологические эффекты ивабрадина. Повышенная ЧСС ассоциирована с разрывом атеросклеротической бляшки и субклиническим воспалением у практически здоровых лиц средней и старшей возрастной группы [9, 10]. Результаты экспериментальных и клинических исследований подтверждают роль повышенной ЧСС в патогенеза коронарного атеросклероза. Так, P.A. Beere и соавт. показали, что снижение ЧСС после абляции синоатриального узла у яванских макак, получавших атерогенную диету, уменьшало площадь коронарных бляшек в 2,3 раза [11]. В экспериментальной работе у мышей с дефицитом аполипопротеина-Е высокохолестериновая диета приводила к развитию выраженного атеросклероза, а 6-недельная терапия ивабрадином, сопровождавшаяся снижением ЧСС на 13,4% (р<0,01), достоверно уменьшала размер атеросклеротической бляшки в корне аорты >40%, в восходящем отделе аорты >70%. Помимо снижения ЧСС, ивабрадин значимо уменьшал активность сосудистой НАДФ-окигеназы, перекисного окисления липидов и продукцию супероксида, улучшал эндотелиальную функцию, чем в основном и объяснялся такой отчетливый антиатеросклеротический эффект препарата [12].
В другой работе 3-месячная терапия ивабрадином предотвращала ухудшение эндотелийзависимой вазодилатации в почечных и мозговых артериях у мышей с экспрессией апопротеина ApoB-100 человека и дислипидемией [13]. В то же время метопролол при сопоставимом снижении ЧСС подобного эффекта не оказывал, что объясняется, с одной стороны, ингибированием через β-адренорецепторы эндотелиальной NO-синтетазы, а с другой – вероятными плейотропными свойствами ивабрадина.
 В исследовании RIVENDEL, включавшем 70 пациентов c ИБС (средний возраст 69 лет, 77% мужчины), подвергшихся чрескожному коронарному вмешательству (ЧКВ) с полной коронарной реваскуляризацией, добавление ивабрадина (n=36) к стандартной медикаментозной терапии сопровождалось достоверным снижением ЧСС с 68 до 62 уд/мин (р<0,001) и приростом эндотелийзависимой вазодилатации плечевой артерии на 6,3% (р<0,001) после 8 нед лечения. В группе контроля (n=34) достоверных изменений ЧСС и диаметра плечевой артерии не отмечалось [14].
В исследовании RIVENDEL, включавшем 70 пациентов c ИБС (средний возраст 69 лет, 77% мужчины), подвергшихся чрескожному коронарному вмешательству (ЧКВ) с полной коронарной реваскуляризацией, добавление ивабрадина (n=36) к стандартной медикаментозной терапии сопровождалось достоверным снижением ЧСС с 68 до 62 уд/мин (р<0,001) и приростом эндотелийзависимой вазодилатации плечевой артерии на 6,3% (р<0,001) после 8 нед лечения. В группе контроля (n=34) достоверных изменений ЧСС и диаметра плечевой артерии не отмечалось [14].
В экспериментальной модели на изолированных сердцах свиней с 90-минутным периодом ишемии миокарда и 120-минутным периодом реперфузии ивабрадин в дозе, снижающей ЧСС на 25 уд/мин, пропорционально улучшал регионарный коронарный кровоток и сократимость ЛЖ, и этот эффект полностью нивелировался предсердной стимуляцией. Введение ивабрадина до индукции ишемии уменьшало зону инфаркта миокарда (ИМ) на 46%, однако этот эффект частично устранялся предсердной стимуляцией, после которой размер ИМ оставался уменьшенным на 29%. Введение же ивабрадина до начала реперфузии уменьшало размер ИМ на 42%, и на этот эффект не влияла предсердная стимуляция, целью которой было предотвращение снижения ЧСС [15].
Ивабрадин в синоатриальном узле ингибирует f-каналы, которые кодирует семейство генов HCN (активируемые гиперполяризацией цАМФ-зависимых каналов). Экспрессия генов HCN вне САУ, низкая в норме, в определенных условиях, таких как ишемия миокарда и сердечная недостаточность, возрастает [16]. Повышение плотности f-каналов в ЛЖ может увеличивать входящие кальциевые токи и обусловливать внутриклеточную перегрузку кальцием [17]. Поэтому потенциально часть положительных эффектов ивабрадина может быть связана с прямым воздействием на миокард ЛЖ и не зависеть от снижения ЧСС. Ивабрадин, улучшая эндотелиальную функцию, может также играть позитивную роль в сохранении жизнеспособного миокарда [8].
P. Milliez и соавт. оценивали в эксперименте на сердцах крыс уровни транскриптов двух основных генов ренин-ангиотензин-альдостероновой системы (РААС). Терапия ивабрадином уменьшала уровень матричной РНК и протеинов миокардиальных ангиотензинпревращающих ферментов и рецепторов к ангиотензину I [18]. Снижение активности РААС может предотвращать развитие фиброза и связанного с ним ремоделирования миокарда.
Таким образом, ивабрадин обладает антиатерогенным, антиоксидантным и антифибротическим эффектами.
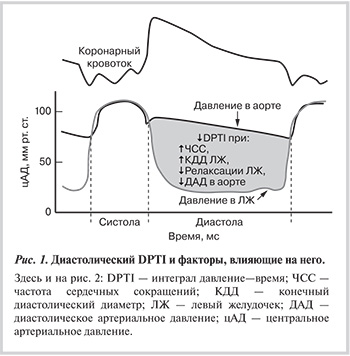
Влияние ивабрадина на время диастолической перфузии и коронарный кровоток. Коронарный кровоток главным образом осуществлется в период диастолы. В этой связи наряду с градиентом перфузионного давления длительность диастолы является определяющей. Установлено, что в норме удлинение диастолы на 1% повышает субэндокардиальный кровоток на 2,6—6% [19]. И длительность диастолы, и градиент перфузионного давления объединены в диастолический интеграл давление—время (DPTI), который является механической детерминантой коронарного кровотока (рис. 1) [20]. Поэтому снижение артериального давления (АД) в корне аорты, повышение диастолического АД в желудочках, уменьшение длительности диастолы, задержка изоволюмического расслабления желудочков уменьшают этот интеграл и коронарный кровоток.
Ивабрадин замедляет скорость спонтанной диастолической деполяризации, что приводит к удлинению фазы диастолической деполяризации без изменений других характеристик потенциала действия. В итоге ивабрадин снижает ЧСС и увеличивает длительность диастолы, что продемонстрировали J.D. Dillinger и соавт. [21]. Рандомизированное двойное слепое перекрестное исследование включало 12 пациентов с ИБС, имевших нормальное АД, синусовый ритм, ЧСС ≥70 уд/мин и получавших постоянную терапию β-адреноблокаторами. Пациенты получали ивабрадин в дозе 7,5 мг 2 раза в сутки или плацебо в течение 3 нед с последующим перекрестным приемом активного препарата и плацебо под контролем показателей аппланационной тонометрии. В отличие от плацебо 3-недельная терапия ивабрадином привела к значительному снижению ЧСС в покое (на 0,3±5,8 уд/мин против 15,8±7,7 уд/мин; р=0,001). По сравнению с плацебо терапия ивабрадином была связана с увеличением времени диастолической перфузии (+215,6±105,3 мс против –3,0±55,8 мс; р=0,0005), и, как следствие, со значительным увеличением коэффициента жизнеспособности субэндокарда — SEVR (+39,3±27,6% против –2,5±13,5%; р=0,0015).

В нашем исследовании сравнивали влияние ивабрадина и атенолола на показатели ригидности артерий и центральной гемодинамики у больных стенокардией напряжения с артериальной гипертонией без ИМ в анамнезе и систолической дисфункции ЛЖ [22]. В открытое рандомизированное проспективное исследование был включен 31 пациент со стабильной стенокардией II—III функционального класса и синусовым ритмом. В группу приема ивабрадина в дозе 10 мг/сут были рандомизированы 15 больных, другие 16 пациентов — в группу приема атенолола в дозе 50 мг/сут. Дозы препаратов увеличивались до достижения целевого уровня ЧСС 55—60 уд/мин в течение 2 нед и затем в течение 4 нед не менялись. На фоне приема ивабрадина к концу исследования отмечалось снижение ЧСС с 74 (71; 76) до 54 (53; 56) уд/мин (р=0,002). ЧСС в группе атенолола снизилась с 75 (72; 80) до 55 (53; 57) уд/мин (р=0,002). При этом статистически значимых различий по ЧСС между сравниваемыми группами как на этапе рандомизации, так к концу исследования не было. Атенолол, в отличие от ивабрадина, приводил к дополнительному снижению АД на плечевой артерии и не изменял центральный индекс аугментации, что было сопряжено с увеличением продолжительности систолы ЛЖ, систолического (на 24%; р=0,023) и диастолического (на 10%; р=0,007) интеграла давление—время. Ивабрадин, напротив, снижал нормализованный центральный индекс аугментации и статистически значимо не влиял на продолжительность систолы ЛЖ, увеличивая при этом диастолу. В итоге систолический интеграл давление—время снизился (на 13%; р=0,04), а диастолический — увеличился (на 13%; р=0,002) (рис. 2).
Ивабрадин, не оказывая влияния на периферическое АД, снижал, как и атенолол, центральное систолическое АД (САД) и диастолическое АД (ДАД), что, вероятно, обусловлено способностью ивабрадина уменьшать центральный индекс аугментации. И ивабрадин, и атенолол снижали скорость распространения пульсовой волны (соответственно на 1,5 и 1,6 м/с; р=0,002 для обоих случаев).
Снижение центрального САД и отсутствие статистически значимого влияния на продолжительность сердечного выброса, т.е. систолы ЛЖ, зарегистрированные на фоне лечения ивабрадином, уменьшают потребность миокарда в кислороде, а увеличение продолжительности диастолы улучшает его кровоснабжение. Подтверждением этого может служить увеличение SEVR, представляющего собой отношение диастолического к систолическому интегралу давление—время. При этом прирост SEVR был достоверно выше на фоне терапии ивабрадином в сравнении с атенололом. Уменьшение аугментации пульсового давления, наблюдающееся на фоне приема ивабрадина, снижает посленагрузку на миокард, что способствует снижению конечного диастолического давления в ЛЖ и поддерживает его функцию расслабления.
 Влияние ивабрадина на коронарный резерв и коронарную микроциркуляцию. В отличие от β-адреноблокаторов ивабрадин снижает ЧСС без ухудшения изоволюмической релаксации ЛЖ, что обеспечивает более выраженное улучшение коронарного кровотока вследствие удлинения диастолы [23]. Уменьшение потребности миокарда в кислороде на фоне приема ивабрадина связано еще и с тем, что в престенотических отделах миокарда уменьшается метаболическая коронарная вазодилатация и замедляется скорость коронарного кровотока, что облегчает и увеличивает доставку крови в постстенотические отделы и улучшает ее трансмуральное распределение.
Влияние ивабрадина на коронарный резерв и коронарную микроциркуляцию. В отличие от β-адреноблокаторов ивабрадин снижает ЧСС без ухудшения изоволюмической релаксации ЛЖ, что обеспечивает более выраженное улучшение коронарного кровотока вследствие удлинения диастолы [23]. Уменьшение потребности миокарда в кислороде на фоне приема ивабрадина связано еще и с тем, что в престенотических отделах миокарда уменьшается метаболическая коронарная вазодилатация и замедляется скорость коронарного кровотока, что облегчает и увеличивает доставку крови в постстенотические отделы и улучшает ее трансмуральное распределение.
Как известно, существует антагонизм катехоламинов в отношении β- и α-адренорецепторов, поэтому в условиях блокады β-адренорецепторов баланс между β-адренергической вазодилатацией и α-адренергической вазоконстрикцией смещается в сторону последней. Блокада β-адренорецепторов демаскирует α-адренергическую вазоконстрикцию в эпикардиальных КА и коронарных капиллярах [7, 24], и такой эффект особенно выражен при стенозирующем атеросклерозе [7].
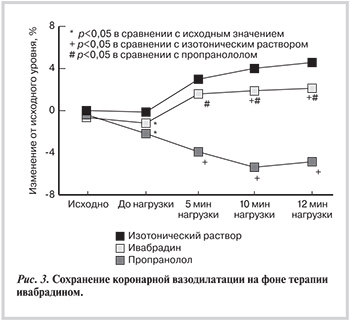
Ивабрадин не способен инициировать α-адренергическую коронарную вазоконстрикцию, но может поддерживать эндотелийзависимую вазодилатацию, которая возникает в крупных эпикардиальных КА в ответ на повышение напряжения сдвига и на уровне микроциркуляции в ответ на увеличение кровотока (рис. 3) [25].
Активация коллатерального кровотока представляет собой естественный компенсаторный механизм, возникающий в условиях прогрессирования стенозирующего атеросклероза КА и предотвращающий развитие ишемии миокарда. В экспериментальных работах показано, что ивабрадин усиливает коллатеральную функцию. При экспериментальном ИМ отдаленный эффект снижения ЧСС ивабрадином связан с увеличением плотности коронарных резистивных сосудов в жизнеспособных участках миокарда ЛЖ [26]. В другом исследовании у мышей с экспрессией аллеля ApoE2/2, наблюдающегося у пациентов с гиперлипидемией III типа, индуцированное ивабрадином снижение ЧСС стимулировало адаптивный рост коллатеральных артерий [27].
В проспективном рандомизированном плацебо-контролируемом одноцентровом исследовании, спланированном для подтверждения экспериментальной концепции, у 46 пациентов со стабильной стенокардией напряжения оценивалось влияние ивабрадина на коллатеральный коронарный кровоток. В течение 6 мес 23 пациента получали ивабрадин, другие 23 — плацебо. Основным исследуемым параметром был индекс коллатерального кровотока, который оценивался в период одноминутной окклюзии КА баллоном исходно и через 6 мес лечения. Индекс коллатерального кровотока представляет собой отношение одновременно регистрируемых среднего давления закливания КА (Pcw) к среднему давлению в аорте (Pa), из которых вычиталось среднее центральное венозное давление (Pv): (Pcw–Pv)/(Pa–Pv) [28].
В конце наблюдения изменение ЧСС в группе плацебо составило +0,2±7,8 уд/мин, а в группе ивабрадина — –8,1±11,6 уд/мин (р=0,0089). В группе плацебо индекс коллатерального кровотока снизился с 0,140±0,097 до 0,109±0,067 (p=0,12), а в группе ивабрадина увеличился с 0,107±0,077 до 0,152±0,090 (р=0,046). Изменение (Δ) индекса коллатерального кровотока в группе плацебо составило –0,031±0,090, в группе ивабрадина — +0,040 ±0,094 (p=0,011) [28].
Усиление коллатеральной функции способствует улучшению перфузии миокарда и увеличению доставки кислорода, обеспечивая антиишемический эффект. Полученные данные согласуются с результатами предшествующих клинических исследований, продемонстрировавших увеличение коронарного резерва и снижение риска развития фатального и нефатального ИМ у пациентов со стенокардией напряжения и систолической дисфункцией ЛЖ [2, 29]. Эти исследования также показали отличительное преимущество ивабрадина в отношении улучшения коллатерального коронарного кровотока в сравнении с другими антиангинальными препаратами, такими как β-адреноблокаторы [30].

Резерв коронарного кровотока отражает функциональную способность микроциркуляторного русла обеспечивать достаточный объем кровотока во время возросшей работы сердца. Результаты клинического исследования, включавшего 21 пациента со стабильной стенокардией и одно- или двухсосудистым атеросклеротическим поражением коронарных артерий, показали, что терапия ивабрадином достоверно уменьшала среднюю пиковую скорость коронарного кровотока в состоянии покоя и увеличивала среднюю пиковую скорость коронарного кровотока во время гиперемии, тем самым повышая резерв коронарного кровотока c 2,78±0,61 до 3,51±0,81 (p<0,001) [31]. При достижении исходной ЧСС в период правопредсердной электрической стимуляции пиковая скорость коронарного кровотока в покое возвратилась к базовому уровню, тогда как уровень пиковой скорости гиперемического коронарного кровотока на фоне приема ивабрадина сохранялся выше базового. Поэтому резерв коронарного кровотока, который определялся как отношение скорости гиперемического кровотока к скорости коронарного кровотока в покое, также оставался выше базового [3,04±0,6 против 2,78±0,61 (p<0,01)]. Таким образом, терапия ивабрадином достоверно повышала скорость гиперемического коронарного кровотока и резерв коронарного кровотока, и этот эффект не зависел от снижения ЧСС, что может свидетельствовать об улучшении функционального состояния микроциркуляторного русла, которое обусловлено действием препарата.
E. Tagliamonte и соавт. сравнивали влияние ивабрадина и бисопролола на резерв скорости коронарного кровотока в проспективном рандомизированном двойном слепом исследовании, в которое были включены пациенты со стабильной стенокардией напряжения и синусовым ритмом, получавшие постоянную стандартную терапию в течение как минимум 15 дней до рандомизации [32]. Резерв скорости коронарного кровотока измеряли с помощью трансторакальной допплеровской эхокардиографии в передней межжелудочковой ветви и рассчитывали как отношение гиперемического коронарного кровотока к базальной диастолической скорости коронарного кровотока.
Результаты исследования показали, что при сопоставимом снижении ЧСС у пациентов со стабильной стенокардией по сравнению с бисопрололом ивабрадин в большей степени увеличивал гиперемический пик диастолической скорости коронарного кровотока (65,0 см/с против 70,7 см/с; р<0,01) и резерв скорости коронарного кровотока (3,35 см/с против 3,52 см/с; р<0,01).
Представленные результаты показали более благоприятные, чем у β-адреноблокаторов, эффекты ивабрадина в отношении коронарного русла на уровне микроциркуляции, что может иметь значение при лечении больных с микрососудистой стенокардией, а также потенциально уменьшить риск развития периоперативного повреждения миокарда у пациентов с ИБС при проведении элективных ЧКВ и улучшить их прогноз.
Влияние ивабрадина на ишемизированный миокард и сократительную способность. Ивабрадин уменьшает станнирование миокарда, т.е. улучшает восстановление сократительной функции ЛЖ во время реперфузии, следующей за стресс-индуцированной ишемией миокарда. Отсутствие у ивабрадина отрицательного инотропного эффекта поддерживает глобальную сократительную функцию ЛЖ. Связанное с приемом ивабрадина снижение ЧСС, сопровождающееся улучшением диастолической перфузии КА, у пациентов со сниженной сократительной способностью миокарда приводит к улучшению диастолического наполнения ЛЖ, увеличению его конечного диастолического и ударного объемов, согласно механизму Франка—Старлинга [33]. При этом увеличивается сократительная мощность ЛЖ, что доказывается снижением конечного систолического размера ЛЖ [33], а также увеличением DPTI [21, 22].
Постсистолическое утолщение стенки служит типичным признаком асинхронии сокращения и расслабления ЛЖ, которая связана с обратимой локальной ишемией миокарда и реперфузией [34, 35]. В эксперименте на собаках в противоположность атенололу ивабрадин продемонстрировал уникальную способность преобразовывать утолщение стенки ЛЖ из постсистолического в систолическое, и, как результат, сокращение «смещалось» в период сердечного выброса (рис. 4) [36].
Таким образом, в оглушенном миокарде увеличение локальной сократительной функции ЛЖ на фоне приема ивабрадина может происходить за счет не дополнительного инотропного эффекта, а перераспределения существующего утолщения стенки между диастолой и систолой. Можно предположить, что уменьшение парадоксального утолщения стенки ЛЖ в раннюю диастолу (постсистолу) сохраняет и способность к эффективной релаксации ЛЖ.
В исследовании F. Maranta и соавт. оценивалось влияние ивабрадина на стресс-индуцированную дисфункцию ЛЖ и пост-ишемическое оглушение миокарда у 15 больных ИБС с фракцией выброса >40% и ЧСС >70 уд/мин [37]. Всем пациентам после периода вымывания, в котором они получали плацебо, выполнялась эхокардиография с оценкой деформации ЛЖ в покое, на максимуме нагрузки в ходе тредмил-теста и во время периода восстановления вплоть до момента достижения исходных характеристик. Критерием включения в протокол являлась воспроизводимость стресс-теста. Через 2 нед приема ивабрадина в дозе 7,5 мг 2 раза в сутки повторно оценивались эхокардиографические параметры при уровне физической нагрузки, достигнутом в периоде вымывания. Во время проведения стресс-эхокардиографии ивабрадин не изменял сегментарную деформацию ЛЖ в отдаленных от очага ишемии участках, но в ишемизированных сегментах миокарда достоверно уменьшал выраженность ее ухудшения, особенно на максимуме физической нагрузки, по сравнению с периодом вымывания. Однако следует отметить, что по сравнению с сегментарной деформацией ЛЖ перед тредмил-тестом на пике физической нагрузки в ишемизированных сегментах этот показатель немного достоверно ухудшался. Глобальная продольная деформация ЛЖ на фоне терапии ивабрадином достоверно улучшилась c –22,2±0,75 до –23,55±0,60% (p<0,001).
ИБС является ведущей причиной систолической дисфункции ЛЖ вследствие гибели кардиомиоцитов и формирования рубцовой ткани или гибернации миокарда, представляющей собой хроническую дисфункцию жизнеспособной ткани [38, 39]. Прогрессирующее станнирование, возникающее после рецидивирующих эпизодов ишемии, может рассматриваться в качестве потенциального механизма гибернации миокарда [39]. В связи с этим можно предположить, что конечным эффектом ивабрадина, позитивно влияющего на систолическую дисфункцию ЛЖ посредством уменьшения ишемии, обусловленной повышенной потребностью в кислороде, и оглушения миокарда, является уменьшение его гибернации.
Отчасти такой патофизиологический каскад объясняет результаты исследования SHIFT, в котором у 70% пациентов систолическая дисфункция ЛЖ имела ишемическую природу, а добавление ивабрадина к стандартной терапии ХСН уменьшало частоту наступления первичной комбинированной конечной точки, включавшей сердечно-сосудистую смерть и госпитализацию по поводу прогрессирования ХСН, на 18% (относительный риск 0,82 при 95% доверительном интервале от 0,75 до 0,90; р<0,0001) [40].
Заключение
Достижение целевой частоты сердечных сокращений является ключевой позицией в тактике лечения пациентов с коронарной болезнью сердца и хронической сердечной недостаточностью с систолической дисфункцией левого желудочка. Однако учет плейотропных эффектов при выборе пульсурежающего препарата может обеспечить дополнительные преимущества в определенных клинических ситуациях. Селективное снижение частоты сердечных сокращений при назначении ивабрадина улучшает и коронарный кровоток, и функциональное состояние коронарного русла, но без негативного эффекта α-адренергической вазоконстрикции и нарушения изоволюмического расслабления желудочков, которые могут сопровождать применение β-блокаторов. Ивабрадин, не оказывая отрицательное инотропное действие, способствует поддержанию глобальной сократительной способности левого желудочка без повышения артериального давления, а при развитии ишемии уменьшает острую дисфункцию и оглушение миокарда. Результаты представленных экспериментальных работ на изолированном сердце свидетельствуют, что улучшение функции левого желудочка обусловленно именно воздействием ивабрадина и не связано с модификацией оказываемой на него нагрузки или циркулирующими нейрогормональными факторами, так как в изолированном препарате сердца условия пред- и посленагрузки на левый желудочек фиксированы на протяжении всего исследования.



