Высокая эффективность процедур реваскуляризации миокарда при лечении больных ишемической болезнью сердца (ИБС) не вызывает сомнения, прежде всего, при многососудистом поражении коронарных артерий (КА). Если у больных с острым коронарным синдромом оптимальная диагностическая и лечебная стратегия достаточно проработаны [1—3], то при проведении плановой коронарографии (КГ) остаются нерешенные вопросы [4]. С одной стороны, существует направленность на широкое использование КГ для выявления пациентов, которым показаны реваскуляризующие процедуры. С другой стороны, при таком подходе приходится констатировать, что зачастую КГ проводится пациентам без достаточных показаний к данной инвазивной процедуре. В конечном счете это приводит к тому, что по результатам КГ у большого процента больных не выявляются изменения (пациенты с так называемыми малоизмененными КА), как показывают регистровые исследования [5, 6]. Поэтому в международных рекомендациях предложены диагностические алгоритмы, основанные как на клинической оценке характера болевого синдрома в грудной клетке с определением претестовой вероятности (ПТВ) ИБС, так и на проведении неинвазивных диагностических тестов [3, 7]. Тем не менее в клинической практике в российских условиях данный подход пока не нашел широкого распространения, для выявления причин этого, соответственно, необходим дополнительный анализ. Это послужило основанием для проведения настоящего исследования, целью которого было изучение частоты и возможных причин выявления малоизмененных КА при плановой КГ.
Материал и методы
Проведен ретроспективный анализ 711 историй болезни пациентов, подвергшихся плановым КГ на базе Кемеровского кардиологического центра за период с 1 апреля по 31 мая 2014 г. В зависимости от наличия и степени поражения коронарного русла были сформированы 4 группы: 1-я (n=234) — пациенты без поражения КА, 2-я (n=94) — больные с незначимым поражением КА (стенозы менее 60%), 3-я (n=22) — пациенты с пограничным поражением КА (стенозы 60—69%), 4-я (n=361) — больные с гемодинамически значимым поражением КА (стенозы 70% и более). Исследуемые группы были сопоставлены по основным антропометрическим, клинико-анамнестическим данным, получаемой терапии, показателям лабораторного и инструментального обследования. До проведения КГ у всех пациентов проводилась оценка лабораторных показателей — уровень гемоглобина, глюкозы, креатинина, общего холестерина. Кроме того, выполняли эхокардиографию (ЭхоКГ) с оценкой размеров, объемных показателей и фракции выброса (ФВ) левого желудочка (ЛЖ). Нагрузочные тесты (велоэргометрия — ВЭМ) и суточное мониторирование электрокардиограммы (СМ ЭКГ) с целью определения толерантности к физической нагрузке, выявления признаков скрытой коронарной недостаточности (СКН) больным проводили по месту жительства. Верификацию атеросклеротического поражения каротидного бассейна, артерий нижних конечностей, брюшной аорты выполняли с применением цветового дуплексного сканирования (ЦДС). При необходимости после проведения ЦДС с целью получения дополнительной информации о локализации и анатомических особенностях облитерирующих изменений выполняли ангиографическое исследование интересующего артериального бассейна. Кроме того, в группах проведен анализ клинических проявлений стенокардии с последующей оценкой ПТВ наличия поражения коронарного русла в зависимости от пола и возраста, группы были сопоставлены по показаниями к проведению КГ. В группе с гемодинамически значимыми стенозами КА представлена распространенность коронарного атеросклероза.
 Исследование выполнено в соответствии с Хельсинкской декларацией, одобрено этическим комитетом учреждения. Все участники исследования подписали информированное согласие.
Исследование выполнено в соответствии с Хельсинкской декларацией, одобрено этическим комитетом учреждения. Все участники исследования подписали информированное согласие.
Для статистической обработки данных использовали стандартный пакет прикладных программ Statistica 8.0. Качественные значения представляли в абсолютных числах (n) и процентах (%), сравнение проводили с помощью критерия χ2 Пирсона. Нормальность распределения проверяли с помощью критерия Колмогорова—Смирнова. Для всех количественных переменных распределение отличалось от нормального, и они представлены в виде медианы и нижнего и верхнего квартилей — Mе [LQ; UQ]. При сравнении более двух групп по качественному и количественному признакам использовали метод рангового анализа вариаций Крускала—Уоллиса. При сопоставлении двух независимых групп по количественному признаку использовали критерий Манна—Уитни. В многофакторный регрессионный анализ включали переменные, для которых значения критерия статистической значимости при однофакторном анализе составляли меньше 0,1. Предварительно выявляли возможные корреляции между предполагаемыми предикторами, затем формировали несколько регрессионных моделей с учетом выявленных корреляций. Уровень критической значимости (р) был принят равным 0,05.
Результаты
В обследуемой когорте пациентов у 32,9% отсутствовали стенозы КА, у 13,2% стенозы КА были незначимые, в 3,1% случаев — пограничные и в 50,8% — гемодинамически значимые. Распространенность коронарного атеросклероза в группе с гемодинамически значимыми стенозами КА представлена на рис. 1, преобладали стенозы 1 и 2 КА (48,2 и 31,6% соответственно), поражение 3 КА выявлено у 19,7% пациентов, ствола левой КА — у 5,5%.
При сопоставлении исследуемых групп (табл. 1) отмечено, что большинство составляли мужчины (p<0,001), за исключением группы без поражения коронарного русла — в ней преобладали женщины (р<0,05). Пациенты с пограничными и гемодинамически значимыми стенозами КА были старше лиц без поражения и с незначимым поражением КА (р=0,019). По индексу массы тела (ИМТ) группы достоверно не различались (р=0,391). Клиническая картина стенокардии реже всего прослеживалась у больных без поражения КА (p<0,001). При этом больные с наличием инфаркта миокарда (ИМ) в анамнезе преобладали в группе с гемодинамически значимым поражением КА (59,6%) относительно остальных групп (14,5, 27,7 и 36,4% соответственно; p<0,001). Признаки хронической сердечной недостаточности (ХСН) преимущественно имели пациенты групп с пограничными и гемодинамически значимыми стенозами КА (p<0,001). Нарушения ритма сердца (НРС) чаще регистрировались у пациентов группы с отсутствием поражения коронарного русла (p<0,001), при этом пациенты данной группы реже других страдали сахарным диабетом — СД (р=0,010). По распространенности артериальной гипертензии (АГ), бронхолегочной патологии, дисфункции почек, наличию инсультов и операций на некоронарных артериальных бассейнах в анамнезе группы достоверно не различались (р>0,05). Операцию коронарного шунтирования (КШ) ранее перенесли 30 (8,3%) больных группы с гемодинамически значимыми стенозами КА (p<0,001). Частота чрескожных коронарных вмешательств (ЧКВ) в анамнезе составила 19,2% в группе незначимых, 22,7% — в группе пограничных и 16,6% — гемодинамически значимых стенозов КА (p<0,001). По распространенности атеросклеротического поражения периферических артериальных бассейнов достоверных межгрупповых различий выявлено не было (р>0,05). Больные группы без окклюзионно-стенотических изменений коронарного русла реже остальных принимали β-адреноблокаторы, статины и ацетилсалициловую кислоту (p<0,05).

Сопоставление групп по основным направлениям, явившимся показаниями к проведению КГ, представлено в табл. 2. С клинической картиной стенокардии в отсутствие ИМ в анамнезе чаще направлялись пациенты групп без поражения (43,6%) и с незначимым поражением КА (52,1%) в сравнении с другими группами (45,5 и 30,5% соответственно; p<0,001). При этом в связи с наличием постинфарктного кардиосклероза КГ преимущественно проводилась больным группы с гемодинамически значимыми стенозами КА — 68,7% по сравнению с остальными группами (13,7, 26,6 и 36,4% соответственно; p<0,001). Пациенты, направленные на КГ перед коррекцией порока сердца, преобладали в группе без поражения КА (p<0,001). Среди пациентов, направленных на ангиографическое исследование по поводу безболевой ишемии миокарда и для предоперационной оценки больных с периферическим атеросклерозом, достоверных межгрупповых отличий выявлено не было (р>0,05).
Типичная картина стенокардии (табл. 3) чаще прослеживалась у пациентов с поражением коронарного русла (в 48,9, 50 и 50,4% случаев соответственно), чем у больных с нормальными КА (31,6%; p<0,001). Атипичная клиническая картина стенокардии часто встречалась в группе без окклюзионно-стенотических изменений КА (p<0,001). При этом кардиалгия преобладала у больных без поражения и с пограничными стенозами КА (p<0,001). У отдельных пациентов оценить функциональный класс (ФК) и типичность стенокардии не удалось, поскольку в истории болезни отсутствовало описание клинической картины, а судить о выраженности стенокардии представлялось возможным только на основании выставленного диагноза. Учитывая клинические признаки стенокардии, пол и возраст пациента, мы рассчитали ПТВ наличия поражения коронарного русла — у больных с поражением КА она была достоверно выше, чем у лиц без стенозов КА (p<0,001).
 Анализ лабораторных данных показал (табл. 4), что уровень гемоглобина и глюкозы был ниже у пациентов группы без поражения КА в сравнении с группой с гемодинамически значимыми стенозами КА (p=0,003 и р=0,006 соответственно). При этом уровень креатинина у больных группы без поражения КА был ниже, чем в остальных группах (р=0,008). По результатам ЭхоКГ размеры и объемы полости ЛЖ в группе с гемодинамически значимыми стенозами КА превышали данные параметры в группе без поражения КА (р<0,05). ФВ ЛЖ в группе пациентов без стенозов КА была достоверно выше, чем в группе с пограничным и гемодинамически значимым поражением КА (р<0,001).
Анализ лабораторных данных показал (табл. 4), что уровень гемоглобина и глюкозы был ниже у пациентов группы без поражения КА в сравнении с группой с гемодинамически значимыми стенозами КА (p=0,003 и р=0,006 соответственно). При этом уровень креатинина у больных группы без поражения КА был ниже, чем в остальных группах (р=0,008). По результатам ЭхоКГ размеры и объемы полости ЛЖ в группе с гемодинамически значимыми стенозами КА превышали данные параметры в группе без поражения КА (р<0,05). ФВ ЛЖ в группе пациентов без стенозов КА была достоверно выше, чем в группе с пограничным и гемодинамически значимым поражением КА (р<0,001).
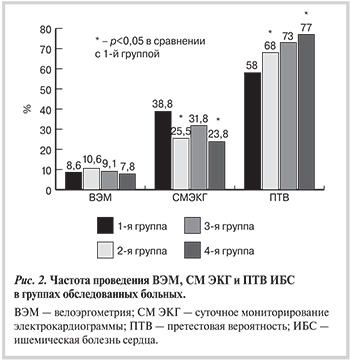
Анализируя результаты нагрузочных тестов (рис. 2), мы отметили, что показатели ВЭМ не выявили статистически значимых межгрупповых различий (р=0,844), данное исследование проводилось довольно редко во всех группах (от 7,8 до 10,6% случаев). При этом СМ ЭКГ чаще выполнялось у больных без окклюзионно-стенотических изменений коронарного русла (р<0,001). Признаки СКН преимущественно были зарегистрированы также в этой группе — 10,7, 5,3, 4,6 и 3,6% соответственно (р=0,006). Учитывая клинические признаки стенокардии, пол и возраст пациента, мы рассчитали ПТВ наличия поражения коронарного русла — у больных с наличием поражения она была достоверно выше, чем у лиц без стенозов КА (p<0,001). Однако в группе без стенозов КА ПТВ ИБС была высокой (медиана 58%).
Для выявления предикторов малоизмененных КА проведен регрессионный анализ (табл. 5, 6). Так, по результатам многофакторного регрессионного анализа (см. табл. 6) в модели 1 независимыми предикторами выявления малоизмененных КА оказались: наличие атипичной клинической картины стенокардии (вероятность увеличивалась в 3,16 раза; р<0,001) и обследование перед операциями по поводу клапанных пороков сердца (в 6,61 раза; р<0,001). При этом вероятность отсутствия поражения коронарного русла снижалась у лиц мужского пола (р<0,001), при увеличении возраста (р=0,008), при наличии ХСН (р=0,013) и атеросклеротического поражения брахиоцефальных артерий (р=0,027). В другой регрессионной модели независимыми предикторами выявления малоизмененных КА являлись: наличие кардиалгии (вероятность увеличивалась в 6,18 раза; р<0,001) и обследование перед операциями по поводу нарушений ритма и проводимости (в 6,05 раза; р<0,001). Мужской пол (р<0,001), увеличение возраста (р=0,001) и наличие СД (р<0,001), наоборот, снижали вероятность отсутствия окклюзионно-стенотических изменений коронарного русла.
Обсуждение
При проведении плановой КГ малоизмененные КА выявлены у 32,9% обследованных. Среди этих пациентов было больше женщин, они были моложе по сравнению с другими группами, у них реже выявляли СД, ИМ в анамнезе. Чаще в этой группе причинами направления на КГ были обследование перед клапанными операциями на сердце и НРС. При ретроспективной оценке ПТВ ИБС она была наименьшая в группе малоизмененных КА.
Отсутствие поражения КА при инвазивной КГ может резко различаться в разных клиниках и зависит от контингента обследуемых. Так, в Национальной базе данных США из 661 063 больных, подвергнутых плановой КГ, в 58,4% случаев выявлена необструктивная ИБС (стенозы до 50% или их отсутствие). Неинваизвные нагрузочные тесты выполнены у 64% больных, 51,9% из них были признаны патологическими, но только 9% имели признаки поражения КА высокого риска [8]. При сопоставлении частота выявления гемодинамически значимых поражений КА в отдельных центрах колеблется от 23 до 100% (медиана 45%). В центрах с низкой частотой выявления значимых стенозов КА обследованные пациенты были моложе, имели меньший риск по Фрамингемской шкале, чаще симптомы были атипичными или отсутствовали (73% против 58%; p<0,0001), а функциональные тесты были негативными, неполными или отсутствовали [9]. В другом многоцентровом регистре при проведении КГ в среднем 41,9% больных имели нормальные КА, чаще в муниципальных клиниках по сравнению с академическими (47,1% против 35,4%; р<0,001), в отдельных клиниках этот показатель составлял от 18,4 до 76,9% [5]. В настоящем исследовании в группе больных, обследованных с подозрением на ИБС, частота выявления нормальных КА (37,6%) была вполне сопоставима с этими данными. Кроме того, отмечены различия в выявлении гемодинамически значимых стенозов КА в зависимости от врача, проводящего КГ (реже у врачей инвазивной диагностики, чаще — у врачей-интервенционистов), от типа клиники (реже в диагностических центрах, чаще в клиниках с наличием всех видов реваскуляризации, включая КШ) [10].
При обследовании пациентов перед кардиальными операциями при наличии симптомов стенокардии, ИМ или ЧКВ в анамнезе гемодинамически значимые стенозы КА при КГ выявляются в 2/3 случаев, в отсутствие этих факторов — только в 1/3 [11]. В нашем исследовании частота выявления нормальных КА у больных данной категории была выше и составила 76%.
По данным регистров, независимыми факторами, ассоциированными с необструктивной ИБС, были молодой возраст, женский пол, атипичная боль в грудной клетке и нагрузочные тесты низкого риска [8]. В многофакторной модели женский пол был наиболее сильным предиктором нормальной КГ (относительный риск — ОР 3,55, при 95% доверительном интервале — ДИ от 2,93 до 4,28). Кроме того, с высокой частотой нахождения нормальных КА при КГ были ассоциированы отсутствие СД, дислипидемии, курения, периферического атеросклероза, проведение КГ не в академической клинике [5]. В другой работе факторами, ассоциированными с наличием стенозов КА, были позитивные результаты неинвазивных тестов, возраст, мужской пол, курение, СД, дислипидемия и АГ [12]. Именно наличие признаков высокого риска, по данным неинвазивных стресс-тестов, было также ассоциировано с наличием обструктивной ИБС (ОР 3,03 при 95% ДИ от 2,86 до 3,22) [8].
Несколько парадоксальным выглядит то, что, несмотря на неприменение оценки ПТВ и редкое использование неинвазивных стресс-тестов, в настоящем исследовании частота выявления гемодинамически значимых стенозов КА была сопоставимой с таковой по данным зарубежных авторов, широко использовавших указанные диагностические стратегии. Так, при сопоставлении результатов КГ в двух регионах США отмечены существенные различия как по числу больных с высокой ПТВ ИБС (более 50%) (19,3% против 41%; р<0,001), так и в выявлении гемодинамически значимых стенозов КА (30,4% против 44,8%; р<0,001) [6]. Однако в последних работах показано, что использование оценки ПТВ ИБС существенно завышало ее по сравнению с данными мультиспиральной компьютерной томографии-ангиографии (МСКТ-АГ) как в целом по группе (18 против 51 для 50% стенозов КА, 10 против 42 для 70% стенозов КА; р<0,001), так и отдельно для больных с атипичной стенокардией (15 против 47 для 50% стенозов КА, 7 против 37 для 70% стенозов КА) и типичной стенокардией (29 против 86 для 50% стенозов КА, 19 против 71 для 70% стенозов КА) [13]. В нашем исследовании также в группе с малоизмененными КА ПТВ ИБС была хотя и меньше, чем в других группах, но составляла в среднем 58%, т.е. явно завышена. Поэтому неудивительно, что предлагаются альтернативные (помимо шкалы Diamond—Forrester) методы оценки вероятности ИБС, в частности клиническая шкала Duke. По сравнению с шкалой Diamond—Forrester при использовании новой шкалы реклассификация вероятности ИБС на низкую, промежуточную и высокую возросла на 51% (p=0,01), улучшение было особо заметно у больных низкого риска. У пациентов, реклассифицированных в группу низкой вероятности ИБС, в 97% случаев отсутствовали клинически значимые стенозы КА [14].
Невысокая частота использования неинвазивных тестов в настоящем исследовании (около 10%) отчасти объясняется имевшимися показаниями к КГ (у ряда пациентов КГ проводилась в качестве предоперационного обследования перед операциями на сердце, на некоронарных артериальных бассейнах и перед вмешательствами по поводу НРС). Кроме того, эти тесты представлены только ВЭМ. Можно сопоставить наши данные с результатами Национальной базы данных США, в которой среди неинвазивных тестов преобладало проведение стресс-магнитно-резонансной томографии (54%), реже встречались стресс-ЭхоКГ (21%) и тредмилметрия (25%) [15].
Аналогично например, в исследовании бразильских авторов плановая КГ была проведена 1892 больным, из которых 82% имели позитивный неинвазивный тест: с физической нагрузкой (41%), с визуализацией перфузии миокарда (36%), стресс-ЭхоКГ (3%) или МСКТ-АГ КА (3%). Частота выявления стенозов КА более 50% составила 57%, она была выше у больных с позитивными тестами по сравнению с пациентами без тестов (58% против 51%; p=0,026) и при использовании анатомических тестов по сравнению с функциональными (81,3% против 57,1%; p=0,001) [12].

Тем не менее, по опубликованным недавно данным обширного регистра с включением 661 063 больных, результаты неинвазивных тестов имели минимальную дополнительную ценность по сравнению с клиническими факторами для прогнозирования гемодинамически значимых стенозов КА [8]. Поэтому неудивительно, что редкое проведение нагрузочных тестов в нашем исследовании не сказалось существенно на частоте выявления патологии КА. Сходные данные получены в регистре CathPCI: среди 790 601 больного без анамнеза ИБС стресс-тесты не были проведены в 36,9% случаев. У этих больных чаще не было симптомов стенокардии (38,5% против 28,2% по сравнению со стресс-тестами), но по частоте выявления существенных стенозов КА группы не различались (35,7% против 40,1%). Среди 449 579 больных с ИБС в анамнезе в 44,2% случаев стресс-тесты не проводились. У таких больных чаще отмечалась более тяжелая стенокардия (ФК III/IV — 17,8% против 13,4%), но гемодинамически значимые стенозы КА выявляли не чаще, чем у больных со стресс-тестами (78,7% против 81,1%) [16].
Использование более современных диагностических методов дает примерно такие же результаты. Так, оценка коронарного резерва при позитронно-эмиссионной томографии (ПЭТ) оказалась полезна в прогнозировании отсутствия стенозов КА высокого риска при нормальном коронарном резерве с высокой чувствительностью (86%) и прогностической ценностью отрицательного результата (97%). Однако нарушения коронарного резерва при ПЭТ не позволяют отличить значимые стенозы эпикардиальных артерий от диффузного необструктивного атеросклероза или микроваскулярной дисфункции [17]. В мета-анализе было показано, что диагностическая точность нагрузочных тестов зависела от возраста, пола, клинических характеристик и вида нагрузочного теста. В любом случае нагрузочные тесты были более полезны для исключения ИБС, чем для ее подтверждения [18].
Для повышения частоты выявления гемодинамически значимых поражений КА целесообразно использовать ряд подходов. Во-первых, это может быть оценка ПТВ ИБС, но только с использованием более совершенных шкал [14]. Во-вторых, среди неинвазивных тестов заслуживает внимания МСКТ-АГ КА. Так, по данным многоцентрового регистра ACIC, результаты стресс-тестов не имели ассоциации с частотой выявления стенозов КА >50% по данным МСКТ. При этом у пациентов, подвергнутых КГ (n=621), отмечена сильная корреляция результатов КГ с данными МСКТ-АГ КА (ОР 9,09 при 95% ДИ от 5,57 до 14,8; p<0,001), но не с результатами стресс-тестов (ОР 0,79 при 95% ДИ от 0,56 до 1,11; p=0,17) [19]. Более точно место данной диагностической стратегии может определить проводимое в настоящее время проспективное рандомизированное исследование по сравнению эффективности функциональных тестов (нагрузочная ЭКГ, сцинтиграфия миокарда или стресс-ЭхоКГ) и анатомической оценки с помощью 64-срезовой МСКТ-АГ КА [20].
Возможно, в улучшении отбора больных на КГ после неинвазивных тестов поможет новая шкала GRS (Global Risk Score). При низких оценках по этой шкале, неинвазивных тестах низкого риска или в отсутствие симптомов стенокардии только в 8% случаев больные имели гемодинамически значимые стенозы КА, в то время как при высоких оценках по GRS такое поражение имели 44% больных [21]. При ретроспективной оценке плановых КГ у 8986 больных в 35,3% случаев были критерии целесообразности ее проведения, в 39,8% — неопределенные критерии и в 24,9% — критерии нецелесообразности. Среди 2240 больных без отсутствием целесообразности проведения КГ в 56,7% случаев не проводили нагрузочные тесты. В отдельных клиниках частота проведения КГ при ее нецелесообразности колебалась от 8,6 до 48,8% (медиана 28,5%) [22].
Кроме того, необструктивная ИБС чаще выявляется у женщин даже при наличии симптомов стенокардии и положительных результатов неинвазивных тестов. У больных данной категории предложено использовать дополнительную шкалу для оценки риска выявления гемодинамически значимых стенозов КА с включением таких параметров, как возраст ≥55 лет, ИМТ <30 кг/м2, курение, низкие уровни холестерина липопротеидов высокой плотности, семейный анамнез ранней ИБС, изменения в боковой стенке при нагрузочных тестах с визуализацией и физическая работоспособность <5 МЕТ [23]. Отмечено также, что связь между множественными факторами риска развития заболевания сердца и наличием гемодинамически значимых стенозов КА более выражена у женщин, чем у мужчин [24]. Использование клинической шкалы Мориса при оценке вероятности выявления ИБС у женщин более точно прогнозировало наличие обструктивных поражений КА при МСКТ-АГ, чем шкала Diamond—Forrester [25], которая рекомендуется к использованию в рекомендациях Европейского общества кардиологов [7].
Низкая частота выявления обструктивных поражений КА перед хирургическим вмешательством при поражении клапанов сердца и НРС известна была и ранее, но экспертами признается необходимость скринингового обследования для уменьшения частоты развития периоперационных осложнений. В частности, показаниями к КГ при клапанных поражениях сердца являются подозрение на наличие ишемии миокарда (болевой синдром в грудной клетке, данные неинвазивных тестов), систолическая дисфункция ЛЖ, возраст старше 40 лет у мужчин, постменопауза у женщин и наличие ≥1 фактора риска развития сердечно-сосудистых заболеваний [26]. По-видимому, для более точного определения необходимости КГ перед кардиальными операциями есть смысл оценивать риск развития ИБС с помощью дополнительных критериев. Во всяком случае, для больных без симптомов стенокардии, ИМ и ЧКВ в анамнезе предложена модель с учетом возраста, пола, отсутствия СД и периферического атеросклероза, которая позволяет выявить группу пациентов с низкой (≤10%) вероятностью коронарных стенозов [11]. Похожая модель была предложена для оценки риска наличия ИБС перед операциями на аортальном клапане, в которой учитывались возраст пациентов, наличие стенокардии, СД и АГ. Среди больных с низким риском по данной модели только у 1,2% выявлено поражение одной КА и ни в одном случае не выявлено существенных поражений [27].
Не вызывает сомнения также, что в правильной диагностической стратегии имеет значение квалификация врача. Например, после проведения стресс-теста на тредмиле (его результаты были негативными в 79% случаев, позитивными — в 3,6% и неполными — в 18%) кардиологи реже назначали дополнительное обследование, чем не кардиологи (9,5% против 12,2%; p=0,02), меньше назначали неинвазивных тестов (5,9% против 10,4%; p<0,0001) и чаще — инвазивную КГ (3,6% против 1,8%; p<0,0001) [28].
Заключение
Среди обследованных пациентов у 32,9% отсутствовали стенозы коронарных артерий. В этой группе больных преобладали женщины (56%), они были моложе, у них реже выявляли инфаркт миокарда в анамнезе и сахарный диабет. В клинической картине в этой группе пациентов реже отмечалась типичная стенокардия, чаще — атипичная стенокардия или кардиалгия. Соответственно претестовая вероятность ишемической болезни сердца у больных этой группы была наименьшей и составляла 58%. Существенные различия между группами отмечены и по показаниям к направлению на коронарографию — в группе с малоизмененными коронарными артериями чаще встречались пациенты перед клапанными операциями на сердце и с нарушениями ритма сердца, реже — после перенесенного инфаркта миокарда. Для улучшения отбора больных на инвазивную коронарографию целесообразно, по-видимому, использовать более точные методики расчета претестовой вероятности ишемической болезни сердца, а в качестве неинвазивных тестов использовать функциональные тесты с визуализацией или оценку состояния коронарных артерий с помощью мультиспиральной компьютерной томографии. По-видимому, нуждается в усовершенствовании и тактика предоперационного обследования по поводу наличия коронарных стенозов перед кардиальными операциями.



