Нарушения ангиогенеза — один из важнейших механизмов развития сосудистых поражений при сахарном диабете (СД). Для данного заболевания характерны парадоксальные изменения сосудистого ремоделирования в различных бассейнах: микрососудистые осложнения (пролиферативная ретинопатия, начальные стадии нефропатии) характеризуются неадекватным ускорением новообразования сосудов, в то время как ишемическая болезнь сердца (ИБС) и макроангиопатия нижних конечностей сопровождаются снижением адаптивного ангиогенеза [1].
Механизмы нарушения регуляции новообразования сосудов при СД остаются предметом интенсивных исследований. Как известно, ангиогенез начинается с активации эндотелиальных клеток. Ключевую роль в этом процессе играет фактор роста эндотелия сосудов (VEGF: Vascular Endothlium Growth Factor). Подсемейство VEGF включает пептиды VEGF-A, VEGF-B, VEGF-C, VEGF-D и VEGF-E, плацентарные факторы роста PlGF-1 и PlGF-2, рецепторы VEGFR-1, VEGFR-2 и VEGFR-3. Каждая из этих молекул играет свою роль в процессе ангиогенеза. VEGF-A влияет на развитие новых и выживание незрелых кровеносных сосудов, связываясь с мембранными рецепторами VEGFR-1 и VEGFR-2. Факторы VEGF-С и VEGF-D, действующие через VEGFR-3 и VEGFR-2, регулируют главным образом лимфангиогенез [2, 3].
Фактору VEGF-A отводят важную роль в развитии коллатерального кровоснабжения миокарда в условиях ишемии [4, 5]. По данным мета-анализа 12 исследований, смертность больных ИБС с хорошо развитым коллатеральным кровоснабжением миокарда на 36% ниже, чем у больных со слабо развитыми коллатералями [6]. Циркулирующий VEGF-A изучается как потенциальный биомаркер состояния коллатерального кровотока у больных ИБС [7, 8]. Диагностическое значение пептидов VEGF у пациентов с сочетанием ИБС и СД нуждается в уточнении. Сложность в интерпретации показателя у данных больных может быть связана с тем, что на уровень VEGF-А в крови влияют колебания уровня глюкозы в крови [9—11]. Изменения уровня циркулирующих VEGF-C и VEGF-D при СД не изучены.
Генетические особенности регуляции ангиогенеза могут отличать пациентов с СД 2-го типа от общей популяции [12]. В гене VEGFA обнаружены полиморфные участки — однонуклеотидные замены (SNPs: single nucleotide polymorphisms), расположенные главным образом в некодирующих областях (интронах). Варианты нуклеотидов в ряде полиморфных позиций гена VEGFA влияют на интенсивность его экспрессии [13]. Функциональные полиморфизмы гена VEGFA у больных ИБС ассоциированы с состоянием коллатерального кровоснабжения миокарда [14].
Целью исследования явилось изучение уровня в сыворотке крови пептидов семейства VEGF (VEGF-A, VEGF-C и VEGF-D) и функциональных полиморфизмов гена VEGFA (rs699947 и rs3025039) у больных СД 2-го типа в зависимости от наличия ИБС.
Материал и методы
Обследованы 196 больных СД 2-го типа (43 мужчины и 153 женщины) европеоидной расы, подписавшие информированное согласие на участие в исследовании. Критериями исключения являлись кетоацидоз в анамнезе и/или наличие других клинических или лабораторных признаков СД 1-го типа; признаки других специфических типов СД; злокачественные новообразования, аутоиммунные и хронические воспалительные заболевания в анамнезе; острые инфекционные и воспалительные заболевания в течение 3 мес перед исследованием; ВИЧ-инфекция; дыхательная недостаточность; хроническая болезнь почек IV—V стадии; беременность; лечение глюкокортикоидами, иммуносупрессантами, цитостатиками, нестероидными противовоспалительными средствами, тиазолидиндионами, ингибиторами дипептидилпептидазы 4-го типа, локальными или системными ингибиторами ангиогенеза в течение 3 мес перед исследованием.
 Возраст обследованных варьировал от 43 до 70 лет (медиана 63 года), длительность заболевания с момента постановки диагноза — от 1 года до 36 лет (медиана 13 лет). У 138 обследованных имелось ожирение; избыточная масса тела зафиксирована у 44 пациентов. Сахароснижающая терапия включала инсулины (у 164), препараты сульфонилмочевины (у 120), метформин (у 118), в большинстве случаев — в виде комбинаций (у 111). Уровень гликированного гемоглобина (HbA1c) находился в пределах 5,3—13% (медиана 8,3%).
Возраст обследованных варьировал от 43 до 70 лет (медиана 63 года), длительность заболевания с момента постановки диагноза — от 1 года до 36 лет (медиана 13 лет). У 138 обследованных имелось ожирение; избыточная масса тела зафиксирована у 44 пациентов. Сахароснижающая терапия включала инсулины (у 164), препараты сульфонилмочевины (у 120), метформин (у 118), в большинстве случаев — в виде комбинаций (у 111). Уровень гликированного гемоглобина (HbA1c) находился в пределах 5,3—13% (медиана 8,3%).
Диагноз ИБС был верифицирован у 76 пациентов на основании результатов тредмил-теста и/или коронарографии. Наиболее частой формой ИБС являлась стенокардия напряжения (у 63 пациентов). Инфаркт миокарда (ИМ) ранее перенесли 16 обследованных. Хроническая сердечная недостаточность (ХСН) I функционального класса (ФК) выявлена у 60 больных, II ФК — у 80, III ФК — у 7. Все пациенты имели артериальную гипертензию (АГ) и получали ингибиторы ангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II в качестве монотерапии или в комбинации с другими антигипертензивными средствами. Терапия β-адреноблокаторами проводилась у 96 обследованных, дезагрегантами — у 114. Статины в постоянном режиме получали 95 человек, фибраты — 4.
У 111 больных (в том числе у 54 с ИБС) проведен профессиональный непрерывный мониторинг уровня глюкозы в крови в течение 48—72 ч с использованием систем для мониторирования. По данным мониторинга рассчитывали средний уровень глюкозы в крови, а также параметры его вариабельности: средняя амплитуда колебаний глюкозы в крови (MAGE: Mean Aplitude of Glycemic Excursions), индекс риска развития гипергликемии (HBGI; High Blood Glucose Index), индекс риска развития гипогликемии (LBGI: Low Blood Glucose Index). Параметры вариабельности уровня глюкозы в крови рассчитывали с помощью электронного калькулятора, предложенного N. Hill и соавт. [15]. Диагностическое значение данных параметров рассмотрено в недавних обзорах [16, 17].
Исследование концентрации VEGF-A, VEGF-C и VEGF-D в сыворотке крови, взятой из локтевой вены утром натощак, проводили методом проточной флуориметрии на двухлучевом лазерном автоматизированном анализаторе с использованием наборов, в соответствии с инструкцией производителя. Порог чувствительности измерения составлял для VEGF-A 0,4 пг/мл, для VEGF-C — 2,3 пг/мл и для VEGF-D — 11,5 пг/мл. Результаты сопоставляли с контрольной группой, которую составили 24 человека (8 мужчин и 16 женщин) в возрасте от 40 до 67 лет без сердечно-сосудистых заболеваний, нарушений углеводного обмена и других критериев исключения, указанных выше.
Типирование нуклеотидов в полиморфных позициях регуляторных участков гена VEGFА -2578 A/С (rs699947) и +936 C/Т (rs3025039) проводили с помощью полимеразной цепной реакции в реальном времени с использованием TaqMan зондов на амплификаторе, согласно инструкции фирмы-производителя коммерческих тест-систем.
Протокол исследования одобрен локальным Этическим комитетом.
Статистическая обработка полученных данных проведена с использованием программы Statistica 10. Учитывая, что распределение большинства изученных признаков отличалось от нормального, применяли методы непараметрической статистики. Межгрупповые различия оценивали с помощью критерия Манна—Уитни и ANOVA Крускала—Уоллиса. Взаимосвязь признаков изучали с помощью рангового корреляционного анализа Спирмена, многофакторного логистического анализа. Распределение генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди—Вайнберга. Достоверность различий частот распределения изучаемых признаков в альтернативных группах определяли по критерию χ2 с поправкой Йетса на непрерывность и двустороннему варианту точного критерия Фишера для четырехпольных таблиц. Данные представлены в виде медианы и процентилей — Ме (25-й процентиль; 75-й процентиль). Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты
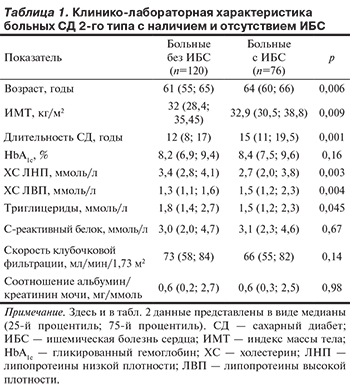
Клинико-лабораторная характеристика групп больных СД 2-го типа с ИБС и без ИБС представлена в табл. 1. Больные ИБС по сравнению с остальными пациентами оказались несколько старше, имели больший индекс массы тела (ИМТ), более длительный (с момента постановки диагноза) анамнез СД и более благоприятные показатели липидограммы (очевидно, в результате более активной терапии статинами). Не выявлено достоверных различий между группами пациентов с ИБС и без ИБС по среднему уровню глюкозы в крови — 8,1 (6,8; 9,0) и 8,0, (7,4; 9,6) ммоль/л соответственно (р=0,56) и параметрам вариабельности уровня глюкозы в крови: MAGE — 4,2 (3,6; 5,2) и 4,3, (3,5; 5,1) ммоль/л (р=0,64), HBGI — 6,1 (2,7; 8,2) и 5,6 (3,7; 9,0) усл. ед. (р=0,4), LBGI — 1,4 (0,8; 4,2) и 0,9 (0,4; 2,6) усл. ед. (р=0,47).
 Концентрация VEGF-A и VEGF-C в сыворотке крови у обследованных больных СД была достоверно ниже, чем в контрольной группе: VEGF-A — 661 (421; 1211) и 1455 (377; 2489) пг/мл соответственно; р=0,03; VEGF-C — 1790 (1066; 3803) и 4823 (1280; 6587) пг/мл соответственно; р=0,006. Уровень VEGF-D демонстрировал тенденцию к снижению — 1233 (967; 3597) и 4330 (900; 5911) пг/мл; р=0,14. Медиана уровня VEGF-A у больных СД была ниже, чем в контроле, в 2,2 раза, VEGF-C — в 2,7 раза, VEGF-D — в 3,5 раза.
Концентрация VEGF-A и VEGF-C в сыворотке крови у обследованных больных СД была достоверно ниже, чем в контрольной группе: VEGF-A — 661 (421; 1211) и 1455 (377; 2489) пг/мл соответственно; р=0,03; VEGF-C — 1790 (1066; 3803) и 4823 (1280; 6587) пг/мл соответственно; р=0,006. Уровень VEGF-D демонстрировал тенденцию к снижению — 1233 (967; 3597) и 4330 (900; 5911) пг/мл; р=0,14. Медиана уровня VEGF-A у больных СД была ниже, чем в контроле, в 2,2 раза, VEGF-C — в 2,7 раза, VEGF-D — в 3,5 раза.
Больные СД с ИБС по сравнению с остальными пациентами имели более высокий уровень VEGF-A (табл. 2). Повышение уровня VEGF-D не достигло степени статистической значимости. Концентрация VEGF-C не различалась между группами. Уровень VEGF-A, VEGF-C и VEGF-D у больных ИБС оставался ниже, чем в группе контроля (p=0,03, p=0,004 и p=0,05 соответственно).
Концентрация VEGF-A у больных с ХСН была достоверно выше, чем у пациентов без данного осложнения, — 704 (455; 1294) и 491 (358; 1109) пг/мл соответственно; р=0,02. Уровень фактора возрастал по мере увеличения выраженности ХСН (р=0,02). У больных с ХСН по сравнению с остальными пациентами прослеживалась тенденция к повышению концентрации VEGF-D — 1324 (997; 3825) по сравнению с 1089 (904; 2437) пг/мл; р=0,06. Уровень VEGF-C не зависел от наличия ХСН и ее ФК.
Не выявлено зависимости уровня регуляторов ангиогенеза от пола, наличия других сосудистых осложнений, применения лекарственных препаратов различных классов.
По данным корреляционного анализа, между тремя исследованными пептидами обнаружены сильные положительные взаимосвязи. Уровень VEGF-A коррелировал с VEGF-C (r=0,81; p<0,0001) и VEGF-D (r=0,87; р<0,0001). Концентрация VEGF-C демонстрировала корреляцию с VEGF-D (r=0,8; р<0,0001). Не установлены взаимосвязи между уровнем VEGF-A, С и D и параметрами углеводного обмена: HbA1c, средним уровнем глюкозы в крови и параметрами его вариабельности, рассчитанными по данным непрерывного мониторинга. Уровень исследованных пептидов не был связан с возрастом пациентов, ИМТ, уровнем холестерина липопротеинов высокой и низкой плотности, триглицеридов, скоростью клубочковой фильтрации и соотношением альбумин/креатинин мочи. Все исследованные пептиды продемонстрировали слабую обратную связь с концентрацией С-реактивного белка, измеренного высокочувствительным методом (r=–0,2; p=0,005).
Анализ SNPs гена VEGFA не выявил взаимосвязи между частотой аллелей и генотипов в полиморфной позиции –2578 A/С (rs699947) и наличием ИБС. Вместе с тем, аллель С и генотип СС в положении +936 (rs3025039) оказались ассоциированы с ИБС. Минорный аллель T и гетерозиготный генотип СТ в данной позиции выявлялись достоверно чаще в группе больных без ИБС (табл. 3). Гомозиготный генотип ТТ был выявлен лишь у одного пациента и в статистическом анализе не учитывался. Взаимосвязь аллеля С с ИБС сохранялась в многофакторном логистическом анализе, включавшем возраст, курение, ИМТ, уровень липидов, длительность АГ и СД, уровень HbA1c в качестве предикторов (р=0,03).
Пациенты с СД 2-го типа — носители аллеля Т в положении +936 гена VEGFA имели более высокую концентрацию VEGF-А в сыворотке крови по сравнению с обладателями аллеля С — 1125 (609; 1622) и 636 (411; 952) пг/мл соответственно; р=0,005. Гетерозиготный генотип CT был ассоциирован с более высоким уровнем VEGF-А по сравнению с генотипом СС — 1146 (666; 1643) и 636 (411; 952) пг/мл соответственно; р=0,003.
Обсуждение
В нашей работе были впервые сопоставлены изменения уровней циркулирующих регуляторов подсемейства VEGF: VEGF-A, VEGF-C и VEGF-D у больных СД. В большинстве предыдущих работ изучались изменения только VEGF-A. Использованный нами метод мультиплексного анализа (проточной флуориметрии) позволяет одномоментно изучать концентрации различных веществ в образце биологического материала. Важность такого подхода определяется тем, что разные пептиды семейства VEGF могут перекрестно реагировать с рецепторами (в частности, VEGFR-2). В итоге ангиогенный ответ зависит от изменений продукции не только VEGF-A, но и других членов семейства [18, 19]. Нами показано, что между уровнями VEGF-A, VEGF-C и VEGF-D существуют тесные корреляции, а это косвенно указывает на общность путей регуляции продукции данных пептидов. Вместе с тем взаимосвязь с ИБС и ХСН продемонстрировал уровень VEGF-A и в меньшей степени — VEGF-D. Концентрация основного регулятора лимфангиогенеза VEGF-C не была связана с сердечно-сосудистой патологией.
 В работе зафиксировано снижение уровня в сыворотке крови ключевых регуляторов новообразования сосудов (VEGF-A, VEGF-C и VEGF-D) у больных СД 2-го типа. Это согласуется с данными о подавлении адаптивного ангиогенеза в миокарде в условиях ишемии при СД [20]. Причины нарушения продукции VEGF при СД неясны. У здоровых лиц индуцированная гипергликемия приводит к снижению уровня циркулирующего VEGF, в то время как гипогликемия способствует повышению концентрации фактора [9]. У больных СД 1-го типа уровень VEGF в крови увеличивается во время гипогликемии [10, 11]. Поскольку VEGF регулирует проницаемость гематоэнцефалического барьера в критических состояниях, предполагают, что его повышение в условиях гипогликемии является компенсаторной реакцией, направленной на повышение снабжения головного мозга глюкозой [21]. Больные СД 2-го типа имеют сниженный ответ VEGF на гипогликемию [22]. В данной работе мы сопоставили уровень циркулирующих пептидов VEGF с параметрами вариабельности уровня глюкозы в крови, отражающими колебания глюкозы в гипер- и гипогликемическом диапазоне. Взаимосвязь концентрации VEGF-A, C и D c показателями вариабельности уровня глюкозы в крови, рассчитанными по данным непрерывного мониторинга глюкозы, а также с содержанием HbA1c, не обнаружена.
В работе зафиксировано снижение уровня в сыворотке крови ключевых регуляторов новообразования сосудов (VEGF-A, VEGF-C и VEGF-D) у больных СД 2-го типа. Это согласуется с данными о подавлении адаптивного ангиогенеза в миокарде в условиях ишемии при СД [20]. Причины нарушения продукции VEGF при СД неясны. У здоровых лиц индуцированная гипергликемия приводит к снижению уровня циркулирующего VEGF, в то время как гипогликемия способствует повышению концентрации фактора [9]. У больных СД 1-го типа уровень VEGF в крови увеличивается во время гипогликемии [10, 11]. Поскольку VEGF регулирует проницаемость гематоэнцефалического барьера в критических состояниях, предполагают, что его повышение в условиях гипогликемии является компенсаторной реакцией, направленной на повышение снабжения головного мозга глюкозой [21]. Больные СД 2-го типа имеют сниженный ответ VEGF на гипогликемию [22]. В данной работе мы сопоставили уровень циркулирующих пептидов VEGF с параметрами вариабельности уровня глюкозы в крови, отражающими колебания глюкозы в гипер- и гипогликемическом диапазоне. Взаимосвязь концентрации VEGF-A, C и D c показателями вариабельности уровня глюкозы в крови, рассчитанными по данным непрерывного мониторинга глюкозы, а также с содержанием HbA1c, не обнаружена.
Известно, что основным стимулом к продукции VEGF и запуску ангиогенеза является гипоксия. Увеличение продукции фактора, индуцируемого гипоксией (HIF-1: hypoxia-inducible factor 1), — необходимое звено в цепи молекулярных реакций, запускающих синтез VEGF и ангиогенез [23]. В условиях гипергликемии продукция HIF-1 в ответ на снижение доставки кислорода снижается [24]. В нашем исследовании уровень VEGF-A в сыворотке крови у больных СД 2-го типа с сопутствующей ИБС был выше, чем у больных без ИБС, но ниже, чем у лиц без ИБС и СД. Сообщалось, что у больных СД 2-го типа наблюдается более высокий подъем уровня VEGF-A в крови при развитии ИМ по сравнению с больными без СД [20]. По-видимому, пациенты с СД в определенной степени сохраняют способность реагировать повышением продукции VEGF на ишемию/гипоксию. У обследованных нами больных уровень VEGF повышался по мере увеличения выраженности ХСН. Можно предполагать, что развитие ХСН (и ассоциированной с ней тканевой гипоксии) служит дополнительным стимулом к увеличению продукции VEGF-A у больных с ИБС на фоне СД.
Помимо гипергликемии и гипоксии на продукцию VEGF у больных СД могут влиять генетические факторы. По имеющимся данным, генотип СС в позиции +634 гена VEGFA ассоциирован с ИМ у больных СД 2-го типа [25]. Нами выявлен более высокий уровень VEGF-A у носителей аллеля T в положении +936 гена VEGFA. Данный вариант гена оказался протективным по отношению к ИБС и был ассоциирован с более высоким уровнем циркулирующего VEGF-A. Ранее H.W. Kim и соавт. выявили более высокий уровень VEGF у больных СД 2-го типа — носителей генотипа TT в данной позиции [26].
Уровень VEGF-A в крови и варианты его гена могут влиять на коллатеральное кровоснабжение миокарда и ангиогенез в условиях ишемии. Обнаружено, что концентрация VEGF-A в крови, взятой из коронарного синуса, коррелирует с развитием коллатералей в миокарде у больных ИБС [27]. Низкий уровень VEGF в периферической крови ассоциирован со слабым развитием коллатерального кровотока в миокарде у пациентов со стабильным течением ИБС [8]. Показана прямая связь уровня изоформы 165 VEGF-A в периферической крови с развитием коллатерального кровообращения у больных ИБС с полной и длительной (более 24 мес) окклюзией коронарной артерии [7]. Определение значения VEGF-A как потенциального маркера неоангиогенеза в миокарде у больных СД обусловливает необходимость дальнейших исследований.
Заключение
Полученные данные свидетельствуют о нарушении регуляции процесса ангиогенеза при сахарном диабете. Уровень ключевых регуляторов новообразования кровеносных и лимфатических сосудов (VEGF-A и VEGF-C) в сыворотке крови у больных сахарным диабетом 2-го типа существенно снижен. При этом величина гипергликемии и параметры вариабельности уровня глюкозы в крови не связаны с уровнем VEGF-A, VEGF-C и VEGF-D.
Пациенты с ишемической болезнью сердца на фоне сахарного диабета 2-го типа имеют более высокий уровень VEGF-A по сравнению с больными сахарным диабетом без ишемической болезни сердца. Тем не менее уровень VEGF-A у больных ишемической болезнью сердца и сахарным диабетом 2-го типа определяется ниже контрольного.
На уровень VEGF-A в сыворотке крови влияет функциональный полиморфизм гена VEGFA rs3025039. Аллель Т в позиции +936 гена VEGFA ассоциирован с более высоким уровнем VEGF-A и отсутствием ишемической болезни сердца.
Исследование выполнено за счет гранта Российского научного фонда (проект № 14-15-00082).



