Болезни системы кровообращения (БСК) — основная причина в структуре смертности взрослого населения экономически развитых стран. По данным Росстата, в 2014 г. смертность от БСК в России была очень высокой и составила 653,7 на 100 тыс. населения [1]. Среди БСК именно ишемическая болезнь сердца (ИБС) является ведущей причиной смерти населения в мире и России [1, 2]. В Европе ИБС — причина 20% смертей [3]. По инвалидизирующим последствиям ИБС находится на 5-м месте среди всех заболеваний и к 2020 г. может выйти на 1-е место [2].
Лечение больного, страдающего ИБС, представляет собой многоступенчатый процесс, включающий оптимальную медикаментозную терапию, высокотехнологичные эндоваскулярные и хирургические методы реваскуляризации миокарда. Хирургическая реваскуляризация миокарда (коронарное шунтирование — КШ) — сложное и травматичное вмешательство. К основным методам создания обходного пути коронарного кровотока относят маммарокоронарный анастомоз посредством внутренней грудной артерии (ВГА) и аортокоронарное шунтирование (АКШ) аутовенозным (собственная подкожная вена) или аутоартериальным (собственные внутренние грудные артерии или лучевая артерия) трансплантатом. Риск развития осложнений возрастает по мере увеличения количества шунтов. Однако благодаря современным достижениям кардиохирургии летальность при КШ снизилась до 3,7% [4]. Лечение больных ИБС хирургическими методами дает возможность увеличить продолжительность жизни пациентов с выраженными атеросклеротическими поражениями коронарных артерий (КА) — трехсосудистым поражением, стенозом ствола левой КА, ишемической дисфункцией левого желудочка (ЛЖ), тяжелой стенокардией [5]. По данным исследования SYNTAX, операция АКШ снижала вероятность развития тяжелых сердечно-сосудистых осложнений (ССО): через 1 год и 5 лет частота развития всех ССО составила 12,4 и 26,9%, смерти — 3,5 и 5,4%, инфаркта миокарда (ИМ) — 3,3 и 7,3%, повторных вмешательств – 5,9 и 12,8% соответственно [6].
После выписки из стационара сохранение достигнутого успеха операции и дальнейшее течение заболевания зависят от мероприятий, направленных на улучшение отдаленных результатов и прогноза ИБС. По данным ангиографических исследований, ежегодно прекращают функционировать от 4 до 9% венозных шунтов, что приводит к возобновлению симптомов стенокардии [7]. По данным исследования ACIP (Asymptomatic Cardiac Ischemia Pilot Study), после хирургической реваскуляризации миокарда в течение года у 43% больных вновь появляются признаки преходящей ишемии миокарда, а по данным исследования Y. Kataoka, у 5% больных развивается ИМ [5, 8]. В исследовании BARI (Bypass Angioplasty Revascularization Investigation) усугубление поражения ЛЖ за 5 лет наблюдения отмечено у 51% пациентов после КШ [9].
Ишемия после КШ чаще является следствием несостоятельности шунтов из-за атеросклеротического процесса в самом шунте или прогрессирования его в КА, дистальнее наложенного аортокоронарного шунта. В 75% случаев выявляются изменения в КА, не затронутых вмешательством.
Очевидно, что клинический успех реваскуляризация миокарда при КШ во многом зависит от последующего правильного ведения пациента и его активного вовлечения в комплексные программы реабилитации и вторичной профилактики. Доказано, что программы кардиореабилитации направлены на увеличение продолжительности и качества жизни (КЖ), предотвращение ССО и смерти, прогрессирования атеросклероза и тромбоза, госпитализаций и повторных инвазивных/хирургических вмешательств. Участие пациента в кардиореабилитационных программах существенно изменяет его физическое и психологическое здоровье, разрушает «болезненные» или приводящие к болезни установки и условные связи на фоне воспитания новых полезных поведенческих навыков, формирует мотивацию к выздоровлению и поддержанию здорового образа жизни [10, 11].
По данным мета-анализа, выполненного R.S. Taylor и соавт. (2004), применение реабилитационных программ, основанных на физических тренировках (ФТ), у больных ИБС (n=8940) приводит к снижению смертности от всех причин на 20% и смертности от ССО — на 26% [12]. B.G. Hammill и соавт. оценивали клинические эффекты программы кардиологической реабилитации у 73 049 пациентов, перенесших ИМ, чрескожную коронарную ангиопластику или КШ [13]. Через год показатели смертности у пациентов, прошедших реабилитацию, были в 2 раза ниже (2,2%), чем у пациентов, не вовлеченных в нее (5,3%). При этом 5-летняя смертность у пациентов, прошедших 25 сезонов реабилитации, была на 20% ниже, чем у пациентов, тренировавшихся менее 25 сезонов.
Важный результат КШ — восстановление трудоспособности пациента, хотя в настоящее время процент возврата больных, перенесших КШ, к трудовой деятельности остается невысоким. При этом основной проблемой являются не медицинская составляющая, а социальный аспект (неготовность самих пациентов к возобновлению труда) и несовершенство законодательной базы. Именно участие пациентов в программах кардиореабилитации после КШ содействует их более активному возвращению к полноценной жизни и труду.
Программа кардиореабилитации больных после КШ основана на дифференцированном применении разных ее аспектов: адекватного назначения медикаментозной терапии, физической и психологической реабилитации, контроля факторов риска (ФР) развития сердечно-сосудистых заболеваний. Трехэтапный процесс кардиореабилитации пациента, перенесшего КШ, осуществляется мультидисциплинарной командой под руководством кардиолога.

Настоящие реалии здравоохранения указывают на сокращение сроков пребывания больного в стационаре после КШ. В этой связи такие пациенты должны переводиться в стационарное кардиореабилитационное отделение второго этапа реабилитации (в первую очередь, пациенты с высоким риском развития осложнений и низким/средним реабилитационным потенциалом), а после выписки из него поступать в поликлиническое кардиореабилитационное отделение третьего этапа реабилитации. Пациенты после КШ без осложнений и с высоким/очень высоким реабилитационным потенциалом могут сразу направляться в поликлиническое кардиореабилитационное отделение, т.е. на третий этап реабилитации. Для запуска кардиореабилитационной системы помимо существующих организационных проблем необходима методологическая основа, эффективность которой оценена в рандомизированных клинических исследованиях. В этой связи имеется потребность в оптимизации программ кардиореабилитации и ее физического аспекта для их раннего применения после КШ на третьем этапе реабилитации (на который будет поступать большинство пациентов). Такая программа должна сочетать в себе эффективные и безопасные контролируемые (проводимые в лечебном учреждении) и неконтролируемые (проводимые в домашних условиях) ФТ.
Следует отметить, что реабилитационные мероприятия у пациентов, перенесших хирургическую реваскуляризацию КА, имеют ряд особенностей. В раннем послеоперационном периоде у таких больных наблюдаются последствия травмы грудной клетки и мягких тканей конечностей в местах забора венозного трансплантата, метаболические нарушения в миокарде, гиперсимпатикотония, часто встречаются нарушения ритма сердца (особенно фибрилляция предсердий), у отдельных больных выявляются признаки коронарной недостаточности или недостаточности кровообращения. Сроки начала активных ФТ у оперированных больных зависят не только от функционального состояния сердечно-сосудистой системы, но и от выраженности послеоперационных осложнений и времени консолидации грудины. Достаточно долгое заживление грудины обусловливает исключение упражнений на «раздвижение» грудной клетки и поднятие больными тяжестей в течение первых месяцев после вмешательства.
Актуален вопрос возможности сокращения продолжительности контролируемых ФТ при начале последних в ранние сроки после хирургического вмешательства и перевода больных на программы тренировок в домашних условиях.
Цель настоящего исследования — оценка клинической эффективности ранней постстационарной реабилитации больных ИБС, перенесших КШ, в условиях поликлинического отделения кардиологической реабилитации (третьего этапа кардиореабилитации).

Материал и методы
В исследование были включены мужчины (n=36), страдающие ИБС и перенесшие КШ, через 3—8 нед с момента операции (в среднем через 7,8±1,6 нед). Все пациенты подписали информированное согласие на участие в исследовании.
Критериями отказа от включения пациентов в исследование были ранняя послеоперационная стенокардия, перикардит (по данным эхокардиографии — ЭхоКГ, объем жидкости в перикарде 200 мл и более или расхождение листков перикарда в диастолу в области задней стенки на 1 см и более, или наличие небольшого количества жидкости в перикарде и выраженные признаками воспалительного процесса), диастаз грудины и другие послеоперационные осложнения (нарушение заживления послеоперационной раны в области грудины, лигатурные свищи в области голеней и бедер, выраженный болевой синдром в области послеоперационных рубцов грудины), выраженные нарушения ритма сердца и проводимости, выраженная сердечная недостаточность, мощность пороговой физической нагрузки (ФН) при велоэргометрической пробе (ВЭМ) менее 50 Вт, уровень артериального давления (АД) выше 180/100 мм рт.ст., инсульт или транзиторная ишемическая атака в анамнезе, сужение внутреннего диаметра сонных артерий ³50%, синдром перемежающейся хромоты, рецидивирующие тромбоэмболические осложнения, сахарный диабет (СД) тяжелого течения, патологическое ожирение, выраженные нарушения внешнего дыхания, сопутствующие заболевания, мешающие проведению ФТ.
 После исходного клинико-инструментального обследования больных рандомизировали в 2 группы: основную группу (n=18 человек, средний возраст 58,6±7,0 года), больные которой занимались по программе образовательной «Школы для больных, перенесших КШ» (далее «Школа»), контролируемыми и неконтролируемыми (в домашних условиях) ФТ; контрольную группу (n=18, средний возраст 55,9±7,0 года), в которой больные проходили только обучение в образовательной «Школе» с рекомендацией неконтролируемых ФТ в условиях дома.
После исходного клинико-инструментального обследования больных рандомизировали в 2 группы: основную группу (n=18 человек, средний возраст 58,6±7,0 года), больные которой занимались по программе образовательной «Школы для больных, перенесших КШ» (далее «Школа»), контролируемыми и неконтролируемыми (в домашних условиях) ФТ; контрольную группу (n=18, средний возраст 55,9±7,0 года), в которой больные проходили только обучение в образовательной «Школе» с рекомендацией неконтролируемых ФТ в условиях дома.
Содержание комплексной кардиореабилитационной программы. Занятия в образовательной «Школе» под руководством кардиолога в группах (до 9 человек) 1 раз в неделю, продолжительностью 60—80 мин, в течение 5 нед.
Контролируемые ФТ (разработанные Д.М. Ароновым и соавт.) под врачебным контролем (не ранее чем через 3 нед от операции КШ) продолжительностью до 60 мин, в группах (по 6—10 человек), 3 раза в неделю на протяжении 4 мес. Программа состояла из комплекса гимнастических упражнений и велотренировок на механических велотренажерах фирмы «Tunturi» (Финляндия) в режиме умеренной интенсивности — 50—60% от индивидуальной пороговой мощности ФН. Из тренировочных занятий исключали упражнения на «раздвижение» грудной клетки, упражнения на полу и упражнения с отягощением более 2 кг в первые месяцы от операции. ФТ выполнялись на базе поликлинического кардиореабилитационного отделения консультативно-диагностической поликлиники Московского научно-практического центра интервенционной кардиологии.
Неконтролируемые ФТ в домашних условиях, включающие комплексы гимнастических упражнений (по методике Д.М. Аронова и соавт.), предлагались больным в виде распечаток и рекомендовались к выполнению в течение года наблюдения.
Критериями прекращения участия пациента в исследовании были развитие тяжелых ССО (ИМ, инсульт, тромбоэмболия легочной артерии и др.), невыполнение требований настоящего исследования (прекращение занятий ФТ по любой причине, несоблюдение сроков обследования, отказ от лекарственной терапии).
Больных обследовали на момент включения, через 4, 6 и 12 мес. Общая продолжительность наблюдения в исследовании составила 1 год.
План обследования больных включал сбор анамнеза; физическое обследование, осмотр — измерение АД, частоты сердечных сокращений (ЧСС), антропометрические характеристики; электрокардиограмма (ЭКГ) покоя в 12 отведениях; ЭхоКГ на ультразвуковом сканере Acuson 128XP/10 (США) по стандартной методике с определением линейных и объемных показателей сердца (фракцию выброса — ФВ левого желудочка — ЛЖ определяли по методу Симпсона); велоэргометрическая проба – проба на велоэргометре по непрерывно ступенеобразно возрастающей методике с увеличением на 25 Вт (150 кгм/мин) каждые 3 мин до достижения клинических или электрокардиографических критериев прекращения нагрузки (ВОЗ, 1973, Аронов Д.М., 1995), или субмаксимальной ЧСС (Andersen K.L., 1971) со скоростью педалирования 60 оборотов в минуту. Величина «двойного произведения» (ДП) в усл.ед.: ДП = ЧСС · систолическое АД (САД)/100. Экономичность работы сердца при ФН по ДП (в Вт/усл.ед.) рассчитывали по формуле: отношение объема выполненной работы сердца к среднему приросту ДП за период нагрузки (ДПсум. = [ДП макс. – ДП покоя] x + Т/2).

Лабораторные методы исследования: кровь из локтевой вены; сыворотку крови получали центрифугированием при 3000 об/мин в течение 15 мин цельной крови, взятой у пациента утром натощак (после 12—14-часового голодания) из локтевой вены. Содержание в сыворотке крови общего холестерина (ХС), триглицеридов (ТГ) и ХС липопротеидов высокой плотности (ЛВП) определяли на автоанализаторе с помощью ферментативных диагностических наборов; содержание ХС липопротеидов низкой плотности (ЛНП) рассчитывали по формуле Фридвальда (1972); показатели липидного состава крови выражали в ммоль/л. Концентрацию глюкозы (в ммоль/л) определяли в сыворотке крови на автоанализаторе глюкозооксидазным методом. Уровень фибриногена (в г/л) определяли методом Clauss по стандартной таблице, измеряя время образования сгустка в плазме крови в ответ на добавление раствора тромбина. В целях получения цитратной плазмы, используемой для исследования фибриногена, венозную кровь быстро смешивали с цитратом натрия (0,11 М) в соотношении 9:1 и центрифугировали в течение 10 мин при 2000 об/мин.
Исследования методом тестирования: опросник по двигательной активности ОДА23+ (разработано Ароновым Д.М., Красницким В.Б., Бубновой М.Г. патент на изобретение № 2485895 от 27 июня 2013 г.); опросник по питанию, опросник КЖ (по Аронову Д.М., Зайцеву В.П., 1982, 2002), госпитальная шкала тревоги-депрессии (HADS, Zigmound A.S., Snaith R.P., 1983) — выявление и оценка тяжести депрессии и тревоги [14, 15]. Все опросники заполнялись больными самостоятельно на основании предварительной краткой инструкции.
Статистическую обработку данных проводили с использованием стандартных методов вариационной статистики с помощью пакета прикладных программ SAS (Statistical Analysis Systems, SAS Institute. США). Данные представлены в виде среднего арифметического значения (М) и среднеквадратичного отклонения (σ). Статистическую значимость различий оценивали с помощью парного и непарного критерия t Стьюдента, а также критерия c2. Различия при р<0,05 рассматривали как статистически значимые.
Результаты и обсуждение
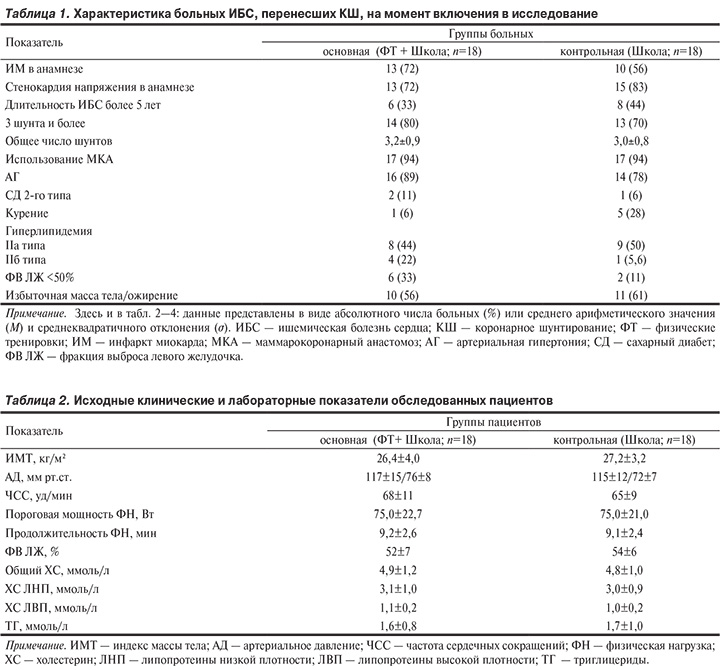
Характеристика больных коронарной болезнью сердца (КБС), включенных в исследование. У пациентов, перенесших КШ, обращает внимание распространенность факторов риска (ФР), связанных с КБС Так, у 83,4% пациентов выявлялась артериальная гипертония (АГ), у 61,2% — гиперлипидемия, у 33,3% — избыточная масса тела (индекс массы тела — ИМТ ≥25 и <30 кг/м2), у 25% — ожирение (ИМТ ≥30 кг/м2), у 8,3% — СД 2-го типа. После операции продолжали курить 16,6% больных. Исходная характеристика больных ИБС, которым выполнено КШ, по группам представлена в табл. 1. Статистически значимых различий между группами не обнаружено.
 Исходно пациенты двух групп не различались по ИМТ, уровню АД, ЧСС, показателям физической работоспособности (ФРС), ФВ ЛЖ, содержанию липидов и липопротеидов в крови (табл. 2). Исходные средние уровни АД на фоне терапии были в пределах рекомендуемых целевых значений. ФВ ЛЖ у пациентов обеих групп была сохранена (>50%). В то же время обращали внимание высокие уровни ХС ЛНП (выше рекомендуемой цели <1,8 ммоль/л) на момент включения пациентов в исследование.
Исходно пациенты двух групп не различались по ИМТ, уровню АД, ЧСС, показателям физической работоспособности (ФРС), ФВ ЛЖ, содержанию липидов и липопротеидов в крови (табл. 2). Исходные средние уровни АД на фоне терапии были в пределах рекомендуемых целевых значений. ФВ ЛЖ у пациентов обеих групп была сохранена (>50%). В то же время обращали внимание высокие уровни ХС ЛНП (выше рекомендуемой цели <1,8 ммоль/л) на момент включения пациентов в исследование.
Все больные, включенные в исследование, находились на стандартной терапии, рекомендованной для лечения больных ИБС с учетом противопоказаний и продолжающейся до окончания исследования (табл. 3). В целом характер лекарственной терапии внутри групп за период наблюдения статистически значимо не изменился, за исключением сокращения приема нитратов в основной группе к 4-му месяцу ФТ и некоторого увеличения (на 11%) в обеих группах числа пациентов, принимавших ингибиторы ангиотензинпревращающего фермента (АПФ).
Динамика показателей ФРС. Исходно сравниваемые группы больных ИБС, перенесших КШ, не различались по основным показателям ФРС. Заметные различия между группами появились, когда пациенты основной группы закончили 4-месячный курс контролируемых ФТ, причем достигнутый позитивный эффект ФТ сохранялся в течение последующего года наблюдения.
Так, у больных ИБС, перенесших КШ и прошедших 4-месячный курс ФТ, статистически значимый рост продолжительности выполняемой ФН отмечался сразу по окончании ФТ через 4 мес (на 32,6%; р<0,05), а также через 6 мес (на 47%; р<0,05) и 12 мес (на 37,9%; р<0,05) (рис. 1). У больных, не тренировавшихся после КШ, но прошедших образовательную Школу, прирост продолжительности ФН также наблюдался, однако он был небольшим (на 9,8%; р<0,05) и проявился только к 12-му месяцу от начала исследования.
Пороговая мощность ФН в основной группе (ФТ + Школа) пациентов в отличие от контрольной группы (Школа) статистически значимо увеличилась не только через 4 мес (на 35,2%; р<0,05), но и через 6 мес (на 53,9%; р<0,05), и 12 мес (на 49,5%; р<0,05) (см. рис. 1). В то же время в отсутствие физической реабилитации после КШ толерантность к ФН у больных не изменялась. Если у пациентов основной группы общий объем физической работы в начале исследования составлял 30,0±13,3 кДж и не отличался от такового в контрольной группе (29,6±13,0 кДж; р>0,05), то через 4 мес ФТ этот показатель у них увеличился (на 63,2%; р<0,05) с последующим выраженным приростом к 6-му месяцу (на 101,9%; р<0,05) и 12-му месяцу (на 85,3%; р<0,05) (см. рис. 1). Напротив, у больных после КШ без ФТ общий объем физической работы оставался на исходном уровне.
Величина ДП, косвенно указывающая на повышение максимального потребления миокардом кислорода при пороговой ФН, в основной группе на фоне ФТ статистически значимо повышалась в течение всего периода наблюдения (на 25,5% от исходного; р<0,05), тогда как в контрольной группе пациентов не изменилась. В результате такой показатель, как экономичность работы сердца при ФН, у тренировавшихся больных после КШ к концу года наблюдения был статистически значимо выше (на 25,7%; р<0,05), чем у нетренировавшихся пациентов (рис. 2).
Таким образом, комплексная программа реабилитации с включением систематических ФТ, проводимая больным после КШ в ранние сроки и в условиях поликлинического кардиореабилитационного отделения, статистически значимо способствовала повышению толерантности к ФН и объема выполняемой физической работы на фоне роста экономичности работы сердца. При этом клинический успех программы кардиореабилитации был достигнут при применении сокращенного до 4 мес курса контролируемых ФТ вместо обычного, ранее принятого курса контролируемой физической реабилитации (6 мес и более). Очевидно, что ФТ помогают больным после КШ быстрее адаптировать организм к повседневным ФН и ускоряют репаративные процессы. Известно, что повышение ФРС на 1 метаболическую единицу сопряжено со снижением риска смерти от всех причин на 12% [16]. ФТ — это один из самых действенных методов, существенно повышающих ФРС пациентов после КШ. Напротив, у больных, перенесших КШ и не участвовавших в программе физической реабилитации, хотя и посещающих образовательную «Школу», заметного улучшения основных показателей ФРС в течение года наблюдения не произошло.

Динамика структурно-геометрических и линейных параметров по данным ЭХоКГ. Исходно показатели ЭхоКГ у больных, перенесших КШ, двух сравниваемых групп были сопоставимы. Но через 4 мес у тренировавшихся больных отмечалось некоторое увеличение ФВ ЛЖ (на 1,5%; p<0,05; табл. 4). К 12-му месяцу у этих пациентов наблюдался рост ударного объема (УО) ЛЖ (на 6,8%; p<0,05) при уменьшении конечного систолического объема (КСО) ЛЖ (на 2,4%; p<0,05).
У нетренировавшихся больных после КШ к 12-му месяцу наблюдения также выявлялось увеличение УО ЛЖ (на 6,5%; p<0,05), но при отсутствии позитивной динамики других показателей (табл. 5). За период наблюдения в обеих сравниваемых группах не наблюдалось изменения толщины межжелудочковой перегородки и задней стенки ЛЖ.
Итак, на фоне ФТ в течение 4 мес улучшения структурно-геометрических показателей и систолической функции ЛЖ у больных ИБС после КШ можно ожидать в более ранние сроки, чем без систематических ФТ.
Динамика показателей липидного состава крови. Исходные показатели состава спектра крови у больных двух групп были сопоставимы (см. табл. 2). Отсутствие ФТ в программе реабилитации больных после КШ отрицательно повлияло на уровни липидов и липопротеидов в крови: отмечался рост концентрации атерогенных фракций — общего ХС и ХС ЛНП к 12-му месяцу на 10,2% (p<0,05) и 15,6% (p<0,05) соответственно. При этом число пациентов с целевым уровнем ХС ЛНП (<1,8 ммоль/л) сократилось в 2,5 раза. Напротив, в группе тренировавшихся пациентов после ФТ число больных с целевыми уровнями ХС ЛНП и ТГ увеличилось.
Таким образом, программа физической реабилитации, в которую включались больные после КШ, предотвращает рост концентрации атерогенных липидных фракций, вовлеченных в прогрессирование атеросклероза в КА. Важно отметить, что 94% пациентов в обеих группах, наблюдаемых в исследовании, получали статины (см. табл. 3).
Динамика содержания фибриногена и глюкозы в крови. У тренировавшихся и нетренировавшихся больных, перенесших КШ, исходный уровень фибриногена в плазме крови был выше нормы (4,6±1,3 и 4,6±1,1 г/л соответственно) и оставался таковым в течение годичного наблюдения.
Больные обеих сравниваемых групп в течение годичного наблюдения были сопоставимы по среднему уровню глюкозы в плазме крови (уровень был в пределах нормы): в основной группе исходно 5,6±1,0 ммоль/л, через 4 мес — 5,5±0,8 ммоль/л, через 12 мес — 5,6±0,8 ммоль/л; в конт-рольной группе — 5,6±1,7, 5,6±1,9 и 5,8±1,7 ммоль/л соответственно.
Динамика основных ФР. В работе был проведен анализ влияния 4-месячной программы ФТ и образовательной Школы на такие традиционные ФР развития ССО, как ИМТ (показатель избыточной массы тела и ожирения), уровни АД и ЧСС. Динамика указанных показателей была отслежена в течение года.
Средний ИМТ у пациентов основной группы исходно составлял 26,4±4,0 кг/м² без статистически значимого изменения в течение годичного наблюдения. У пациентов, прошедших только образовательную Школу без участия в программе ФТ, ИМТ увеличился с 27,2±3,2 до 28,0±3,4 кг/м² (р<0,05) к 6-му месяцу и до 28,4±3,4 кг/м² (р<0,05) к 12-му месяцу (т.е. на 4,4%).
В настоящее время ожирение рассматривается как независимый предиктор увеличения послеоперационной смертности у больных, направляемых на КШ. Участие таких пациентов в программах физической реабилитации ФТ позволяет лучше контролировать им массу тела.
Средний уровень офисного АД исходно и в процессе наблюдения находился в пределах целевого значения в обеих группах больных, перенесших КШ: в основной группе АД исходно составляло 117±15/ 76±8 мм рт.ст., через 4 мес — 115±10/72±4 мм рт.ст., через 12 мес — 118±15/74±10 мм рт.ст., а в контрольной группе — 115±12/74±10, 118±16/72±8 и 118±12/75±7 мм рт.ст. соответственно. Это в первую очередь можно объяснить влиянием адекватной антигипертензивной терапии и высокой приверженностью к ней пациентов после КШ.
У больных после ФТ наблюдалось урежение средней ЧСС в покое на 8,8% (с 68±11 до 62±6 уд/мин; р<0,05) через 4 мес и на 9,2% (от исходного до 62±6 уд/мин; р<0,05) через 6 мес, что, очевидно, является следствием тренировочного эффекта. Однако к 12-му месяцу без систематических ФТ ЧСС возвратилась к исходной (67±10 уд/мин). В контрольной группе без ФТ статистически значимых различий по динамике ЧСС в течение 12 мес не выявлено (исходно 65±9 уд/мин, через 12 мес 64±12 уд/мин; р>0,05). Таким образом, участие пациентов после КШ в программе физической реабилитации в сочетании с образовательной Школой препятствует сдвигу ФР развития ССО в негативном направлении.
Динамика ежедневной физической активности (ФА) и характера питания. В соответствии с протоколом исследования у больных ИБС, перенесших КШ, проводилась оценка ежедневной ФА с помощью опросника ОДА23+ [15]. Низкому уровню ежедневной ФА соответствовало менее 62 набранных по опроснику баллов, среднему — 62—84 балла, высокому — более 84 баллов.
Исходный уровень ежедневной ФА пациентов сравниваемых групп больных после КШ находился в пределах среднего и был сопоставим: в основной группе — 79±13 баллов и контрольной группе — 70±18 баллов (рис. 3).
Участие больных после КШ в программе 4-месячных ФТ привело к статистически значимому росту их ежедневной ФА через 4 мес на 13% (р<0,05), и ее уровень определялся как высокий. Однако уже через 2 мес после окончания курса ФТ уровень ежедневной ФА снизился до исходного среднего. Одной из возможных причин такого снижения уровня ежедневной ФА по окончании еженедельных физических занятий в лечебном учреждении является невысокая приверженность пациентов к поддержанию достигнутого в ходе тренировок уровня ФА посредством продолжения тренировок в домашних условиях. У пациентов контрольной группы уровень ежедневной ФА в ходе исследования не изменялся и оставался на среднем уровне.
У больных, наблюдавшихся в течение 12 мес, был проанализирован характер питания. Питание пациента оценивалось как неправильное при общей сумме набранных по опроснику баллов от 30 до 60, как требующее некоторой коррекции — от 61 до 70, как близкое к правильному и требующее минимальной коррекции — от 71 до 80 и как правильное — от 81 до 90.
Характер питания тренировавшихся и нетренировавшихся больных после КШ нуждался в минимальной коррекции, поскольку приближался к более правильному и здоровому и статистически значимо не изменился в ходе исследования: исходно у тренировавшихся пациентов средний балл был 75±6 и у нетренировавшихся пациентов — 72±7 (р>0,05), а через 12 мес – 78±5 и 76±6 баллов соответственно (р>0,05). Различий по характеру питания при сравнении двух групп на разных визитах не отмечалось. Это можно объяснить тем, что все пациенты, перенесшие КШ, прошли обучение в образовательной Школе, где им разъяснялись правила здорового питания.
Таким образом, участие пациентов после КШ в образовательных Школах играет позитивную роль в формировании правильного представления пациента о здоровом питании и ФА в отношении профилактики осложнений атеросклероза и тромбоза.
Динамика показателей, характеризующих психологический статус и КЖ. Для выявления и оценки тревожно-депрессивной симптоматики у больных, перенесших КШ, до и после реабилитационных мероприятий (ФТ + Школа или Школа) использовалась субъективная Шкала тревоги и депрессии (HADS). Тревожную и депрессивную симптоматику диагностировали при суммарной оценке по Шкале тревоги или Шкале депрессии 11 баллов и выше. Субклинической симптоматике соответствовала оценка 8—10 баллов.
Исходно, через 4 (после окончания курса ФТ), 6 и 12 мес от начала исследования статистически значимых изменений по уровню тревоги/депрессии, выраженному в баллах, у больных двух сравниваемых групп не отмечалось. Причем средняя суммарная оценка по уровню тревоги/депрессии находилась в пределах нормы (рис. 4). Число пациентов из основной группы, имевших оценку 8 баллов и более (субклиническую и клиническую симптоматику), было по шкале тревоги исходно 16,8% и по шкале депрессии — 11,2%, а в контрольной группе — 22,4 и 16,8% соответственно. В ходе исследования статистически значимой динамики в процентном распределении больных по уровню тревоги/депрессии не отмечалось.
КЖ больных оценивалось методом анкетного опроса, разработанного В.П. Зайцевым и Д.М. Ароновым [14]. Каждый полученный ответ соответствовал определенному количеству баллов. В начале исследования пациенты сравниваемых групп были сопоставимы по показателю КЖ: 6,9±4,5 балла в основной группе против 4,8±2,4 балла контрольной группы (р>0,05). Под влиянием ФТ у больных через 4 мес средняя оценка КЖ повысилась на 23,2% (р<0,05), через 6 мес — на 30,4% (р<0,05). Однако в период от 6 до 12 мес без регулярных ФТ в лечебном учреждении средняя оценка КЖ имела тенденцию к снижению, хотя по прежнему превышала исходную на 14,5% (р<0,05).
У больных контрольной группы, не вовлеченных в процесс ФТ, через 4 мес от начала исследования средняя оценка КЖ не менялась и оставалась таковой в течение 12 мес наблюдения за больными.
Итак, участие пациентов после КШ в программах кардиологической реабилитации (ФТ и образовательная Школа) играет положительную роль в поддержании у них психологического «комфорта» и улучшении КЖ. При этом ФТ обеспечивают заметное дополнительное благоприятное влияние на КЖ и психологический статус пациента, перенесшего КШ.
Краткосрочные и отдаленные клинические исходы. Среди больных, перенесших КШ, 4-месячный курс ФТ закончили 18 (100%), тогда как из контрольной группы преждевременно выбыл 1 пациент по немедицинским причинам.
Исходно и в течение года наблюдения пациенты, посещающие образовательную Школу и вовлеченные в программу ФТ, не предъявляли жалоб на приступы стенокардии. В противоположность этому в группе пациентов, участвующих только в работе образовательной Школы, на приступы стенокардии напряжения исходно и через 4 мес жаловались 3 человека. Через 6 мес приступы стенокардии у этих пациентов сохранялись и появились еще у 1 пациента (всего 4 пациента), а к 12-му месяцу наблюдения стенокардия напряжения имелась у 5 пациентов. При этом среднее число приступов стенокардии в неделю (в пересчете на каждого пациента) у нетренировавшихся пациентов составляло исходно 0,17±0,4, через 4 мес 0,24±0,6 (увеличилось на 41% от исходного; р<0,05), 0,29±0,6 через 6 мес (прирост на 71% от исходного; р<0,05), 0,47±0,9 через 12 мес (повышение на 176% от исходного; р<0,05). Следует отметить, что имеющаяся у больных в контрольной группе стенокардия напряжения после КШ была в пределах II функционального класса по Канадской классификации.
Среди тренировавшихся после КШ больных ИБС по сравнению с нетренировавшимися через 12 мес наблюдения ухудшение клинического состояния отмечалось лишь у 1 (5,6%) против 5 (29,4%) больных.
За 12 мес наблюдения в обеих подгруппах смертельных исходов зарегистрировано не было. Повторные вмешательства на КА (коронарная ангиопластика/стентирование) перенесли 1 больной из основной группы и 1 из контрольной. В ходе исследования были госпитализированы 3 пациента основной группы, из них 1 по поводу обострения ИБС (выявлена безболевая ишемия миокарда) и 2 по некардиальным причинам (плановые операции). Из контрольной группы госпитализировался 1 больной по кардиальной причине (окклюзия шунта). В течение 12 мес наблюдения клинические проявления недостаточности кровообращения у больных двух сравниваемых групп не выявлялись. В целом все ССО (появление стенокардии, ИМ, повторная реваскуляризация, госпитализация по поводу обострения ИБС) после КШ выявлялись в 3 раза реже у пациентов, вовлеченных в комплексную программу реабилитации ФТ + образовательная Школа (у 2, или у 11,1%), чем у пациентов, посещающих только образовательную Школу (у 7, или у 39,2%).
Таким образом, сокращенный 4-месячный курс ФТ благоприятно повлиял на клинический статус больных ИБС, перенесших КШ. Это привело к тому, что все тренировавшиеся пациенты возвратились к своей трудовой деятельности в течение года от начала исследования, тогда как у пациентов контрольной группы, не прошедших курс ФТ, этот показатель составил 82,4%.
Заключение
Результаты проведенного рандомизированного клинического исследования показали, что ранняя комплексная программа реабилитации третьего этапа после коронарного шунтирования, проводимая в рамках поликлинического кардиореабилитационного отделения с включением образовательной Школы и физического аспекта (курса систематических физических тренировок, даже сокращенного до 4 мес), оказывает благоприятное влияние на показатели физической работоспособности, эхокардиографии и факторы, вовлеченные в атеротромбогенез, поддерживает психологический статус пациента, улучшает его качество жизни и клиническое течение ишемической болезни сердца. Доказано, что физические тренировки умеренной интенсивности безопасны и доступны для пациентов в ранние сроки после коронарного шунтирования. При обучении пациент может самостоятельно тренироваться дома по специально разработанной программе.



