В 1977 г. A. Gruntzig впервые провел чрескожную транслюминальную коронарную ангиопластику, что стало одним из самых больших достижений в кардиологии за последние 40 лет [1]. Развитие медицинских технологий в последующие годы позволило значительно улучшить инструментарий для чрескожных коронарных вмешательств (ЧКВ), что дало возможность выполнения сложных процедур, типа реканализации хронических тотальных окклюзий, использовать в повседневной практике проводниковые катетеры небольшого диаметра [2]. Это привело к тому, что для коронарных вмешательств стало возможным использовать доступ через лучевую артерию [3]. Впервые лучевой доступ дляпроведения коронарографии (КГ) был описан в 1989 г. доктором L. Campeau [4], и уже в 1993 г. доктором F. Kiemeneij этот доступ был предложен для проведения ЧКВ [5].
Кровотечения из места пункции, а также сосудистые осложнения — наиболее частая причина неблагоприятных исходов, связанных с ЧКВ [5—9]. По сравнению с бедренным доступом использование лучевого доступа для коронарных вмешательств позволяет снизить частоту развития периферических осложнений и кровотечений [10—13], продолжительность пребывания больных в стационаре [14—17]. Стоит отметить, что снижение частоты кровотечений при использовании лучевого доступа для ЧКВ приводит к снижению смертности в отдаленном периоде [14, 18]. Применение лучевого доступа также позволяет снизить стоимость ЧКВ [19]. Однако, несмотря на очевидные преимущества лучевого доступа, его применение значительно различается в разных странах и регионах [20, 21]. Несколько лет назад был проведен крупный анализ National Cardiovascular Data Registry в США, в который было включено более 600 клиник, выполняющих ЧКВ в США [22]. Данный анализ продемонстрировал, что только в 1,5% случаев ЧКВ выполнялись лучевым доступом.
В первую очередь такому отношению к лучевому доступу способствует переоценка сложностей с его проведением, а также относительно большой процент неудач и переходов на бедренный доступ. Стоит иметь в виду, что данные о безуспешных попытках лучевого доступа были получены, как правило, в определенных группах пациентов в центрах с небольшим или средним объемом вмешательств с использованием лучевого доступа [23].
В большинстве исследований, результаты которых свидетельствуют в пользу проведения ЧКВ лучевым доступом, вмешательства проводились хирургами с большим объемом работы. В ряде небольших исследований подтверждено преимущество лучевого доступа над бедренным при плановых, спасательных и первичных ЧКВ [24—26]. Тем интереснее познакомиться с исследованием, в котором ЧКВ выполнялись хирургами с небольшим или средним объемом работы. Это исследование проводилось доктором P. Dehghani и соавт. [23]. Всего в исследовании приняли участие 14 специалистов, которые в год выполняли от 8 до 42% ЧКВ лучевым доступом у 2100 пациентов. Выбор доступа осуществлялся по усмотрению хирурга в каждом конкретном случае. Пациенты с отрицательным тестом Аллена или кардиогенным шоком в исследование не включались. У пациентов с коронарным шунтированием (КШ) в анамнезе ЧКВ лучевым доступом выполнялись только в тех случаях, если поражение располагалось в нативном артериальном русле или венозном шунте, что было выявлено на предыдущей КГ.
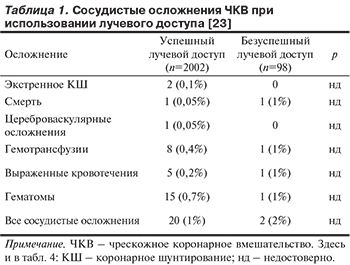 Превалирующей причиной безуспешного проведения ЧКВ лучевым доступом были невозможность провести проводниковый катетер в восходящий отдел аорты у 50 (51%) пациентов, плохая поддержка проводникового катетера у 35 (36%) пациентов и неудачная пункция лучевой артерии в 13 (13%) случаях. Проводниковый катетер невозможно было провести в восходящий отдел аорты из-за спазма лучевой артерии, что ограничивало манипуляцию им или причиняло боль пациенту. Остальными причинами, ограничивающими успех вмешательства, были диссекции, вызванные проводником или катетером, в 10 (10%) случаях, извитость лучевой артерии, которую не удалось выпрямить гидрофильным проводником 180 см, у 6% пациентов, и стеноз лучевой артерии в одном случае. Еще в 35 случаях не удалось адекватно катетеризировать коронарную артерию или добиться хорошей поддержки проводниковым катетером, что послужило причиной для перехода на бедренный доступ. Выраженная извитость подключичной артерии стала причиной безуспешной попытки у 18 пациентов, в то время как еще у 17 неудача лучевого доступа была вызвана кальцификацией, извитостью и другими причинами, препятствующими проведению стента или баллонного катетера к месту поражения. Максимальное число использованных проводниковых катетеров при лучевом доступе составило 6 для правой коронарной артерии и 7 для левой. Таким образом, у 98 (4,6%) пациентов ЧКВ не удалось провести лучевым доступом, и был выполнен переход на бедренный доступ. Достоверных клинических различий между двумя группами в исследовании выявлено не было (табл. 1).
Превалирующей причиной безуспешного проведения ЧКВ лучевым доступом были невозможность провести проводниковый катетер в восходящий отдел аорты у 50 (51%) пациентов, плохая поддержка проводникового катетера у 35 (36%) пациентов и неудачная пункция лучевой артерии в 13 (13%) случаях. Проводниковый катетер невозможно было провести в восходящий отдел аорты из-за спазма лучевой артерии, что ограничивало манипуляцию им или причиняло боль пациенту. Остальными причинами, ограничивающими успех вмешательства, были диссекции, вызванные проводником или катетером, в 10 (10%) случаях, извитость лучевой артерии, которую не удалось выпрямить гидрофильным проводником 180 см, у 6% пациентов, и стеноз лучевой артерии в одном случае. Еще в 35 случаях не удалось адекватно катетеризировать коронарную артерию или добиться хорошей поддержки проводниковым катетером, что послужило причиной для перехода на бедренный доступ. Выраженная извитость подключичной артерии стала причиной безуспешной попытки у 18 пациентов, в то время как еще у 17 неудача лучевого доступа была вызвана кальцификацией, извитостью и другими причинами, препятствующими проведению стента или баллонного катетера к месту поражения. Максимальное число использованных проводниковых катетеров при лучевом доступе составило 6 для правой коронарной артерии и 7 для левой. Таким образом, у 98 (4,6%) пациентов ЧКВ не удалось провести лучевым доступом, и был выполнен переход на бедренный доступ. Достоверных клинических различий между двумя группами в исследовании выявлено не было (табл. 1).
При однофакторном анализе предикторами безуспешных ЧКВ лучевым доступом были возраст 75 лет (относительный риск — ОР 4,41 при 95% доверительном интервале — ДИ от 2,73 до 7,12; р=0,0001), женский пол (ОР 1,84 при 95% ДИ от 1,15 до 2,92; р=0,001), КШ в анамнезе (ОР 4,65 при 95% ДИ от 2,34 до 9,21; р=0,0001) и рост пациента (ОР 0,96 при 95% ДИ от 0,94 до 0,98; р=0,001). ЧКВ в анамнезе, острый коронарный синдром или индекс массы тела (ИМТ) 25 кг/м2 не являлись предикторами безуспешного лучевого доступа. При многофакторном анализе возраст 75 лет (ОР 3,86 при 95% ДИ от 2,33 до 6,40; р=0,0006), КШ в анамнезе (ОР 7,47 при 95% ДИ от 3,45 до 16,19; р=0,0002) и рост (ОР 0,97 при 95% ДИ от 0,95 до 0,99; р=0,02) были независимыми предикторами безуспешного ЧКВ лучевым доступом. Возраст 75 лет (р=0,04), мужской пол (р=0,007) и многососудистое ЧКВ (р=0,0001) были независимым предиктором длительного времени флюороскопии, в то время как мужской пол (р=0,0001) и многососудистое ЧКВ (р=0,0001) были независимым предиктором большого расхода контрастного вещества.
 На основании полученных данных авторы исследования сделали заключение, что лучевой доступ может успешно применяться для выполнения ЧКВ хирургами с небольшим и средним объемом работы. При этом для лучевого доступа можно использовать стандартные инструменты, используемые для бедренного доступа, включая проводниковые катетеры, с низкой частотой неудач. Возраст старше 75 лет, низкий рост и КШ в анамнезе являются независимыми предикторами безуспешных ЧКВ лучевым доступом. Правильный отбор пациентов и тщательная оценка рисков необходимы для извлечения максимальной пользы от лучевого доступа при выполнении ЧКВ.
На основании полученных данных авторы исследования сделали заключение, что лучевой доступ может успешно применяться для выполнения ЧКВ хирургами с небольшим и средним объемом работы. При этом для лучевого доступа можно использовать стандартные инструменты, используемые для бедренного доступа, включая проводниковые катетеры, с низкой частотой неудач. Возраст старше 75 лет, низкий рост и КШ в анамнезе являются независимыми предикторами безуспешных ЧКВ лучевым доступом. Правильный отбор пациентов и тщательная оценка рисков необходимы для извлечения максимальной пользы от лучевого доступа при выполнении ЧКВ.
В последние десятилетия проблема ожирения стала социально значимой для всех стран, включая Российскую Федерацию, а число больных с ожирением резко увеличивается из года в год [27]. Так, в Российской Федерации избыточная масса тела или ожирение встречаются в 24,9% случаев [28]. Известно, что степень ожирения напрямую связана с риском развития сердечно-сосудистых заболеваний, а также общей заболеваемостью и смертностью [29]. Проведение КГ и ЧКВ у пациентов с ожирением, особенно с ожирением III степени (ИМТ >40 кг/м2), сопровождается высоким риском развития осложнений.
Целью следующего исследования была оценка безопасности и эффективности лучевого доступа по сравнению с бедренным доступом у пациентов с ожирением III степени, подвергающихся КГ и ЧКВ [30]. С 2007 по 2010 г. в исследование B. Hibbert и соавт. были включены 564 пациента с ожирением III степени, которым выполнялись КГ и ЧКВ лучевым или бедренным доступом. В группу лучевого доступа были включены 203 пациента, а в группу бедренного доступа — 361. Большинство демографических характеристик достоверно не различались между группами. В группе лучевого доступа достоверно были выше масса тела (132,8±24,0 кг против 121,4±18,6 кг; р<0,001) и ИМТ (47,3±5,9 кг/м2против 44,0±4,5 кг/м2; р<0,001). В группе лучевого доступа чаще применялся гепарин (77,3% против 21,3%; р<0,001) по причине почти рутинного использования при лучевом доступе и большем проценте ЧКВ (32,5% против 23,5%; р<0,05; табл. 2).
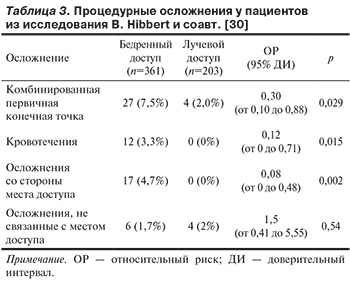
Комбинированная первичная точка (кровотечения, осложнения в области места доступа или осложнения, не связанного с доступом) зарегистрирована в 2% случаев при лучевом доступе и 7,5% случаев при бедренном (ОР 0,30 при 95% ДИ от 0,10 до 0,88; р=0,029). Эта конечная точка в основном была сформирована за счет кровотечений (0 при лучевом доступе против 3,3% при бедренном; ОР 0,12 при 95% ДИ от 0 до 0,71; р=0,015) и осложнений со стороны места доступа (0 при лучевом доступе против 4,7% при бедренном; ОР 0,08 при 95% ДИ от 0 до 0,48; р=0,002). Осложнения, не связанные с доступом, статистически значимо не различались между группами (табл. 3).
 Неудачи вмешательств, которые были конечной точкой (переход на бедренный доступ, невозможность завершить ангиографию с последующим проведением повторной ангиографии в другое время, невозможность завершить реваскуляризацию целевого сосуда), не различались между двумя доступами (7,3% при лучевом против 5,8% при бедренном доступе; р>0,05). Тем не менее при лучевом доступе продолжительность вмешательства достоверно увеличивалась (44,3±25,3 мин против 30,5±23,0 мин; р<0,001), как и время флюороскопии (12,5±8,2 мин против 6,7±6,3 мин; р<0,001).
Неудачи вмешательств, которые были конечной точкой (переход на бедренный доступ, невозможность завершить ангиографию с последующим проведением повторной ангиографии в другое время, невозможность завершить реваскуляризацию целевого сосуда), не различались между двумя доступами (7,3% при лучевом против 5,8% при бедренном доступе; р>0,05). Тем не менее при лучевом доступе продолжительность вмешательства достоверно увеличивалась (44,3±25,3 мин против 30,5±23,0 мин; р<0,001), как и время флюороскопии (12,5±8,2 мин против 6,7±6,3 мин; р<0,001).
В данном исследовании оценивалось влияние артериального доступа на кровотечения, сосудистые и процедурные осложнения после КГ и ЧКВ в группе пациентов с ожирением III степени. В этой группе высокого риска наблюдалась значительно более низкая частота кровотечений и осложнений со стороны артериального доступа при использовании лучевого доступа. В целом удалось добиться снижения частоты развития сосудистых осложнений с 7,5% в группе бедренного доступа до 2% в группе лучевого доступа, что позволяет избежать одного тяжелого осложнения при использовании лучевого доступа у 18 пациентов с ожирением III степени. В то же время при использовании лучевого доступа отмечалось значительное увеличение продолжительности процедуры и лучевой нагрузки на пациента. Эти данные не удивительны, так как известно, что лучевой доступ и масса тела пациента вносят вклад в увеличение лучевой нагрузки [31, 32]. Однако в недавно проведенных исследованиях было показано, что эффективное использование защитных экранов и большой опыт хирурга могут значительно снижать лучевую нагрузку на него и пациента [33—35].
Таким образом, авторы данного исследования пришли к выводу, что использование бедренного доступа для КГ и ЧКВ у пациентов с ожирением III степени ассоциируется с большей частотой кровотечений и осложнений со стороны артериального доступа по сравнению с лучевым доступом. У пациентов с ожирением III степени значительное снижение частоты развития процедурных осложнений может быть достигнуто при использовании лучевого доступа.
В ряде исследований была продемонстрирована клиническая польза от интервенционной стратегии при ишемической болезни сердца у пожилых пациентов [36—38]. При этом пожилой возраст является одним из основных факторов риска развития осложнений, связанных с коронарными вмешательствами. Известно, что осложнения, связанные с артериальным доступом, значительно чаще встречаются у пациентов старше 75 лет. В связи с этим клиническое применение интервенционной стратегии для диагностики и лечения при одновременном снижении частоты развития осложнений со стороны артериального доступа имеет очень большое значение, особенно для растущего числа пожилых пациентов. Использование лучевого доступа позволяет в большинстве случаев проводить успешные вмешательства, при этом частота развития сосудистых осложнений находится на достаточно низком уровне. Однако использование лучевого доступа у пожилых пациентов может быть технически более сложным по сравнению с бедренным доступом, что связано с атеросклеротическими изменениями лучевой артерии, извитостью подключичной артерии или расширением восходящей аорты.
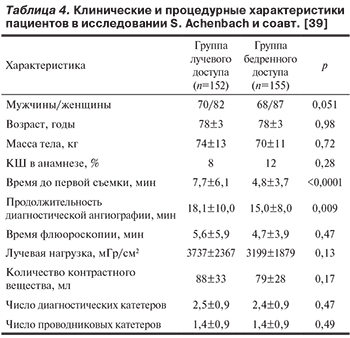
В исследование S. Achenbach и соавт. были включены пациенты старше 75 лет, которым выполнялась ангиография или ЧКВ лучевым и бедренным доступом [39]. В группу лучевого доступа были включены 152 пациента, из которых 36 были выполнены ЧКВ, и в группу бедренного доступа вошли 155 пациентов с последующим ЧКВ у 43 из них (табл. 4).
 В группе лучевого доступа из 152 пациентов вмешательства были завершены через лучевую артерию у 139 (91,5%). Еще у 8 пациентов проводник удалось провести в артерию, но проводник или катетер в артерию не были проведены из-за спазма или извитости артерии; у оставшихся 5 пациентов в лучевую артерию не удалось провести даже проводник. Этим пациентам процедура проводилась через бедренный доступ, при этом контралатеральная лучевая артерия не использовалась. У 1 пациента из группы бедренного доступа провести диагностический катетер не представлялось возможным из-за извитости подвздошной артерии, процедура ЧКВ была выполнена с использованием лучевого доступа.
В группе лучевого доступа из 152 пациентов вмешательства были завершены через лучевую артерию у 139 (91,5%). Еще у 8 пациентов проводник удалось провести в артерию, но проводник или катетер в артерию не были проведены из-за спазма или извитости артерии; у оставшихся 5 пациентов в лучевую артерию не удалось провести даже проводник. Этим пациентам процедура проводилась через бедренный доступ, при этом контралатеральная лучевая артерия не использовалась. У 1 пациента из группы бедренного доступа провести диагностический катетер не представлялось возможным из-за извитости подвздошной артерии, процедура ЧКВ была выполнена с использованием лучевого доступа.
Средняя продолжительность диагностической процедуры составила 18,1±10 мин в группе лучевого доступа против 15,0±8 мин в группе бедренного доступа (р=0,009). Эта разница во времени была обусловлена более длительным периодом от первой попытки пункции до первой съемки, который составил 7,7±6 мин в группе лучевого доступа против 4,8±4 мин в группе бедренного доступа (р<0,001). Время флюороскопии, лучевая нагрузка, объем введенного контрастного вещества и количество использованных диагностических и проводниковых катетеров достоверно между двумя группами не различались.
В исследовании было зарегистрировано 5 выраженных сердечно-сосудистых осложнений: инсульт, 3 случая сильного кровотечения с последующей гемотрансфузией, гематома, потребовавшая хирургического лечения. Все выраженные осложнения развились в группе бедренного доступа. Таким образом, частота развития выраженных сердечно-сосудистых осложнений составила 0 в группе лучевого доступа против 3,2% в группе бедренного доступа (р<0,001).
В исследовании также были зарегистрированы 11 невыраженных сердечно-сосудистых осложнений. В 2 случаях пациенты были рандомизированы в группу лучевого доступа, но в обоих случаях был выполнен переход на бедренный доступ, после которого и развились осложнения: псевдоаневризма бедренной артерии, которая разрешилась с помощью компрессии под ультразвуковым контролем, и кровотечение, что потребовало мануальной компрессии в течение 30 мин. У 9 пациентов, рандомизированных в группу бедренного доступа, также развились невыраженные осложнения: 2 небольших кровотечения, прекращенных с помощью мануальной компрессии, и 7 случаев псевдоаневризм, которые подверглись компрессии под ультразвуковым контролем. Итак, частота развития невыраженных осложнений составила 1,3 и 5,8% в группах лучевого и бедренного доступов соответственно (p<0,001). Стоит отметить, что по данным ультразвукового исследования, в группе лучевого доступа не было зарегистрировано ни одного постпроцедурного случая окклюзии лучевой артерии.
Всего в данном исследовании было проведено 79 ad-hoc ЧКВ: 36 ЧКВ в группе лучевого доступа и 43 ЧКВ в группе бедренного доступа. У 2 пациентов, которые подверглись ЧКВ в группе бедренного доступа, развились выраженные сосудистые осложнения. В 5 случаях из 9 развились малые осложнения после ЧКВ бедренным доступом. У 36 пациентов из группы лучевого доступа после ЧКВ осложнения не были зарегистрированы ни в одном случае. Таким образом, частота осложнений после ad-hoc ЧКВ составила 0 в группе лучевого доступа против 16% в группе бедренного доступа (р=0,03).
В данном исследовании было показано, что использование лучевого доступа в повседневной клинической практике для проведения КГ и ЧКВ у пожилых пациентов сопровождается высокой частотой успеха и значительно не увеличивает продолжительность вмешательства, лучевой нагрузки, количества использования контрастного вещества или числа катетеров. Кроме того, при лучевом доступе отмечается меньшее количество осложнений по сравнению с бедренным доступом, что позволяет рекомендовать лучевой доступ для более широкого использования у пожилых пациентов с высоким риском развития сосудистых осложнений.
Подводя итог рассмотренным выше исследованиям, можно сделать вывод, что в целом лучевой доступ позволяет выполнять вмешательства безопасно и с высокой степенью эффективности. Стоит также отметить, что при использовании этого доступа отмечаются случаи перехода на бедренный доступ. В то же время, по данным рандомизированных исследований, проведение ЧКВ лучевым доступом позволяет значительно снизить частоту постпроцедурных кровотечений и в целом улучшает исход вмешательств по сравнению с бедренным доступом [40, 41]. Использование лучевого доступа несколько увеличивает продолжительность процедур, время флюороскопии и лучевой нагрузки по сравнению с бедренным доступом [21, 42]. Однако эффективное использование радиационной защиты и большой опыт хирурга могут значительно снизить лучевую нагрузку [34, 35].
Все больше пожилых пациентов подвергаются ЧКВ и их доля постоянно увеличивается, несмотря на то что риск развития перипроцедурных осложнений в этой категории значительно выше, чем у более молодых пациентов [43]. Наиболее часто развиваются сосудистые осложнения со стороны артерии-доступа, что приводит к более длительному пребыванию больных в стационаре [44]. Проведение коронарных вмешательств лучевым доступом у пожилых пациентов возможно и безопасно, как и у более молодых пациентов, что продемонстрировано в ряде исследований. Например, в исследование R. Jaffe и соавт. были включены пожилые пациенты старше 80 лет, и результаты этого исследования показали, что использование лучевого доступа позволяет раньше выписывать больных после вмешательств и значительно снизить риск развития сосудистых осложнений [45].
Еще одной сложной категорией пациентов для проведения КГ и ЧКВ являются пациенты с выраженным ожирением. Известно, что у пациентов с ИМТ >40 кг/м2 коронарные вмешательства ассоциированы с высоким риском развития осложнений. В исследовании B. Hibbert и соавт. было установлено, что частота развития осложнений и кровотечений после КГ и ЧКВ у пациентов с ИМТ >40 кг/м2 значительно выше в группе бедренного доступа по сравнению с лучевым [30]. Таким образом, лучевой доступ у больных этой категории позволяет значительно снизить частоту развития периферических осложнений. Однако не только пациенты с ИМТ >40 кг/м2 получают значительные преимущества от лучевого доступа. Как было установлено в исследовании J.R. McDonagh и соавт., лучевой доступ по сравнению с бедренным ассоциируется с более низкой частой постпроцедурных кровотечений и переливаний крови во всех весовых категориях пациентов [46]. В то же время только в группах пациентов с ИМТ <25 и >40 кг/м2 наблюдается наибольшее абсолютное снижение риска кровотечения и переливания крови.
К ограничениям лучевого доступа можно отнести невозможность использования внутриаортальной баллонной контрпульсации, для которой требуется проводник диаметром 8Fr, или наружную кардиостимуляцию. С этой позиции оба доступа выступают в роли дополняющих друг друга и обеспечивают интервенционного кардиолога большим спектром возможностей.



