Реперфузионное лечение больных острым инфрактом миокарда с подъемом сегмента ST (ИМпST) — основное вмешательство, увеличивающее продолжительность жизни. Действие на выживаемость своевременно проведенной реперфузии сохраняется, по крайней мере, в течение 10 лет [1]. Проведение чрескожных коронарных вмешательств (ЧКВ) является приоритетной стратегией реперфузии при ИМпST и характеризуется снижением смертности от сердечно-сосудистых заболеваний [2, 3].
Применение тромболитической терапии (ТЛТ) допускается в условиях, когда ЧКВ не может быть выполнено в пределах 120 мин от первого контакта с медперсоналом, а в первые 3 ч заболевания этот срок сокращается до 90 мин. Альтернативным подходом является применение так называемой фармакоинвазивной стратегии, когда при ожидаемой задержке в выполнении ЧКВ ему предваряется ТЛТ. В России широкое распространение получила фармакоинвазивная стратегия, когда ЧКВ выполняются после предшествующей ТЛТ [4, 5]. Все международные рекомендации, тем не менее, советуют создавать локальные протоколы ведения таких больных, учитывающие особенности конкретной местности, транспортной схемы, экономические возможности и, наконец, наличие опытного инвазивного центра.
Создание подобного протокола невозможно без проведения исследований клинической практики, которая часто оказывается весьма далекой от исследований в рамках рандомизированных исследований. Более того, в доказательной базе существуют некоторые противоречия относительно безопасности и эффективности такого подхода [6]. Поэтому целью настоящей работы явилась оценка особенностей и результатов ЧКВ у пациентов с ОИМпST после догоспитального тромболизиса в клинической практике Тюмени.
Материал и методы
Основную группу исследования составили 144 пациента (122 мужчины и 22 женщины), которым в период с 2008 по 2013 г. были выполнены ЧКВ после догоспитального тромболизиса полной дозой препарата тенектеплаза.
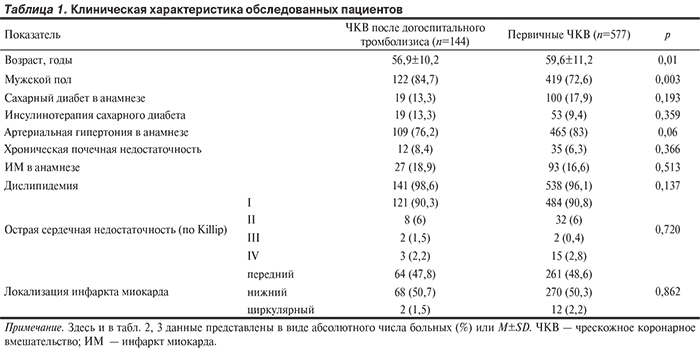
Группу сравнения составили 577 пациентов (419 мужчин и 158 женщин), у которых за аналогичный период времени были выполнены ЧКВ без предшествующей ТЛТ (первичные ЧКВ). Клиническая характеристика больных представлена в табл. 1.
Решение о выполнении ЧКВ после догоспитального тромболизиса принимали через 90 мин после введения препарата в зависимости от достижения критериев реперфузии (снижение сегмента ST более чем на 50%). В отсутствие критериев реперфузии выполняли немедленные спасительные ЧКВ. При наличии критериев реперфузии выполняли ранние ЧКВ через 3—24 ч после введения тромболитического препарата.
Все вмешательства до 2011 г. выполняли с использованием трансфеморального доступа, а начиная с 2011 г. – преимущественно трансрадиальным доступом (2011 г. — 77,3%, 2012 г. — 90%, 2013 г. — 99%). Все вмешательства были выполнены в Тюменском кардиологическом центре, который принимает больных из двух административных округов города Тюмени (население 679 861 человек).
У пациентов основной группы анализировали следующие временны'е показатели: время от начала болевого синдрома до введения тромболитического препарата (время «боль—игла»), время от введения тромболитического препарата до выполнения ЧКВ.
У пациентов контрольной группы рассчитывали следующие временны'е показатели: время от начала болевого синдрома до поступления в стационар, время от поступления в стационар до раздувания баллона в коронарной артерии (время «дверь—баллон»).
У всех пациентов оценивали степень коронарного кровотока в инфаркт-связанной артерии по шкале TIMI. Непосредственный ангиографический успех определяли как полное (TIMI 3) восстановление коронарного кровотока в инфаркт-связанной артерии. При оценке результатов вмешательств анализировали следующие показатели: летальность, частоту рецидивов инфаркта миокарда (ИМ), тромбозов стентов, развития феномена no-reflow, который определялся как отсутствие адекватной перфузии миокарда после восстановления коронарного кровотока [7]. Кроме того, оценивали частоту развития основных кардиальных осложнений (смерть, рецидив ИМ, тромбоз стента) на госпитальном этапе.
Статистическую обработку полученных данных проводили с использованием пакета статистических прикладных программ («SPSS Inc.», версия 17.0). Результаты представлены в виде М±SD при нормальном распределении; при асимметричном распределении значения представлены медианой (Ме) с интерквартильным размахом в виде 25-го и 75-го процентилей. Распределение количественных переменных определяли с помощью критерия Колмогорова—Смирнова. При сопоставлении количественных переменных при нормальном распределении использовали t-критерий Стьюдента, при распределении, отличном от нормального, применяли непараметрический критерий Манна—Уитни. Для сопоставления качественных переменных использовали χ2-критерий. Различия между группами считали статистически значимыми при р<0,05. Применяли многофакторный анализ — бинарный логистический регрессионный анализ.
Результаты
При сопоставлении группы догоспитального тромболизиса и группы первичного ЧКВ выявлено, что пациенты основной группы были моложе, среди них было больше мужчин. Группы были сопоставимы по распространенности сахарного диабета, артериальной гипертонии, хронических заболеваний почек, дислипидемии и ИМ в анамнезе. Не было различий между группами по тяжести состояния пациентов при поступлении в стационар и локализации ИМ. При анализе данных ангиографии (табл. 2) не было выявлено различий по локализации инфаркт-связанной артерии, характеру поражения коронарного русла. Стенты с антипролиферативным покрытием имплантировались одинаково часто в обеих группах. Частота полной окклюзии инфаркт-связанной артерии в основной группе пациентов была статистически значимо ниже, чем у пациентов, которым выполнялись первичные ЧКВ. При этом частота использования трансрадиального доступа в сравниваемых группах статистически значимо не различалась.
При анализе временны'х показателей в основной группе было выявлено, что медиана времени от начала болей до введения тромболитика составила 80 (55; 172) мин, при этом ЧКВ выполнялись через 270 (120; 540) мин после тромболизиса.
В контрольной группе медиана времени от начала заболевания до поступления в стационар равнялась 120 (60; 230) мин, а время «дверь—баллон» – 86 (67; 115) мин.
При оценке госпитальных результатов вмешательств (табл. 3) не было выявлено различий по частоте непосредственного ангиографического успеха процедуры, развитию феномена no-reflow, тромбоза стента, смерти и рецидива ИМ. Не определялось различий и по комбинированному показателю, включающему смерть, рецидив ИМ и тромбоз стента.

При этом частота геморрагических осложнений в месте пункции не различалась в сравниваемых группах.
С использованием бинарного логистического регрессионного анализа (см. рисунок) была выявлена независимая связь между развитием основных кардиальных осложнений на госпитальном этапе и пожилым возрастом, наличием предшествующего ИМ, полной окклюзией инфаркт-связанной артерии. При этом использование фармакоинвазивной стратегии не ассоциировалось со снижением риска развития основных кардиальных осложнений.
Обсуждение
Итак, ретроспективный анализ данных, полученных в клинической практике Тюмени, показывает, что применение фармакоинвазивной стратегии сопоставимо с результатами первичных ЧКВ. Эти результаты совпадают с данными нескольких рандомизированных исследований, в которых также не было показано преимуществ такого подхода [8—10]. В то же время обращают на себя внимание некоторые отличия в протоколе ведения больных, использованном в исследованиях других авторов, от принятого нами. Так, в исследовании GRACIA-2 [8], опубликованном в 2007 г., были сопоставлены две группы больных — леченных вначале тромболитиком, а затем подвергнутых ЧКВ, и тех, кому проводилось сразу первичное ЧКВ. Главным отличием исследования было то, что вмешательство после тромболизиса всем проводилось не ранее 3-го часа, что не вполне соответствует современной концепции «спасающего» ЧКВ, выполняемого у пациентов с электрокардиографическими признаками отсутствия реперфузии так быстро, как это возможно. Именно эти больные являются наиболее тяжелой группой с точки зрения прогноза ишемической болезни сердца, с одной стороны, и с точки зрения кровотечения, с другой. В исследовании ASSENT-4 летальность при фармакоинвазивной стратегии даже оказалась статистически значимо выше (6 и 3,8% соответственно; p=0,039) [9], несмотря на то что полная окклюзия инфаркт-связанной артерии у больных этой группы определялась значительно реже (36 и 78% соответственно). Основное отличие протокола этого исследования заключается в том, что гипотеза «усиленного» ЧКВ подразумевала быстрое проведение вмешательства без учета эффективности фармакологического этапа. Геморрагический риск в такой ситуации оказывается неприемлемым. Однако в части выявленной ангиографической эффективности тромболизиса эти данные совпали с нашими — у пациентов основной группы частота выявления полной окклюзии инфаркт-связанной артерии была ниже, чем у пациентов, которым выполнялись первичные ЧКВ (41,7 и 71,4% соответственно).
Более всего наш протокол соответствует изученному в исследовании STREAM [10], в котором также не наблюдалось увеличения эффективности за счет применения догоспитального тромболизиса у больных, у которых от начала заболевания прошло менее 3 ч и нет возможности в течение 60 мин от момента контакта с медперсоналом выполнить первичное ЧКВ.

Главное сомнение, которое оставалось после изучения результатов исследования STREAM, – достижимы ли те временны'е стандарты, благодаря которым даже в группе первичного ЧКВ от начала заболевания до реперфузии прошло в среднем 178 мин, при этом от момента принятия решения по поводу реперфузии (рандомизации) до восстановления кровотока прошло 77 мин. Время от начала болей до введения тромболитика при этом оказалось существенно меньшим (100 мин). Однако было бы неправильно утверждать, что при этом реперфузия наступает раньше на такое же количество минут. В отличие от ЧКВ реперфузия не происходит мгновенно, а для восстановления кровотока требуется 30—60 мин (в среднем 45 мин), выигрыш во времени в этом случае минимален [11]. Риск же развития геморрагических осложнений (как это получилось в исследовании STREAM) в группе фармакоинвазивного лечения увеличивается.
Согласно современным рекомендациям фармакоинвазивный подход может использоваться в случаях, когда первичные ЧКВ невозможно выполнить за 120 мин от первого медицинского контакта с больным [12]. Проведение ТЛТ на догоспитальном этапе, по некоторым данным, эффективно только в случае, если длительность болевого синдрома от начала заболевания не превышает 2 ч [13]. В нашем исследовании 61,7% пациентов догоспитальный тромболизис проводился в первые 2 ч от начала заболевания. При принятии решения о фармакоинвазивной стратегии важным является такой временно'й показатель, как объективная задержка реперфузии, являющаяся следствием особенностей ЧКВ. Другими словами, это время от возможного начала ТЛТ до проведения ЧКВ. По нашим данным, задержка выполнения ЧКВ составила 126 мин. При этом допустимая задержка выполнения ЧКВ, по данным различных исследований, составляет от 90 до 120 мин [14, 15]. D. Pinto и соавт. предложен дифференцированный подход к расчету допустимого времени задержки выполнения ЧКВ в зависимости от возраста, длительности симптомов заболевания, а также локализации ИМ.
Так, диапазон допустимого времени задержки выполнения ЧКВ составлял от 40 мин для больных с передней локализацией ИМ, возрастом моложе 65 лет и длительностью симптомов менее 2 ч, до 179 мин – для пациентов старше 65 лет, не передней локализацией ИМ и длительностью симптомов более 2 ч [16].
Максимально возможное сокращение временно'го интервала «дверь—баллон» является приоритетной задачей каждого центра, где выполняются ЧКВ [17]. С этой целью в Тюменском кардиологическом центре был разработан и внедрен алгоритм, согласно которому проводится детальный учет всех временны'х интервалов пребывания пациента в стационаре до выполнения первичного ЧКВ. За счет сокращения неоправданных временны'х потерь в настоящее время удается выполнить первичное ЧКВ менее чем за 60 мин с момента поступления пациента в стационар.
Таким образом, использование фармакоинвазивного подхода оправдано и имеет смысл только в тех районах, где нет опытной круглосуточной рентгенохирургической службы или из-за низкой плотности населения, характерной для значительного количества территории России, ее создание невозможно. В ряде случаев такой подход допустим в крупных мегаполисах, когда высокая загруженность дорог не позволяет своевременно доставить пациента в клинику, выполняющую ЧКВ.
При этом в большинстве городов, имеющих стационары с работающими рентгенохирургическими отделениями, в первую очередь следует отдавать предпочтение первичным ЧКВ, минимизируя время до их выполнения. При этом фармакоинвазивная стратегия, безусловно, является приоритетной в условиях, когда транспортировка больных для выполнения ЧКВ характеризуется значительными временны'ми затратами. Следует также иметь в виду, что при сопоставимой эффективности фармакоинвазивная стратегия требует учета факторов риска развития геморрагических осложнений и у некоторых групп больных может сопровождаться увеличением частоты развития внутричерепных геморрагических осложнений [10].
Следует также иметь в виду удорожание лечения за счет высокой стоимости современного тромболитика [18] и необходимости закупок сразу большого количества препарата, его одновременного наличия в укладках всех бригад скорой медицинской помощи.
В этой связи наиболее подходящая модель дифференцированного подхода к применению фармакоинвазивной стратегии разработана в Турции. После принятия европейской инициативы «Stent for Life» территория этой страны была разделена на 3 района, соответствующих тактике лечения пациентов с ИМпST. Первая территория образована вокруг 18 городов, где были развернуты центры с возможностью круглосуточного выполнения первичных ЧКВ. В этих центрах совместно со службами оказания экстренной медицинской помощи был разработан специальный договор сотрудничества для максимально быстрой доставки больных в ангиографическую операционную. На ряде территорий, где нет возможности выполнения первичных ЧКВ в максимально короткие сроки, была принята фармакоинвазивная стратегия. Были также выделены отдаленные, труднодоступные районы, где единственным возможным методом лечения пациентов оставалась ТЛТ. За 3 года существования проекта частота проведения первичных ЧКВ в первой территории превысила 90% [19].
Заключение
Таким образом, применение фармакоинвазивной стратегии в городе с возможностью круглосуточного выполнения первичных чрескожных коронарных вмешательств в сроки, приближенные к рекомендованным, не сопровождается увеличением выживаемости и снижением частоты развития основных кардиальных осложнений, несмотря на более низкую частоту выявления полной окклюзии инфаркт-связанной артерии и сокращения времени восстановления коронарного кровотока при успешном догоспитальном тромболизисе.



