Известно, что инфаркт миокарда (ИМ) относится к числу полигенных многофакторных заболеваний, развитие которых обусловлено как классическими факторами риска (ФР), так и генетическими факторами. К некорригируемым ФР относят пожилой возраст, мужской пол и наследственную предрасположенность, определяемую генетическими факторами. Среди корригируемых ФР, согласно данным международного исследования INTERHEART [1], основными являются курение, артериальная гипертензия, сахарный диабет, дислипидемия, избыточная масса тела, гиподинамия.
Общепризнано, что сочетание нескольких классических ФР увеличивает вероятность развития ИМ в значительно большей степени, чем наличие одного фактора [2]. В настоящее время для определения риска развития сердечно-сосудистых заболеваний (ССЗ) и индивидуального выбора стратегии профилактики и конкретных вмешательств используется несколько стандартизированных шкал риска. Наибольшее распространение получила шкала SCORE, оценивающая вероятность смерти индивидуума от ССЗ в течение 10 лет, рассчитанной на основании возраста, пола, курения, систолического артериального давления и уровня общего холестерина [3]. Однако прогнозирование развития ССЗ с многофакторной этиологией, включающей генетические факторы, затруднено из-за возможных множественных взаимодействий ФР, что может в итоге влиять на развитие заболевания [4]. Поэтому неудивительно, что несмотря на большое количество работ по изучению влияния различных ФР, проблема прогнозирования ИМ далека от решения.
Ранее мы показали, что варианты генов, кодирующих белки системы коагуляции и воспаления, являются генетическими ФР развития ИМ [5]. Анализ 17 генов-кандидатов, принадлежащих к этим системам, позволил выявить воспроизводящиеся в двух независимых выборках генетические маркеры ИМ, которыми оказались варианты генов трансформирующего фактора роста β-1 (TGFB1), β-цепи фибриногена (FGB) и C-реактивного белка (CRP), а также биаллельное сочетание вариантов генов интерферона-γ (IFNG) и циклооксигеназы-1 (PTGS1). Однако варианты отдельных генов обладают сравнительно низкой прогностической значимостью, и эффективность прогноза значительно повышается при суммировании вкладов отдельных генов.
 Целью настоящей работы является создание комплексной модели оценки индивидуального риска развития ИМ, которая учитывала бы сочетанное влияние факторов генетической предрасположенности, возраста и курения.
Целью настоящей работы является создание комплексной модели оценки индивидуального риска развития ИМ, которая учитывала бы сочетанное влияние факторов генетической предрасположенности, возраста и курения.
Материал и методы
Клиническая характеристика больных. В ретроспективное исследование случай—контроль включены две выборки этнических русских. Одна выборка состояла из 325 больных ИМ (средний возраст ± стандартное отклонение: 53,2±9,9 года), из них 236 мужчин (50,6±9,6 года) и 89 женщин (59,9±7,2 года), которые проходили лечение в отделе неотложной кардиологии Института клинической кардиологии им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ. Контрольная группа включала 185 индивидуумов без ССЗ в анамнезе (60,3±13,3 года), из них 100 мужчин (57,12±11,13 года) и 85 женщин (63,31±11,32 года). Другая выборка состояла только из мужчин (417 человек) — жителей Республики Башкортостан (Россия) – и включала 220 больных ИМ (50,1±6,8 года) и 197 индивидуумов контрольной группы без ССЗ в анамнезе (45,3±7,9 года). Диагностические критерии ИМ [6]: повышение и/или снижение уровня биохимических маркеров некроза миокарда — предпочтительно кардиоспецифичного тропонина при условии, что хотя бы одно измерение превысит 99-й перцентиль верхнего уровня нормы в сочетании по меньшей мере с одним из следующих критериев:
- симптомы ишемии миокарда;
- новые или предположительно новые значительные изменения комплекса ST—T или впервые зарегистрированная полная блокада левой ножки пучка Гиса;
- появление патологических зубцов Q на электрокардиограмме;
- появление нежизнеспособного миокарда или новых зон нарушения локальной сократимости;
- выявление интракоронарного тромбоза при ангиографическом исследовании.
Основные клинические характеристики больных представлены в табл. 1. Критериями исключения для больных и индивидуумов контрольной группы являлись аутоиммунные, инфекционные (ВИЧ, гепатиты) и онкологические заболевания. От всех участников исследования получено информированное согласие на проведение исследования.
 Выделение геномной ДНК из периферической крови проводили методом фенолхлороформной экстракции [7] с модификациями.
Выделение геномной ДНК из периферической крови проводили методом фенолхлороформной экстракции [7] с модификациями.
Геномное типирование проводили методами, основанными на полимеразной цепной реакции (ПЦР). Для полиморфных участков 1444C>T гена CRP (rs1130864) [8], 874A>T гена IFNG (rs2430561) [9] и 869T>C гена TGFB1 (rs1982073) [10] применяли ПЦР с использованием аллель-специфических праймеров. Для полиморфных участков −249C>T гена FGB (rs1800788), 50C>T гена PTGS1 (rs3842787) — ПЦР в реальном времени с использованием технологии TaqMan.
Статистический анализ. Статистическую обработку данных осуществляли при помощи программного обеспечения IBM SPSS 23 для MacOS. Для построения предиктивных моделей использовали метод логистической регрессии с пошаговым включением переменных. При расчетах в уравнение регрессии включали переменные, коэффициенты для которых достигали уровня значимости pw <0,05 по критерию Вальда, при нулевой гипотезе, что коэффициент не значим для модели. Для исключения эффекта переобучения устойчивость полученных моделей проверяли на независимой тестовой выборке.
В качестве маркера (комплексного) принимали модуль значения области задания логистической функции, который рассчитывали по формуле:
b1×a1+b2×a2+, + bn×an,
где: М — маркер (комплексный); bn — коэффициент уравнения регрессии при n-й переменной; an — переменная уравнения регрессии.
 В настоящем исследовании переменными уравнения регрессии являются ФР. При этом для количественных переменных (например, возраст) коэффициент умножается на каждую единицу измерения (например, на число лет), а для порядковых переменных (генетические ФР и курение) он умножается на 1, если у индивидуума имеются ФР, и на 0, если ФР отсутствуют.
В настоящем исследовании переменными уравнения регрессии являются ФР. При этом для количественных переменных (например, возраст) коэффициент умножается на каждую единицу измерения (например, на число лет), а для порядковых переменных (генетические ФР и курение) он умножается на 1, если у индивидуума имеются ФР, и на 0, если ФР отсутствуют.
Прогностическую значимость ФР оценивали по площади под кривой (AUC) в ROC-анализе. Фактор считали маркером при уровне pAUC <0,05, рассчитанной по методу ДеЛонга, при нулевой гипотезе, что AUC=0,5. Эффективным считали маркер с показателем AUC>0,60.
Результаты
Для построения методом логистической регрессии комплексной генетической модели риска развития ИМ в рассмотрение были приняты описанные нами ранее [5] генетические маркеры: три отдельных генетических варианта FGB rs1800788*T, TGFB1 rs1982073*TT, CRP rs1130864*TT, и биаллельное сочетание IFNG rs2430561*A + PTGS1 rs3842787*T. Это сочетание служит четвертым независимым маркером, который формируется в результате эпистатических взаимодействий между входящими в него аллелями [5]. В качестве обучающей выборки была использована группа больных ИМ русских мужчин из Республики Башкортостан и соответствующая ей по полу, возрасту, месту проживания и этнической принадлежности группа сравнения. В табл. 2 приведены коэффициенты уравнения регрессии для его переменных — четырех маркеров, включенных в комплексную модель. Эти коэффициенты статистически значимы (p<0,05) и характеризуют величину изменения риска развития ИМ при носительстве каждого из ФР. По влиянию на развитие ИМ генетические ФР можно расположить в соответствии с убыванием коэффициента регрессии (в ряду от 1,37 до 0,536) в следующем порядке: CRP → IFNG+PTGS1 → TGFB1 → FGB.
Прогностическая значимость полученного комплексного генетического маркера и входящих в его состав генетических ФР, взятых отдельно, оценена с помощью ROC-анализа (табл. 3). Отдельные генетические ФР в обучающей выборке поодиночке являются слабыми маркерами риска развития ИМ (AUC<0,6), при pAUC ≤0,05, тогда как при их использовании в комплексной модели достигается высокая прогностическая эффективность (AUC=0,66; pAUC=1,4·10–8). В табл. 3 включены также значения AUC и pAUC для тестовой выборки из Московского региона. Видно, что отдельные генетические ФР, как и в обучающей выборке, имеют AUC<0,6, а для CRP rs1130864*TT и сочетания (IFNG rs2430561*A + PTGS1 rs3842787*T) pAUC >0,05. В то же время комплексная модель сохраняет свою прогностическую значимость на тестовой выборке (AUC=0,66; pAUC=3,4×10–9). Таким образом, комплексный генетический маркер устойчив и обладает безусловным преимуществом перед отдельными генетическими маркерами для релевантной оценки влияния генетических факторов на вероятность развития ИМ.
 Для создания комплексной модели оценки индивидуального риска развития ИМ к комплексному генетическому маркеру при помощи метода логистической регрессии были добавлены показатели возраста и курения; коэффициенты уравнения регрессии для обучающей выборки приведены в табл. 4. Видно, что все ФР имеют коэффициенты уравнения регрессии, обладающие высоким уровнем значимости (p<1·10–6); при этом комплексный генетический маркер характеризуется более высоким коэффициентом регрессии. Однако прямое сравнение коэффициентов регрессии для порядковых переменных (генетические ФР и курение) и количественных переменных (возраст) затруднено и будет предметом отдельного исследования.
Для создания комплексной модели оценки индивидуального риска развития ИМ к комплексному генетическому маркеру при помощи метода логистической регрессии были добавлены показатели возраста и курения; коэффициенты уравнения регрессии для обучающей выборки приведены в табл. 4. Видно, что все ФР имеют коэффициенты уравнения регрессии, обладающие высоким уровнем значимости (p<1·10–6); при этом комплексный генетический маркер характеризуется более высоким коэффициентом регрессии. Однако прямое сравнение коэффициентов регрессии для порядковых переменных (генетические ФР и курение) и количественных переменных (возраст) затруднено и будет предметом отдельного исследования.
Для каждого индивидуума из обучающей выборки на основании полученных коэффициентов уравнения регрессии (см. табл. 4) был рассчитан комплексный маркер, как это описано в «Материалах и методах», с дальнейшей оценкой его прогностической эффективности при помощи ROC-анализа (рис. 1, А). Из анализа коэффициентов уравнения регрессии и ROC-кривых видно, что полученный комплексный маркер по эффективности прогноза (AUC=0,77) превосходит любой из факторов, включенных в модель и взятых отдельно. Проведенный анализ характера ROC-кривых (данные не представлены) показал, что при чувствительности 71% комплексный маркер характеризуется специфичностью 70%.
Для проверки устойчивости прогностической значимости комплексного маркера при его использовании на выборках, отличных от обучающей, был проведен ROC-анализ комплексного маркера на независимой тестовой выборке индивидов из Московского региона (рис. 1, Б). Принципиально важным отличием этой выборки является присутствие в ней и мужчин, и женщин. По данным рис. 1, Б, величина AUC, полученная на тестовой выборке, составляет 0,82, что свидетельствует об устойчивости полученной модели. Таким образом, полученная комплексная модель оценки риска развития ИМ воспроизводится на двух независимых выборках индивидуумов русской этнической принадлежности, проживающих в различных регионах страны и различающихся по половому составу, и позволяет с вероятностью около 80% обнаруживать различия между больным и здоровым индивидуумами.
Обсуждение
В настоящей работе предпринята попытка создать с использованием метода логистической регрессии комплексную модель оценки индивидуального риска развития ИМ, в которой учтен вклад выявленных нами ранее генетических предикторов ИМ, а также вклад возраста и курения. Для этого на первом этапе был сформирован комплексный генетический маркер, включающий четыре генетических ФР: аллель FGB rs1800788*T, генотипы TGFB1 rs1982073*TT и CRP rs1130864*TT и биаллельное сочетание IFNG rs2430561*A + PTGS1 rs3842787*T, ассоциация которых с ИМ описана нами ранее [5], а затем для получения комплексного маркера к этому комплексному генетическому маркеру были добавлены показатели возраста и курения.
Поскольку в эту модель включено ограниченное число как генетических, так и традиционных ФР, мы рассматривали ее как прототипную. Тем не менее комплексный маркер, полученный и на обучающей, и на тестовой выборке, обладает высокой прогностической эффективностью (AUC≈0,8).
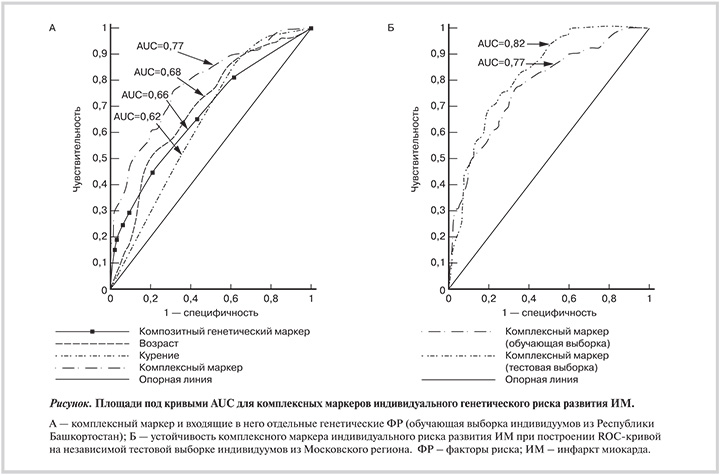
Полученные нами данные укладываются в представление о том, что генетическая предрасположенность является важным ФР развития ИМ. В исследовании INTERHEART неблагоприятный семейный анамнез оказался независимым ФР развития ИМ [1, 11]. В последние десятилетия опубликован большой объем информации об ассоциациях различных полиморфных вариантов генов с риском развития ИМ, наблюдаемых для различных популяций, включая русскую [12—14]. Наряду с исследованиями, выполненными с использованием подхода «ген-кандидат», проведен ряд полногеномных ассоциативных исследований [15]. Однако использование найденных ФР как маркеров ИМ затруднено из-за низкой воспроизводимости результатов, наблюдаемой в большинстве случаев. Наше исследование относится к числу успешных с точки зрения воспроизводимости данных о генетической предрасположенности к ИМ. Действительно, прогностическая значимость полученного комплексного генетического маркера воспроизведена нами на двух независимых выборках русских индивидуумов, проживающих в различных регионах России.
При создании комплексного маркера мы исследовали наряду с генетическими факторами влияние таких мощных ФР, как возраст и курение. На данном этапе исследования мы не учитывали другие ФР, принимая во внимание, что создание комплексного маркера может быть затруднено возможным взаимодействием между генетическими и классическими факторами. Действительно, хорошо известна генетическая обусловленность таких ФР развития ИМ, как артериальная гипертензия [16], сахарный диабет [17] и дислипидемия [18].
Заключение
Предложенный комплексный маркер, характеризующийся устойчивостью прогностической эффективности, может быть использован как основа для создания прогностического теста, позволяющего оценивать индивидуальный риск развития инфаркта миокарда у этнических русских. Однако эти результаты должны быть воспроизведены и в других популяциях, причем особый интерес представляют проспективные исследования.
Работа поддержана грантом Российского научного фонда (проект №16-14-10251).



