Наличие ранней (проявившейся в возрасте ≤55 лет у мужчин или ≤65 лет у женщин) коронарной болезни сердца (КБС) у родственников I степени родства признано одним из основных факторов риска (ФР) развития коронарного атеросклероза [1]. Соответственно у детей лиц с ранней КБС усилия должны быть направлены на выявление модифицируемых (по крайней мере, потенциально) ФР развития атеросклероза. К последним относится низкий уровень холестерина (ХС) липопротеидов высокой плотности (ЛВП) в крови [1, 2—4]. Целью этой работы был поиск собственных и родительских предикторов низкого уровня ХС ЛВП у детей (младшей и старшей возрастных групп) лиц с ранней КБС.
Материал и методы
В рамках программы изучения ФР развития коронарного атеросклероза в семьях лиц с ранней КБС мы обследовали 305 семей: 289 пробандов1 (69,2% мужчин, 79,6% после инфаркта миокарда — ИМ) с ранней КБС, их 213 супругов2 (17,8% мужчин, у 4,23% выявлена КБС) и 399 родных детей пробандов (56,1% лиц мужского пола без КБС) в возрасте 32—67, 28—67 и 5—38 лет соответственно.
Анализ проводили отдельно в группах детей в возрасте 5—17 лет (n=152; 63,2% мужского пола) и 18—38 лет (взрослые дети; n=247; 51,8% мужчин) и в 3 наборах предикторов: собственном (n=399), пробанда-родителя (n=289; 190 из 289 у взрослых детей) и супруга-родителя (n=213: 121 из 213 у взрослых детей).
Определяемые параметры и критерии их оценки. Регистрировали следующие характеристики: массу тела при рождении, длительность грудного кормления, употребление алкоголя, статус курения табака, рост, индекс массы тела (ИМТ), окружность талии (ОТ), частоту сердечных сокращений (ЧСС), систолическое и диастолическое артериальное давление (АД), уровни общего ХС, ХС ЛВП, ХС липопротеидов низкой плотности (ЛНП), триглицеридов (ТГ) в крови, уровень гликемии в сыворотке крови натощак и после пероральной нагрузки глюкозой. Регистрировали также наличие нарушения толерантности к глюкозе и сахарного диабета (СД) [5], артериальной предгипертонии и гипертонии с учетом возраста [6, 7], метаболического синдрома (МС) у лиц в возрасте 10—15 лет [8] и ≥16 лет [9], атерогенной дислипидемии (ДЛП). Кроме того, у родителей учитывали уровень образования и использование пероральных контрацептивных средств. Сведения о массе тела при рождении, длительности грудного кормления, курении, потреблении алкоголя, уровне образования и использовании пероральных контрацептивных средств получали при персональном опросе. Остальные методы обследования изложены нами ранее [10—15].
В группе детей в возрасте 5—17 лет сведения о кормлении материнским молоком отсутствовали у 12 из 152 человек. Об эпизодическом и еженедельном употреблении алкоголя (начиная с 12 лет) сообщили 40 и 2 из 98 подростков 12—17 лет, эпизодическом и ежедневном курении — 5 и 7 из 69 подростков 14—17 лет соответственно. Когда-либо использовали пероральные контрацептивные средства 5, эпизодически и постоянно принимали β-адреноблокаторы соответственно 2 и 1 из 77 супругов-родителей этих детей
Из характеристик, относящихся к группе взрослых детей: эпизодически и постоянно принимали β-адреноблокаторы соответственно 3 и 7 из 136 супругов-родителей.
Определение низкого уровня ХС ЛВП: у лиц в возрасте 5—17 лет ≤25-го процентиля (Исследование Липидных Клиник) [16], у лиц ≥18 лет — <1,03 (45 мг/дл) у мужчин и <1,29 ммоль/л (50 мг/дл) у женщин [9].
Статистический анализ. До оценки связей между низким уровнем ХС ЛВП и другими характеристиками для уменьшения вариабельности и подавления влияния возможных экстремальных значений (выбросов) проведено симметризованное цензурирование непрерывных переменных. Предикторы низкого уровня ХС ЛВП отбирали с поправкой на пол и возраст (дополнительно для ЧСС на прием β-адреноблокаторов, для ТГ, ХС ЛВП и ХС ЛНП на медикаментозное лечение дислипидемий) отдельно в 2 выборках детей: 5—17 лет (n=152) и 18—38 лет (n=247) и в 3 наборах предикторов: собственном (n=399), пробанда-родителя (n=289; 190 из 289 у взрослых детей) и супруга-родителя (n=213; 121 из 213 у взрослых детей). Вначале выполнен бинарный логистический однофакторный регрессионный анализ. Затем полученный в ходе однофакторной регрессии набор предикторов (с р<0,1) был включен в пошаговую регрессионную модель (включения и исключения) для идентификации независимых предикторов низкого уровня ХС ЛВП.
Средние уровни ХС ЛВП сравнивали t-критерием, доли — Z-критерием с поправкой по Йетсу. Данные представлены как среднее значение (m)±стандартное отклонение (SD).
Результаты
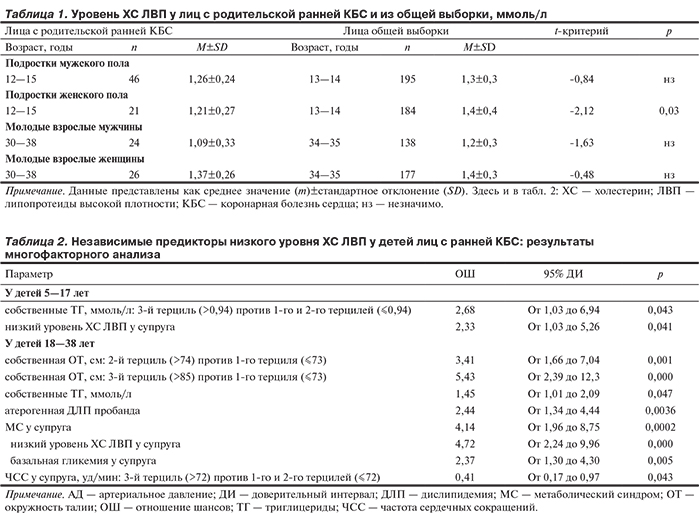
Дети (пробандов) в возрасте 5—17 лет. Уровни ХС ЛВП находились в диапазоне от 0,59 до 2,12 (среднее±стандартное отклонение 1,27±0,25; медиана 1,26); у лиц 12—15 лет — 1,26±0,24 (n=46, мужской пол) и 1,21±0,27 (n=21, женский пол) ммоль/л (табл. 1)
При однофакторном анализе с низким уровнем ХС ЛВП ассоциированы с p<0,1 уровень ТГ, ИМТ, кормление материнским молоком, ОТ, употребление алкоголя, курение этих детей; низкий уровень ХС ЛВП супруга.
Эти характеристики (кроме кормления материнским молоком) включены в пошаговую регрессионную модель. Низкий уровень ХС ЛВП оказался независимо сопряженным с более высокими уровнем ТГ у этих детей и низким уровнем ХС ЛВП у супруга. Отношение шансов (ОШ) верхнего (>0,94 ммоль/л) против двух нижних (≤0,94 ммоль/л) терцилей собственных ТГ 2,68 при 95% доверительном интервале (ДИ) от 1,03 до 6,94 (р=0,043), низкого уровня ХС ЛВП у супруга-родителя 2,33 при 95% ДИ от 1,03 до 5,26 (р=0,041) (табл. 2).
Дети (пробандов) в возрасте 18—38 лет. Детей в возрасте 18—38 лет было 247 (51,8% мужчин). Уровни ХС ЛВП у них находились в диапазоне от 0,49 до 2,56 (1,15±0,30; медиана 1,11, юноши); от 0,80 до 2,56 (1,36±0,30; 1,33, девушки); у лиц в возрасте 30—38 лет —1,09±0,33 (n=24, мужчины) и 1,37±0,26 (n=26, женщины) ммоль/л (см. табл. 1).
Низкий уровень ХС ЛВП выявлен у 91 из (36,8%) 247, в том числе у 39 (30,5%) из 128 мужчин и 52 (43,7%) из 119 женщин. ОШ женщин против мужчин 1,77 при 95% ДИ от 1,05 до 3,00 (р=0,033).
При однофакторном анализе с низким уровнем ХС ЛВП были ассоциированы с p<0,1 ОТ, ИМТ, ТГ и систолическое АД у этих детей; уровень ХС ЛВП, атерогенная ДЛП, ИМТ и высшее образование пробанда; уровень ХС ЛВП, МС, ИМТ, систолическое АД, ЧСС, базальная гликемия, ОТ, ПреАГ/АГ и атерогенная ДЛП у супруга.
При включении в пошаговую регрессионную модель собственных характеристик и характеристик пробанда-родителя низкий уровень ХС ЛВП оказался независимо связанным с более высокими показателями ОТ (ОШ верхнего [>85 см] против нижнего [≤73 см] терциля 5,43 при 95% ДИ от 2,39 до 12,3; р=0,000) и ТГ (ОШ 1,45 при 95% ДИ от 1,01 до 2,09; р=0,047) этих детей и атерогенной ДЛП (ОШ 2,44 при 95% ДИ от 1,34 до 4,44; р=0,0036) пробанда-родителя.
Затем в пошаговую регрессионную модель были включены характеристики супруга-родителя: МС, ИМТ и ЧСС. Низкий уровень ХС ЛВП оказался независимо связанным с МС (ОШ 4,14 при 95% ДИ от 1,96 до 8,75; р=0,0002) и более низкой ЧСС (ОШ верхнего терциля >72 уд/мин против двух нижних терцилей ≤72 уд/мин 0,41 при 95% ДИ от 0,17 до 0,97; р=0,043) у супруга-родителя. После замены МС супруга-родителя его отобранными при однофакторном регрессионном анализе (р<0,1) компонентами (уровень ХС ЛВП, систолическое АД, базальная гликемия, а также ОТ) сохранились только гликемия, ХС ЛВП (обратно), ЧСС супругародителя. ОШ низкого уровня ХС ЛВП 4,72 при 95% ДИ от 2,24 до 9,96 (р=0,000), гликемии 2,37 при 95% ДИ от 1,30 до 4,30 (р=0,005) (см. табл. 2)=.
Обсуждение
В отечественных рекомендациях по профилактике ССЗ у детей и подростков подчеркнуто, что при семейном анамнезе раннего ССЗ необходимо определение липидного профиля. Однако предложенная в них классификация уровней липидов и липопротеидов специфична по возрасту только для ТГ и неспецифична по полу [17]. Поэтому при выборе отрезных точек низкого уровня ХС ЛВП мы отдали предпочтение данным Исследования Липидных Клиник [16], одобренных Академией педиатрии США [18].
Доли детей в возрасте 5—17 лет с уровнями ХС ЛВП ≤10-го и ≤25-го процентилей составили 13,8 и 31,6% соответственно. Обследование общей популяции США с использованием тех же отрезных точек показало, что у лиц в возрасте 8, 11 и 14 лет (n=678) уровни ХС ЛВП <10-го процентиля составили 12,8%, 12,7 и 15,6% соответственно (13,4% в общей группе) [19]. Мы не нашли отечественных работ, в которых были бы использованы аналогичные отрезные точки. Однако существуют данные проспективного исследования с участием лиц в возрасте 13—14 лет, в ходе которого были определены средние уровни ХС ЛВП у 195 мальчиков (1,3±0,3 ммоль) и 184 девочек (1,4±0,4 ммоль/л) (см. табл. 1), средние уровни ХС ЛВП были выше (р<0,001) у девочек [20]. Поэтому для сравнения средних уровней ХС ЛВП мы сформировали две сходные по возрасту подвыборки, среднее и стандартное отклонения уровня ХС ЛВП у подростков в возрасте 12—15 лет составили 1,26±0,24 (n=46, мужской пол) и 1,21±0,27 (n=21, женский пол) ммоль/л.
Доли детей в возрасте 18—38 лет с низким уровнем ХС ЛВП составили 30,5 и 43,7% соответственно у лиц мужского и женского пола (в общей группе 36,8%); низкий уровень ХС ЛВП ассоциировался с полом (ОШ женщин против мужчин 1,77 при 95% ДИ от 1,05 до 3,00; р=0,033). В продольном Богалузском исследовании, в котором приняли участие лица 4—17 лет (средний период наблюдения 15 лет) с положительным (n=303) и отрицательным (n=1 136) родительским анамнезом сахарного диабета, доля низкого уровня у молодых взрослых (без отягощенного анамнеза) составила 31% [21]. Исследование выборки общей популяции Франции (18 483 мужчин и 22 047 женщин в возрасте 16—79 лет) показало, что низкий уровень ХС ЛВП встречался более чем в 2 раза чаще у женщин, чем у мужчин [22]. Мы не нашли отечественных работ, в которых были бы использованы аналогичные отрезные точки. Поэтому в силу причин, указанных выше, для сравнения мы сформировали сопоставимую по возрасту подвыборку молодых взрослых. В ней среднее и стандартное отклонения уровня ХС ЛВП у детей в возрасте 30—38 лет составили 1,09±0,33 (n=24, мужчины) и 1,37±0,26 ммоль/л (n=26, женщины). В ранее упомянутом отечественном проспективном наблюдении московских школьников общей выборки среднее и стандартное отклонения уровня ХС ЛВП у лиц в возрасте 34—35 лет составили 1,2±0,3 (n=138, мужчины) и 1,4±0,3 (n=177, женщины) ммоль/л (см. табл. 1), средние уровни ХС ЛВП были выше (р<0,001) у женщин [20].
Таким образом, полученные нами результаты в целом не противоречат данным литературы и соответствуют представлениям о том, что у лиц детского, подросткового и молодого взрослого возраста низкий уровень ХС ЛВП в крови не участвует в реализации положительного родительского анамнеза ранней КБС. Однако сопоставление данных, полученных в нашей и другой отечественной подвыборке, показало, что средние уровни ХС ЛВП у девочек были значимо ниже в группе риска. Возможной причиной, объясняющей это противоречие, является небольшая численность сравниваемых групп двух отечественных исследований.
В настоящее время накапливаются данные, что на показатели липидного состава крови влияют как факторы окружающей среды (диета и физическая активность), так и генетические факторы [23]. Наша группа не изучала раздельный вклад генетических факторов и факторов окружающей среды на устойчивость показателей липидного состава крови. Но такие работы (исследование из США и Китая 596 пар китайских близнецов, в возрасте 6—12 лет [исходно] и 13—19 лет [дальнейшее наблюдение]) были проведены. Эта устойчивость (по коэффициентам корреляции) составила 0,53 (общий ХС), 0,26 (ТГ), 0,35 (ХС ЛВП) и 0,41 (ХС ЛНП) и для общего ХС и ХС ЛНП определялась, прежде всего, генетическими факторами, тогда как уровень ХС ЛВП определялся в равной мере генетическими факторами и факторами окружающей среды [24].
Показано, что переоценка роли генетического компонента может снизить мотивацию к улучшению профиля ФР развития ССЗ [25]. Поэтому данные о том, что уровень ХС ЛВП в крови определяется в равной мере факторами окружающей среды и генетическими факторами [23], носят ценный характер, делая низкий уровень ХС ЛВП «удобной мишенью» для профилактических мер, направленных на предупреждение появления и развития ССЗ.
У детей в возрасте 5—17 лет низкий уровень ХС ЛВП оказался независимо связан с более высокими показателями собственных ТГ, что соответствует данным литературы об ассоциации компонентов МС [8].
Мы выявили корреляцию (агрегацию) низкого уровня ХС ЛВП детей 5—17 лет с ХС ЛВП их супругов-родителей (81 из 92 матерей), но не с ХС ЛВП их пробандов-родителей (83 из 99 отцов). Низкий уровень ХС ЛВП у супругов-родителей более чем в 2 раза независимо повышал риск низкого уровня ХС ЛВП у этих детей. Наш результат соответствует данным литературы. Наличие семейной агрегации переменных липидного состава крови (общий ХС, ТГ, ХС ЛВП и ХС ЛНП), давно установлен. Показано, что корреляции общего ХС, ТГ, ХС ЛВП и ХС ЛНП мать—дети теснее, чем корреляции отец—дети, причем статистически значимыми различия (между корреляционными коэффициентами отец— дети и мать—дети) были только для ХС ЛВП [26].
Недостатком нашего исследования является отсутствие контрольной группы. Поэтому мы не могли сравнить агрегацию показателей липидного состава крови родители— дети в семьях лиц с ранней КБС с данными, полученными в семьях без родительской КБС. Однако такое исследование с участием обоих родителей и их детей подросткового возраста (17 лет) было проведено. В нем приняли участие 154 семьи (37 из 154 с первым ИМ). Средние уровни общего ХС,ХС ЛНПиТГвкровибыливышеулицсИМиихжен по сравнению с контрольными семьями. Уровень ХС ЛВП был ниже у лиц с ИМ и их жен по сравнению с контрольными семьями и не различался у детей сравниваемых семей. Корреляция отец—ребенок по уровню ХС ЛВП была ниже в семьях с ИМ (r=-0,17), чем в контрольных (r=0,22; р<0,05). После включения в анализ 5 семей, в которых пробандом была мать, различия по коэффициентам корреляции родитель—ребенок стали еще более значительными (r=-0,16 и r=0,34; р<0,01 соответственно). Корреляции отец—ребенок по общему ХС, ХС ЛНП и ТГ в семьях с ИМ (r=0,31, r=0,37, r=0,08) и контрольных (r=0,24, r=0,20, r=0,21) соответственно не различались. После включения в анализ 5 семей, в которых пробандом была мать, различий (корреляций родитель—ребенок) также не выявлено (r=0,43, r=0,49, r=0,15) и (r=0,32, r=0,29, r=0,26, соответственно). Исследователи пришли к выводу, что (в отличие от общего ХС и ХС ЛНП) ХС ЛВП не может быть маркером атеросклеротического риска у подростков [27].
Известно, что агрегация различных фенотипических признаков между родителями и детьми, включая ФР развития КБС, в частности низкий уровень ХС ЛВП, всегда обусловлена действием генетических (постоянных) факторов. Действие же экзогенных (преходящих) факторов длится, по меньшей мере, до того времени, пока родители и дети живут вместе. Мы выявили семейную агрегацию низкого уровня ХС ЛВП как у детей младшей (только с супругом-родителем), так и старшей (с обоими родителями) возрастных групп. При этом обращает на себя внимание, что показатели этой агрегации у детей старшей возрастной группы выше, чем в младшей, контрастируя с тем, что ряд взрослых детей перестали жить с родителями, создав свои семьи. Мы не оценивали эту агрегацию в одних и тех же семьях спустя определенное время. Поэтому мы можем только предположить, что выявленная агрегация не только устойчива во времени, но и растет. Однако исследования, в которых анализировалась устойчивость семейных агрегаций различных ФР развития КБС, были проведены, в частности, как часть продольного исследования Bogalusa Heart Study, в котором приняли участие 727 детей (средний возраст 11,2 года) и их родителей подросткового (средний возраст 11,3 года) и молодого взрослого (средний возраст 25,5 года) возраста. В нем показано, что корреляции мать—ребенок (в отличие от уровня ХС ЛВП и ТГ) в детском и подростковом возрасте для ИМТ, систолического/диастолического АД и ХС ЛНП более тесные, чем в молодом взрослом возрасте. Иными словами, фенотипическое сходство между матерью и ее ребенком в этом возрастном диапазоне по ИМТ, АД и ХС ЛНП уменьшается, а по ХС ЛВП и ТГ — нет. Сходная (но менее тесная) связь была выявлена и для корреляций отец—ребенок [28]. Исследований, в которых бы изучалась устойчивость (во времени) корреляций родители—дети показателей липидного состава крови в семьях с ранней КБС, авторам статьи найти не удалось. Удовлетворительного объяснения более тесной (у детей старшей по сравнению с младшей возрастной группой) агрегации низкого уровня ХС ЛВП родители—дети мы дать не можем. Пытаясь интерпретировать сравнительно высокие показатели агрегации между родителями и их взрослыми детьми, мы можем высказать два предположения. Во-первых, взрослые дети с родительским анамнезом ранней КБС, даже перестав жить с родителями, сохраняют семейную модель нездорового образа жизни. Продольные исследования показали, что привычки образа жизни (курение, физическая активность, пищевые предпочтения) появляются рано и характеризуются устойчивостью [29]. Во-вторых, такие дети, обычно имея сравнительно плохой профиль ФР развития ССЗ (например, имеющие избыточную массу тела, курящие, малоподвижные, потребляющие с пищей много твердого жира и простых углеводов), выбирают себе в пару (для брака) человека со сходными характеристиками. В обзоре и метаанализе итальянских исследователей (более 100 тыс. пар) показана конкордантность (сходство) супругов по большинству известных ФР, особенно по курению и ИМТ [30].
У взрослых детей мы выявили тесную независимую ассоциацию низкого уровня ХС ЛВП с более высокими показателями собственной ОТ. Если значение ОТ было в верхнем терциле (>85 см), это повышало вероятность по сравнению с нижним терцилем (≤73 см) низкого уровня ХС ЛВП почти в 5,5 раза. Мы также выявили слабую независимую ассоциацию низкого уровня ХС ЛВП с более высокими уровнями собственных ТГ. Найденные две ассоциации соответствуют данным литературы о кластеризации компонентов МС; для его диагностики мы использовали отрезные точки Гармонизированных критериев [9].
Низкий уровень ХС ЛВП у взрослых детей оказался, главным образом, связан с метаболическими ФР обоих родителей, прежде всего, с характеристиками супруга-родителя. МС супруга-родителя (94 из 121 матерей) более чем в 4 раза независимо повышал вероятность наличия низкого уровня ХС ЛВП у этих детей. При дальнейшем анализе выяснилось, что ассоциация родительского МС с низким уровнем ХС ЛВП взрослых детей обусловлена такими компонентами МС, как низкий уровень ХС ЛВП и (в меньшей степени) базальная гликемия супругародителя. Низкий уровень ХС ЛВП у этих детей также независимо, но менее тесно, ассоциировался только с атерогенной ДЛП пробанда-родителя (117 из 190 отцов). Данные о более тесной агрегации мать—дети (а не отец—дети) по уровню ХС ЛВП получены нами и в однофакторном анализе. Это соответствует данным литературы. Наше исследование не было генетическим, но работы, в которых оценивались показатели наследуемости различных компонентов МС (по корреляциям родители—дети), проведены. В одном их них (приняли участие здоровые лица >15 лет) получены данные, свидетельствующие о различной степени наследуемости (более низкая для систолического, диастолического АД и ТГ, более высокая — для других компонентов МС). Эта наследуемость (кроме нарушения гликемии натощак) была выше по корреляциям мать—дети, чем отец—дети [31]. Данные о том, что корреляция (по показателям липидного состава крови) родитель—ребенок более тесная с матерью, а не с отцом как в парах родители—дети, так и в парах родители—взрослые дети, получены и в более ранних работах [32].
Другой родительской характеристикой, независимо повышающей шансы (почти в 2,5 раза) взрослых детей иметь низкий уровень ХС ЛВП, была базальная гликемия супруга-родителя. Это также соответствует данным литературы. В исследовании случай—контроль приняли участие 114 человек (64 мужчин, 50 женщин) молодого взрослого возраста. Получены данные, что лица с родительским анамнезом СД 2-го типа (а также нормальными показателями ИМТ и гликемии) имели более низкие уровни ХС ЛВП (р<0,001), чем лица в контрольной группе, т.е. без родительского анамнеза СД 2-го типа [33]. Кроме того, низкий уровень ХС ЛВП и гипергликемия являются компонентами МС, кластеризация которых известна и доказана [9].
Наконец, мы обнаружили слабую обратную независимую ассоциацию низкого уровня ХС ЛВП у взрослых детей c ЧСС их супругов-родителей (анализируемая выборка детей в пошаговой процедуре составила 56 из 153). Работ, в которых была бы выявлена подобная ассоциация между родителями и их детьми, найти не удалось. Что касается ЧСС и уровня ХС ЛВП как собственных признаков, то данные литературы, напротив, свидетельствуют о том, что высокая ЧСС прямо ассоциируется с МС и его компонентами. В исследовании (приняли участие 2959 человек, 1880 мужчин) собственная ЧСС была выше у лиц с МС (р<0,0001, мужчины; р<0,001, женщины) и выявлена ассоциация (менее тесная у женщин) ЧСС с некоторыми компонентами МС (но не с низким уровнем ХС ЛВП у женщин) [34]. Возможно, выявленная нами ассоциация отражает влияние ряда неучтенных факторов.
Заключение
В группе лиц различного возраста с родительским анамнезом ранней коронарной болезни сердца независимыми предикторами низкого уровня холестерина липопротеидов высокой плотности в крови были, главным образом, собственные (триглицериды) и родительские метаболические факторы.



