Фибрилляция предсердий (ФП) — наиболее распространенное тяжелое нарушение ритма сердца, частота развития которого существенно увеличивается с возрастом. По данным американских авторов, среди лиц моложе 60 лет ФП выявляется менее чем у 1%, тогда как в возрасте старше 80 лет доля таких больных достигает 7% и более [1]. Более того, число больных ФП может удвоиться в будущем в связи с постарением населения, которое наблюдается в последние годы во всех экономически развитых странах [2]. Согласно российским данным, распространенность ФП среди лиц в возрасте 35—74 лет составляет 0,75%, в том числе 0,73% у мужчин и 0,79% у женщин, также достоверно увеличивается с возрастом, особенно после 55 лет [3].
Опасность ФП определяется высокой частотой фатальных и нефатальных осложнений [4, 5]. В частности, наличие ФП в 5 раз увеличивает риск возникновения инсульта [6] и в 3 раза – риск развития сердечной недостаточности [7].
Постарение населения и увеличивающаяся в связи с этим распространенность хронических неинфекционных заболеваний ложится тяжелым бременем на систему здравоохранения. Так, по данным M.W. Rich [8], социальные последствия ФП могут удвоиться в течение будущих трех десятилетий.
Среди прогностических факторов, влияющих на возникновение ФП, называют возраст, ожирение, гипертрофию левого желудочка (ГЛЖ), артериальную гипертонию (АГ), а также некоторые поведенческие факторы [9—11]. Большинство этих показателей также являются факторами риска (ФР) развития ишемической болезни сердца или хронической сердечной недостаточности [12]. Вместе с тем результаты исследований, изучающих взаимосвязь ФП с ФР, противоречивы.
Так, отмечаются как положительные, так и отрицательные ассоциации между ФП и нарушениями липидного обмена [13, 14]. Вопросы взаимосвязи ФП и смертности в нашей стране практически не изучались.
Целью настоящего анализа является изучение вклада ФП в смертность от всех причин и от сердечно-сосудистых заболеваний (ССЗ) у российского населения, проживающего в условиях крупного промышленного города.
Материал и методы
Материалом для анализа послужили представительные выборки населения Москвы и Санкт-Петербурга — мужчин и женщин в возрасте 35 лет и старше, обследованных в разные годы, начиная с 1975—1977 гг. и заканчивая 1999—2001 гг. Всего обследованы 20 045 человек, в том числе 12 177 в Москве и 7868 в Санкт-Петербурге, 15 107 мужчин, 4938 женщин. Отклик на обследование составил 75%.
Всех пациентов обследовали по единому протоколу, который включал стандартный опрос, содержащий информацию о социально-демографических показателях, ФР, анамнестических данных. Всем обследованным дважды измеряли артериальное давление (АД), в анализ включали среднее из двух измерений; регистрировали частоту сердечных сокращений (ЧСС) пальпаторным методом и по электрокардио-грамме (ЭКГ); измеряли рост, массу тела, рассчитывали индекс массы тела (ИМТ). Из лабораторных биохимических параметров определяли уровни общего холестерина (ОХС), холестерина (ХС) липопротеидов высокой плотности (ЛВП), триглицеридов (ТГ). Кровь для анализов брали натощак после 12 часов голодания. ЭКГ в покое регистрировали в положении пациента лежа на спине в 12 отведениях. Анализ ЭКГ проводили с помощью Миннесотского кода (МК) в пересмотре 1982 г. два независимых эксперта с привлечением третьего в случае несогласия [15]. Выделяли следующие патологические изменения на ЭКГ: крупноочаговый инфаркт миокарда (ИМ) — зубцы QQS, (МК 1—1,2); минимальные зубцы QQS (МК 128—13); ГЛЖ констатировали при наличии на ЭКГ высоких зубцов R (R>20 мм или в aVL>12 мм, или в V5 или V6>26 мм) или если сумма зубцов R в отведениях V5 или V6 и S в отведении V1>35 мм (МК 3—1, 3—3) [16]; ишемические изменения на ЭКГ: (МК 4—1,2 и/или 5—1,2 без ГЛЖ). Нарушения проводимости включали атриовентрикулярную блокаду I и II ст. (6—1,2) и полную блокаду левой ножки пучка Гиса (7—1). Все указанные признаки вошли в группу клинически значимых изменений ЭКГ.
ФП регистрировалась как категория МК 8—3 [17]. В исследовании отсутствовали данные о причине ФП; кроме того, не были зафиксированы терапия и форма ФП. В анализ включали все случаи ФП и трепетания предсердий суммарно. Клапанные пороки сердца в анамнезе не обнаружены. Всего выявлено 140 случаев ФП, из них 111 у мужчин.
АГ диагностировали при АД выше 140/90 мм рт.ст. и/или если пациент принимал антигипертензивные препараты. ЧСС более 80 уд/мин расценивали как повышенную. Стенокардию напряжения и ИМ в анамнезе диагностировали согласно алгоритму кардиологического вопросника Всемирной организации здравоохранения [18]. Уровни ХС и ТГ≥5,0 ммоль/л и ≥1,7 ммоль/л соответственно определяли как повышенные; уровни ХС ЛВП≤1,0 и 1,2 ммоль/л — как сниженные для мужчин и женщин соответственно. Ожирение оценивали по ИМТ≥30 кг/м2. Курящими считали лиц, выкуривавших ежедневно хотя бы одну сигарету/папиросу. Чрезмерно употребляющими алкоголь считали мужчин, которые употребляли >168 г чистого этанола в неделю, и женщин, употреблявших >84 г чистого этанола в неделю. По уровню образования пациенты разделялись на 3 группы: ниже среднего, среднее, выше среднего.
Все процедуры были стандартизованы. Исследователи прошли специальный тренинг.
За обследованными когортами осуществляли регулярное наблюдение с ежегодным определением жизненного статуса. Подробный протокол наблюдения за смертностью опубликован ранее [19, 20]. На конец 2014 г. число смертей составило 9909 (8164 мужчин и 1745 женщин). Медиана периода наблюдения за когортами достигала 23 года.
Статистический анализ данных проводили с помощью системы статистического анализа и извлечения информации SAS. Использовали стандартные методы описательной статистики и известные критерии значимости (χ2-критерий, t-критерий Стьюдента, F-критерий Фишера). Кроме того, применяли методы аналитической статистики: дисперсионно-ковариационный анализ в версии процедуры SAS PROC GLM.
Анализ данных смертности проводили в регрессионной модели пропорционального риска (Кокса). Использовали две модели отдельно для мужчин и женщин. В Модели 1 проводили стандартизацию только на возраст, город, год скрининга, тогда как в Модель 2 дополнительно включали изучаемые ФР и клинические симптомы: статус курения и употребления алкоголя, ожирение, АГ, повышенный уровень ХС и ТГ и сниженный уровень ХС ЛВП, ЧСС>80 уд/мин, зубцы QQS и ишемические изменения на ЭКГ различной степени выраженности, нарушения проводимости, ГЛЖ, стенокардия и ИМ в анамнезе. Модели стратифицированы по образованию.

Результаты
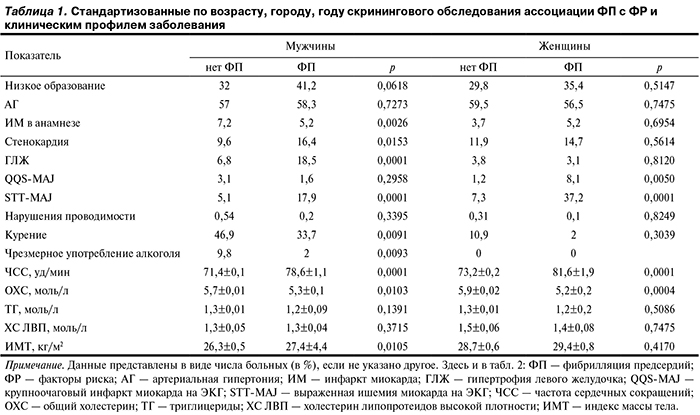
Средний возраст изучаемой популяции составил 47 лет, мужчины чуть моложе женщин (46,4±9,6 и 48,0±11,9 года соответственно). В табл. 1 представлены исходные характеристики изучаемой популяции в зависимости от наличия ФП, стандартизованные на основные переменные (возраст, город, год скрининга). Выявлена тенденция более высокой частоты развития ФП у мужчин с низким уровнем образования (р=0,06), не найденная у женщин. Результаты демонстрируют неоднозначные ассоциации между ФП и традиционными ФР. Так, мы не обнаружили статистически значимых различий по частоте выявления АГ у больных ФП по сравнению с группой лиц без данного состояния (58,3% против 57% у мужчин и 56,5% против 59,5% у женщин). ИМ и стенокардия в анамнезе достоверно чаще выявлялись только у мужчин с ФП. Ассоциации ФП с признаками ГЛЖ и ишемическими изменениями на ЭКГ также были обнаружены только у мужчин, тогда как признаки крупноочагового ИМ на ЭКГ (зубцы QQS) достоверно чаще наблюдались у женщин с ФП. ФП достоверно ассоциировалась с меньшей распространенностью курения и чрезмерного употребления алкоголя у мужчин, тогда как более низкий уровень ХС статистически значимо чаще наблюдался у мужчин и женщин с ФП. Уровень ТГ и ХС ЛВП не зависел от наличия ФП.
В то же время более высокая ЧСС достоверно чаще ассоциировалась с ФП как у мужчин, так и у женщин: у мужчин с ФП 78,6±1,1 уд/мин против 71,4±0,1 уд/мин у лиц без ФП; у женщин 81,6±1,9 уд/мин против 73,2±0,2 уд/мин соответственно (р<0,0001). Повышенный ИМТ чаще наблюдался у мужчин с ФП по сравнению с теми, кто не имел этой патологии. На рис. 1—3 представлены кривые Каплана—Майера, демонстрирующие накопленный риск фатальных осложнений ССЗ, в том числе смерти от инсульта и от всех причин у мужчин и женщин 35—64 лет в зависимости от наличия у них ФП. Дополнительно в модель для сравнения была включена группа лиц с выраженными изменениями на ЭКГ, которые имели наиболее явные ассоциации со смертностью [21].
Тем не менее наиболее опасным оказалось наличие ФП, особенно для женщин. У мужчин наблюдался более пологий подъем кривой смертности от всех причин, чем у женщин, а более резкий подъем смертности от ССЗ определился через 25 и 15 лет соответственно. Кривые смертности от инсульта наиболее выразительно отражают вклад ФП для этой причины смерти; показано, что женщины умирают быстрее. Примечательно, что смертность больных ФП выше, чем смертность лиц с другими клинически выраженными изменениями на ЭКГ.
Относительный риск (ОР) смерти в зависимости от ФП определяли отдельно для мужчин и женщин с использованием моделей пропорционального риска (табл. 2). В первом случае (Модель 1) риск смерти от ССЗ у мужчин с ФП был в 2,9 раза выше, чем у их сверстников без данной патологии (p<0,0001), у женщин — в 4,5 раза (p<0,0001). После дополнительной коррекции на все изучаемые факторы (Модель 2) этот показатель несколько уменьшился и составил у мужчин 2,49 (при 95% доверительном интервале — ДИ от 1,796 до 3,210; p<0,0001). У женщин ОР смерти от ССЗ в Модели 2 составлял 4,7 (при 95% ДИ от 3,077 до 7,333; р<0,0001). Следует отметить, что прогностическая значимость вклада ФП в смертность от ССЗ в популяции российских женщин уступала только возрасту. Аналогичные результаты были получены для общей смертности (табл. 2).
Обсуждение
Будучи самостоятельным и весьма тяжелым патологическим состоянием ФП ассоциируется с другими факторами и клиническими симптомами, которые увеличивают вероятность появления данного нарушения ритма сердца. Так, результаты многочисленных исследований показали, что АГ является бесспорным ФР развития ФП [4, 22]. Более поздние исследования предоставили более детальные данные о связи повышения АД с развитием ФП [23, 24]. Исследования K.B. Yep и соавт. (2008) в Сингапуре и Н. Inoue и соавт. (2009) в Японии показали статистически значимую связь между АГ и ФП [25, 26]. В нашем исследовании не выявлено достоверных ассоциаций между наличием АГ и ФП. Аналогично S. Stewart и соавт. (2001) не обнаружили зависимости между уровнем систолического и диастолического АД и ФП, лишь среди женщин диастолическое АД было статистически значимо выше у страдающих ФП [5].

Данные нашего исследования частично могут объясняться весьма существенным вкладом АГ в смертность российского населения, а сочетание АГ и ФП, значительно увеличивая смертность, приводит к тому, что больные, у которых имелись оба эти состояния, умирают раньше других.
Ожирение — другой важнейший фактор, претендующий на первенство во влиянии на развитие ФП [27, 28]. Датское исследование представило свидетельства, что не только ожирение, но и избыточная масса тела может способствовать развитию ФП [27], однако это не всегда подтверждалось в других исследованиях. В частности, мы выявили положительные ассоциации между повышенным ИМТ только у мужчин, но не у женщин, а K.B. Yap и соавт. не обнаружили связи между ожирением и ФП [25]. W.B. Kannel и соавт. еще в 1998 г. [29] показали, что ни ожирение, ни прием алкоголя не были ассоциированы с развитием ФП. Вместе с тем чрезмерное употребление алкоголя ассоциируется с повышенным риском развития ФП, независимо от других ФР [30—32].
В нашем исследовании чрезмерное употребление алкоголя у мужчин чаще выявляется среди мужчин с ФП, чем среди тех, кто не имеет этого нарушения ритма сердца.
Принято считать, что курение ассоциируется с развитием ФП, однако не все исследователи демонстрируют единодушие и по этому вопросу [4, 22, 33]. S. Stewart и соавт. (2002) показали, что женщины с ФП чаще курили (65,8% против 54,1%), мужчины курили практически одинаково (79% против 81,2%), но все эти различия были недостоверными [5]. K.B. Yep и соавт. (2008) продемонстрировали значимые положительные ассоциации между курением и ФП [25]. Наши данные свидетельствуют о достоверно более низкой распространенности курения у мужчин с ФП. Это можно объяснить тем, что пациенты отказываются от курения, узнав об ухудшении здоровья.
Связь между уровнем липидов и развитием ФП также пока недостаточно понятна. Неожиданно высокий уровень ХС ассоциируется со сниженным риском развития ФП [22]. Исследователи предположили, что низкий уровень ХС ЛВП может влиять на предсердную уязвимость и вызывать ФП [34], но это пока не считается доказанным. Вместе с тем в исследовании АRIC (2012) авторы не нашли независимых ассоциаций между уровнем ХС ЛВП, ТГ и развитием ФП, тогда как низкий уровень ХС и ХС ЛНП ассоциировался с высоким риском развития ФП [14]. Аналогичные результаты были получены в нашем исследовании. Уровень ОХС был достоверно ниже у лиц с ФП в отсутствие связи между ФП и уровнями ХС ЛВП и ТГ. Не выявлено независимых ассоциаций между липидснижающей терапией статинами и риском развития ФП при множественном регрессионном анализе [14].
Результаты нашего исследования показали недвусмысленные положительные ассоциации между уровнем ФП и ЧСС (р<0,0001), что, по сути, не является удивительным. В частности, в португальском одномоментном исследовании были получены ассоциации максимальной ЧСС при 24-часовом мониторировании ЭКГ (ОШ 1,022 при 95% ДИ от 1,004 до 1,040; р<0,015), в то же время прием β-адреноблокаторов достоверно снижал частоту возникновение эпизодов ФП [35]. Это весьма интересная информация, поскольку повышенная ЧСС сама является ФР развития фатальных и нефатальных осложнений, в том числе в российской популяции [36]. К настоящему времени в литературе имеется достаточно данных, в которых обсуждается важность для прогноза контроля как ЧСС, так и ритма [37].
Известно, что ФП существенно уменьшает продолжительность жизни. Кривые накопленной смертности, полученные в нашем исследовании, показали чрезвычайно высокие показатели, особенно смертности от инсульта у женщин уже в первые 5 лет после исходного обследования, что дает основание рассматривать ФП как опасный предвестник фатальных осложнений, если не принимать адекватных мер. ФП удваивает и утраивает смертность даже при коррекции на коморбидные состояния и ФР. Имеющиеся данные свидетельствуют о том, что ФП является независимым предиктором смерти, и хотя большинство исследований было выполнено у пожилых, имеются данные обследования популяции моложе 65 лет. В этом исследовании, включающем 272 186 пациентов с ФП, показано, что риск смерти при наличии ФП у женщин в 2,15 раза, а у мужчин — в 1,76 раза выше [38], чем без ФП, и риск смерти у женщин достоверно выше, чем у мужчин, что совпадает с выводами нашего исследования.
Следует подчеркнуть, что в нашем исследовании отмечался очень высокий риск смерти, особенно от ССЗ.
Даже после коррекции на ФР и клинический профиль заболевания риск смерти от ССЗ составил 2,4 для мужчин и 4,7 для женщин (см. табл. 2). В частности, результаты Фрамингемского исследования показали, что после коррекции на ФР и коморбидные состояния риск смерти составил только 1,9 у женщин и 1,5 у мужчин во всех возрастных категориях [12]. В исследовании S. Stewart и соавт. [5] аналогичный показатель для женщин был 2,2, для мужчин — 1,5.
Интересные замечания высказали D.P. Lеоng и соавт. [39] в ответ на статью Е. Andersson и соавт. [38]. Является ли подъем смертности при ФП ассоциированным или причинным. Авторы резонно отмечают различные факторы, которые могут потенциально влиять на смертность и которые не учитывались в исследовании. Кстати, каждый исследователь добавляет в число этих факторов свои показатели и в разных вариациях. Поэтому D.P. Lеоng и соавт. сомневаются в том, что Е. Andersson и соавт. оценивают непосредственный эффект ФП, а не результат множества ассоциированных факторов. Вероятно, сама ФП может прямо повышать риск смерти, но также может быть маркером прогрессирования сопутствующих заболеваний, которые тесно ассоциированы со смертностью.
Наши данные позволяют предполагать, что ФП является высоко достоверным, весьма опасным и независимым ФР смерти в российской популяции, особенно для женщин. Следует отметить, что в настоящее время кардиология далеко продвинулась в профилактике осложнений ФП. Приход в практику новых пероральных антикоагулянтов оживил интерес к этой проблеме, проводятся новые клинические исследования, основанные на принципах доказательной медицины.
Ограничения исследования. Малый объем выборки женщин затрудняет возможность полноценного анализа, вместе с тем имеющиеся различия по распространенности факторов и клинических состояний между полами, особенно в молодом возрасте, не позволили провести совместный анализ. Следует учитывать, что некоторые когорты были обследованы в конце 70-х гг. прошлого века, когда диагностика и терапия ФП были на другом уровне.
Заключение
В российской популяции среднего возраста фибрилляция предсердий достоверно положительно ассоциируется с частотой сердечных сокращений и признаками ишемической болезни сердца и отрицательно — с уровнем общего холестерина. Гипертрофия левого желудочка и индекс массы тела выше лишь у мужчин с фибрилляцией предсердий, но не у женщин. Фибрилляция предсердий, частота развития которой достоверно не различается у мужчин и женщин, сопровождается более высоким риском смерти от сердечно-сосудистых заболеваний и от всех причин у женщин по сравнению с мужчинами. Даже после коррекции на традиционные факторы риска и клинический профиль заболевания женщины с фибрилляцией предсердий умирают от сердечно-сосудистых заболеваний в 4,7 раза, тогда как мужчины — лишь в 2,4 раза чаще, чем без фибрилляции предсердий. Аналогичные показатели риска смерти от всех причин составили 3,2 и 2,0 соответственно. По вкладу в смертность у женщин фибрилляция предсердий уступает только возрасту.



