Успешное применение противоопухолевых антибиотиков — антрациклинов в последние годы привело к существенному повышению выживаемости онкологических больных. В связи с этим увеличилось число больных, у которых отмечается отсроченное кардиотоксическое действие противоопухолевых препаратов [1, 2], проявляющееся в виде систолической дисфункции левого желудочка (ЛЖ) и сердечной недостаточности (СН) [3]. Этот симптомокомплекс получил название антрациклиновой кардиомиопатии.
Данный вид патологии сердца служит предметом многочисленных исследований как в клинике, так и в эксперименте. Механизм токсического действия доксорубицина — наиболее часто используемого антибиотика — весьма разнообразен: поражаются практически все органеллы кардиомиоцитов, но в наибольшей степени — мембраны, благодаря наличию в них большого количества кардиолипина, имеющего к доксорубицину повышенное сродство [4]. Нарушаются функция митохондрий [5—7] и ионный транспорт [8, 9], естественным следствием является нарушение сократительной функции сердца [10]. Большинство работ направлено на изучение способов предупреждения или уменьшения токсичности антрациклинов, в то время как динамика формирования СН служила предметом изучения в немногочисленных исследованиях [11, 12]. В связи с этим в данной работе мы изучали состояние сердца на разных сроках действия доксорубицина.
Методика исследования. Опыты выполняли на наркотизированных кетамином (100 мг/кг) или золетилом (5 мг/кг) самцах крыс Вистар массой 300—350 г. Всего было выполнено 4 серии экспериментов, в которых кумулятивная доза вводимого доксорубицина варьировала от 8 до 20 мг/кг, которые вводили подкожно еженедельно по 2 мг/кг.
В первой серии, поставленной по классическим образцам, целью которой было изучение кардиодинамики при помощи эхокардиографии (ЭхоКГ), было использовано 50 крыс, которым вводили доксорубицин, и 17 контрольных животных. После 7 нед введения погибло 20% крыс, после 8 нед — 44%, а после 10 нед (кумулятивная доза 20 мг/кг) — 56%. В связи с этим во второй серии (n=81) количество введений доксорубицина было ограничено 8 (кумулятивная доза 16 мг/кг). Через 10 нед смертность составила 27%. По результатам ЭхоКГ (n=59), явное снижение фракции выброса (ФВ) обнаружено в 54% случаев, пограничные значения — в 26% и без изменений ФВ — 20%. В этой серии были выполнены опыты с катетеризацией аорты и ЛЖ. В третьей серии (n=45) смертность после 8 введений доксорубицина составила 39%. Животные были использованы для опытов с ЭхоКГ и катетеризацией аорты и ЛЖ в различные сроки. В четвертой серии (n=25) количество введений доксорубицина было ограничено 4 (кумулятивная доза 8 мг/кг).
 Животные были исследованы через 6—7 нед в опытах с ЭхоКГ и катетеризацией аорты и ЛЖ.
Животные были исследованы через 6—7 нед в опытах с ЭхоКГ и катетеризацией аорты и ЛЖ.
ЭхоКГ. Исследование функции сердца наркотизированных крыс выполняли на аппарате iE33 с использованием датчика S12—4 (4—12 MГц). Конечный диастолический и конечный систолический размеры ЛЖ, а также толщину задней стенки ЛЖ измеряли в М-режиме из парастернального доступа в проекции длинной оси сердца; площадь поперечного сечения ЛЖ в конце диастолы (Sd, см2) и в конце систолы (Ss, см2) определяли из парастернального доступа в проекции по короткой оси сердца на уровне папиллярных мышц, рассчитывая процент изменения площади поперечного сечения ЛЖ в систолу по следующей формуле: ΔS%= (Sd–Ss)/Sd·100. Конечный диастолический объем и конечный систолический объем ЛЖ и ФВ определяли с использованием модифицированного алгоритма Симпсона из апикального доступа в 3 проекциях (4- и 2-камерных и по длинной оси ЛЖ). Интеграл линейной скорости кровотока (VTI, см) — эквивалент ударного объема, а также ударный объем и сердечный выброс (мл/мин) определяли с помощью допплеровского исследования в импульсном режиме на уровне выходного тракта ЛЖ.
Катетеризация. У наркотизированных животных регистрировали электрокардиограмму (ЭКГ) во II стандартном отведении, давление в аорте и ЛЖ. Для регистрации давления в большинстве серий использовали милларовский прецизионный микроманометр на конце тонкого (диаметр 0,53 мм) катетера, введенного через сонную артерию, и тензометрический усилитель. Артериальное давление (АД) через катетер в бедренной артерии измеряли с помощью электроманометра.
Сигналы АД, давления в ЛЖ и ЭКГ подавали на «Biograph-4». Измеряли традиционные показатели сократимости — максимальную скорость развития давления (+dP/dtmax) и индекс сократимости (ИС) (+dP/dtmax/P, где Р — давление в момент достижения максимума +dP/dt). Для характеристики процесса расслабления использовали максимальную скорость снижения давления (–dP/dtmin), а также производный из нее индекс расслабимости по аналогии с ИС. Кроме того, вычисляли константу скорости снижения давления в изоволюмической фазе.
Все сигналы оцифровывали с частотой 1 кГц с помощью аналого-цифрового преобразователя NI-USB-6210 и записывали на жесткий диск компьютера. Для записи и обработки физиологических сигналов были разработаны собственные программы. Детали методики расчета подробно изложены ранее [13].
Все результаты были подвергнуты статистической обработке с применением критерия t Стьюдента и выражены как M±m (среднее значение и средняя ошибка).
Результаты
Состояние крыс. Назначение доксорубицина сразу заметно замедляло естественный набор массы тела. Она медленно нарастала до 4—5-й недели, а потом уменьшалась. В конт-рольной группе через 8 нед масса тела возрастала на 30%, а в двух группах, получавших доксорубицин, она снизилась через 8 нед на 10—15% по сравнению с исходной. В этих группах смертность через 8 нед составила 19%, через 10 нед — 27%.

ЭхоКГ. В первой серии опытов в течение 10 нед было выполнено 10 инъекций доксорубицина. ФВ у этих животных через 11—12 нед была равна 65±4%, в контрольных опытах 86±1%. Еще большее снижение ФВ отмечено через 20 нед, т.е. через 10 нед после прекращения инъекций (табл. 1). Эти животные значительно отставали в прибавке массы тела — их масса составляла 321±15 г против 402±6 г в контроле (снижение на 21%; p<0,01). Частота сердечных сокращений (ЧСС) мало различалась (391±11 и 413±14 мин–1 соответственно). Величина минутного объема (МО) через 20 нед осталась прежней за счет увеличенной дилатации ЛЖ, несмотря на значительное снижение ФВ. Наряду со снижением ФВ отмечено снижение более чем в 2 раза степени уменьшения площади ЛЖ в систоле. Толщина задней стенки ЛЖ в диастоле осталась практически прежней, но степень утолщения стенки в систоле уменьшилась почти в 3 раза. Следовательно, значительное снижение сократимости ЛЖ было в значительной мере компенсировано дилатацией ЛЖ.
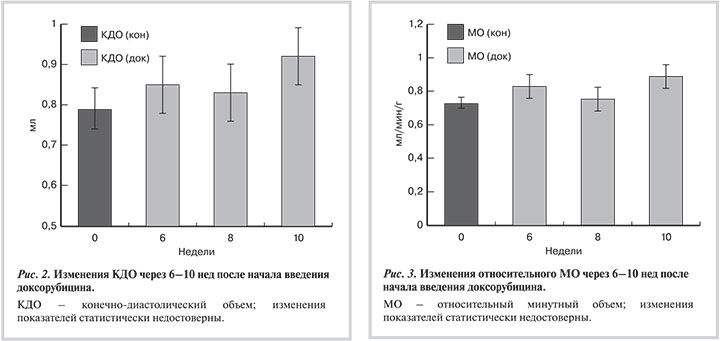
В связи с высокой смертностью после 10 инъекций доксорубицина (44%) в дальнейшем мы ограничивались максимум 8 инъекциями. Динамика изменений структурных и функциональных показателей сердца в разные сроки после начала введения доксорубицина представлена на рис. 1. Видно, что снижение ФВ неуклонно прогрессирует по мере увеличения срока с начала введения доксорубицина, одновременно снижается и выживаемость животных. Подобным образом снижаются и другие показатели сократимости ЛЖ — степень уменьшения площади и степень утолщения стенки ЛЖ. Несмотря на значительное снижение ФВ и степени утолщения стенки, величина минутного объема, отнесенная к единице массы тела, сохранялась постоянной в течение 8 нед и только через 10 нед обнаружила тенденцию к увеличению, как и диастолический размер ЛЖ (рис. 2, 3).
Катетеризация ЛЖ и аорты выполнена в острых опытах также в различные сроки после начала инъекций доксорубицина — через 7 нед (4 инъекции), 9, 11 и 13 нед (8 инъекций). При вскрытии грудной и брюшной полостей примерно у 50% животных был найден асцит, а у 1/3 крыс — гидроторакс. У получавших доксорубицин животных ЧСС и АД на любом сроке имели явную тенденцию к снижению, соответственно снижению АД уменьшалось и систолическое давление в ЛЖ. Эти величины достоверно снижались, начиная с 9 нед. Еще более отчетливо снижалась максимальная скорость развития давления, а реципрокный к нему индекс — время предизгнания — неуклонно увеличивался. Увеличивалось также время систолы. Эти 3 последних показателя были достоверно изменены уже через 7 нед. При этом степень увеличения времени предизгнания на протяжении 11 нед возрастала больше, чем общая длительность систолы — их соотношение возрастало с 14,4% в контроле до 18%, что также свидетельствует о снижении сократимости миокарда.
Отчетливо реагировали и миокардиальные показатели. Все они достоверно снижались уже через 7 нед, и это неуклонное снижение прогрессировало вместе с увеличением срока. Через 13 нед ИС был снижен почти в 2 раза, а константа расслабления (КР) — еще больше. Следует отметить, что с увеличением срока относительное снижение КР было глубже по сравнению с ИС. Так, соотношение КР/ИС через 11—13 нед достоверно снижалось на 25%. Это свидетельствует о более глубоком нарушении процесса расслабления по сравнению с процессом сокращения.
Для 10 животных, у которых функция сердца была исследована при ЭхоКГ и катетеризации, оказалось возможным рассчитать корреляцию между гемодинамическими и миокардиальными показателями (табл. 2). Корреляция ФВ с миокардиальными показателями оказалась умеренной и отрицательной (–0,53 и –0,68), а корреляция между миокардиальными показателями высокой. Так, оба показателя, характеризующих время электромеханической и механической систолы, коррелируют обратно с ИС (–0,89), что указывает на их высокую ценность. Аналогичная корреляция наблюдается и для КР. Отмечена высокая положительная корреляция между КР и ИС (0,89).
Обсуждение
Динамическое наблюдение за состоянием сердца в процессе формирования хронической СН под влиянием доксорубицина позволило установить следующее: 1) ФВ, а также другие показатели сократимости ЛЖ, характеризующие систолическую дисфункцию, снижаются пропорционально сроку действия доксорубицина, но дилатация ЛЖ развивается постепенно — даже через 10 нед увеличение диастолического объема ЛЖ недостоверно, и только через 20 нед он увеличен на 59%; 2) раньше других реагируют миокардиальные показатели, характеризующие расслабимость и сократимость, причем ухудшение расслабимости по степени превышает снижение сократимости. Гемодинамические показатели (давление в ЛЖ, ЧСС) снижаются позже, когда индексы сократимости и расслабимости снижаются на 40—46% (табл. 3). Эти данные свидетельствуют о первичном нарушении сократимости и расслабимости миокарда под влиянием доксорубицина. Именно они определяют неуклонное снижение ФВ и рост конечного диастолического давления в ЛЖ.
Позднее появление дилатации ЛЖ при относительно раннем развитии систолической дисфункции отмечено также при введении доксорубицина крысам по несколько более жесткой схеме — по 3 мг/кг в течение 6 нед, смертность при этом составила 50% [11]. Через 8 нед у выживших крыс ФВ уменьшилась на 27%, но при этом размер ЛЖ уменьшился только в систоле, но не в диастоле, т.е. дилатация отсутствовала. Отсутствие дилатации при заметном снижении фракции изгнания свидетельствует о мобилизации компенсаторных механизмов, реализуемых на различном уровне. На уровне сердца — относительно медленное развитие процесса, обусловленное еженедельными инъекциями доксорубицина, позволяет в промежутках мобилизовать механизмы репарации миокарда на клеточном и тканевом уровне [14], а именно, восстановление белков цитоскелета [15], повышение диастолической упругости ЛЖ и тонуса коронарных сосудов [16], восстановление уровня антиоксидантной защиты [17]. Конечно, на фоне продолжающихся инъекций доксорубицина степень репарации неизбежно снижается. Облегчение выброса может быть достигнуто за счет снижения периферического сопротивления, в пользу которого косвенным аргументом может служить неуклонное снижение АД (см. табл. 3). Сниженная ЧСС также может вносить вклад, увеличивая время диастолы и тем самым наполнение ЛЖ. В результате МО, отнесенный к единице массы крысы, держался в пределах, близких к контрольному уровню, а дилатация ЛЖ начинала формироваться только после 10 нед с начала действия доксорубицина, когда ФВ снизилась на 23%, а другие показатели сократимости ЛЖ — на 33—38%. На уровне организма — это снижение естественного прироста массы. Через 8 нед масса животных, получавших доксорубицин, была меньше контрольной на 16%, а через 10 нед — на 40%. Уменьшение количества кровоснабжаемых тканей естественно снижает и уровень необходимого МО. Таким образом, все эти, а вероятно, и другие компенсаторные механизмы задерживают мобилизацию последнего резерва — дилатацию ЛЖ.

Катетеризация ЛЖ позволила установить, что показатели сократимости и расслабимости миокарда снижаются раньше, чем гемодинамические показатели ЛЖ. Это согласуется с установившимся мнением, что мишенью доксорубицина в сердце являются кардиомиоциты. Сразу после введения концентрация доксорубицина в миокарде в 50 раз выше, чем в плазме, и даже после однократного введения он обнаруживается в миокарде через 3 нед [18]. Одновременное и пропорциональное снижение показателей сократимости и расслабимости миокарда неудивительно ввиду тесной связи между фазами систолы и диастолы, чему еще одним подтверждением является тесная корреляция между ними.
Преимущественное снижение расслабимости миокарда по сравнению с сократимостью объясняется тем, что величина сокращения миофибрилл зависит от количества ионов Са2+, выделившихся из саркоплазматической сети, а оно определяется тем количеством, которое было поглощено из миоплазмы при расслаблении. Следовательно, именно скорость расслабления может определять последующую скорость и величину сокращения. Очень тесная корреляция между КР и ИС (0,89; см. табл. 2) соответствует такому представлению. Эта ситуация характерна для действия на миокард многих естественных или патологических факторов [19]. Непосредственное сопоставление инвазивных и эхокардиографических данных в исследовании с участием 85 пациентов показало высокую корреляцию пикового наполнения ЛЖ с константой изоволюмического расслабления (r=0,80) и максимальной скоростью снижения давления в ЛЖ (r=–0,64), авторы заключили, что константа изоволюмического расслабления является главным фактором пикового наполнения ЛЖ [20].
Клинические данные об изменениях процессов сокращения и расслабления под влиянием доксорубицина вполне соответствуют такому заключению. В исследовании с участием 125 детей, получавших доксорубицин в различных дозах, уже при минимальных его дозах отмечено снижение отношения Е/А и удлинение времени изоволюмического расслабления при еще неизменном фракционном укорочении [21]. Аналогичный вывод был сделан в исследовании с участием получивших дозу доксорубицина менее 300 мг/м2 56 пациентов без клинических проявлений [22]. В работе на крысах (введение доксорубицина по 2,5 мг/кг в течение 10—12 нед) снижение фракционного укорочения было отмечено только после 12 нед, в то время как диастола была нарушена после 10 нед [10]. В исследовании с участием 58 пациентов, получивших разные дозы доксорубицина (139 и 308 мг/м2), выявлено, что максимальная скорость наполнения ЛЖ уже снижена у больных с меньшей дозировкой доксорубицина, она снижается еще в большей степени при повышенной дозировке, когда присоединяются признаки систолической дисфункции — снижение ФВ и максимальной скорости изгнания [23]. Авторы заключили, что диастолическая дисфункция возникает раньше систолической. С таким заключением согласуются и результаты более поздних работ [24, 25].
Заключение
Результаты показали, что постепенное формирование сердечной недостаточности позволяет мобилизовать разнообразные компенсаторные механизмы, задерживающие развитие дилатации сердца; развитие систолической дисфункции протекает с преимущественным нарушением процесса расслабления; удлинение периодов предизгнания и систолы при неинвазивном исследовании может служить показателем формирования систолической дисфункции.



