Сердце является одной из основных мишеней для токсического действия алкоголя. Обследование 251 пациента с диагнозом «алкогольная зависимость II—III стадии» выявило симптомы патологии сердца у 70%, а диагнозу «алкогольной кардиомиопатии» (АКМП) соответствовали 25% пациентов [1]. Признаки алкогольного поражения сердца обнаруживают у 10—35% лиц, умерших внезапной смертью. Классическая АКМП относится к категории дилатационных и сопровождается пароксизмальной или постоянной фибрилляцией предсердий с признаками недостаточности кровообращения. Прогрессирование АКМП приводит к хронической сердечной недостаточности (ХСН).
Согласно современным представлениям ХСН прогрессирует в результате активации нейрогормонов и выделения цитокинов в ответ на первичное повреждение миокарда [2]. Наиболее важными для развития ХСН считают провоспалительные цитокины: α-фактор некроза опухоли (TNF-α), интерлейкин (IL) 1, IL-6. Они секретируются главным образом мононуклеарными фагоцитами, однако могут вырабатываться и клетками миокарда. Предложена гипотеза, согласно которой отек стенки кишечника при ХСН способствует перемещению бактериального эндотоксина в сосуды слизистой оболочки, что приводит к усилению продукции моноцитами провоспалительных цитокинов в общем кровотоке и различных тканях [3]. Злоупотребление алкоголем является дополнительным фактором, повышающим проницаемость стенки кишечника для бактериальных токсинов, включая липополисахариды. Показано усиление продукции IL-6 в периферических тканях на фоне сердечной недостаточности (СН) при сравнении его концентрации в артериальной и венозной крови [4]. У больных с ХСН в крови может возрастать содержание растворимого СD14 — маркера взаимодействия между клетками и эндотоксином [3].
В крови больных с ХСН со периферическими отеками концентрация эндотоксина повышена, но снижается при терапии диуретиками [5]. Эндотоксин является одним из наиболее мощных стимуляторов продукции TNF-α и других провоспалительных медиаторов. TNF-α в свою очередь считают одним из наиболее важных факторов дисфункции и ремоделирования левого желудочка (ЛЖ), усиленного апоптоза кардиомиоцитов, анорексии и кахексии, снижения кровотока в ткани скелетной мускулатуры и дисфункции эндотелия, а также резистентности к инсулину при СН [1, 6]. Системное введение крысам TNF-α в концентрациях, сопоставимых с теми, что обнаруживают у больных с ХСН, приводит к изменениям в ткани сердца, которые имеют признаки кардиомиопатии при СН [7]. При этом гиперэкспрессия TNF-α в кардиомиоцитах способствует развитию фенотипа сердца, имитирующего отдельные аспекты ХСН, такие как гипертрофия, дилатация желудочков, фиброз, дисфункция клеток [8]. IL-6, концентрация которого возрастает у больных с ХСН, может вызывать гипертрофию миоцитов, дисфункцию миокарда и атрофию скелетных мышц [9]. У генно-модифицированных мышей показана связь IL-6 и его рецепторной субъединицы gp130 с СН [10]. Системное введение крысам IL-6 приводит к концентрической гипертрофии ЛЖ, накоплению коллагена в интерстициальной ткани сердца и повышенной упругости миокарда [11]. Кроме того, в эксперименте показано, что IL-18 повышает экспрессию и образование остеопонтина, который стимулирует фиброз интерстициальной ткани миокарда, а также трансформирующего β1-фактора роста (TGF-β1), усиливающего синтез коллагена и угнетающего активность матриксных металлопротеиназ [12]. Повышенный синтез и пониженная деградация коллагена, а также увеличение активности лизилоксидазы-1, вызывающей образование межмолекулярных сшивок и формирование нерастворимой коллагеновой сети, могут со временем привести к диастолической дисфункции сердца.
В ткани миокарда больных с идиопатической дилатационной кардиомиопатией выявляется IL-1. Кардиотропные эффекты IL-1 включают угнетение сократимости миокарда, стимуляцию апоптоза и гипертрофии миокарда, а также аритмогенный эффект.

Провоспалительные цитокины могут изменять функции миокарда посредством ряда механизмов, включающих стимуляцию гипертрофии и фиброза при прямом действии на кардиомиоциты и фибробласты, угнетения сократимости миокарда за счет влияний на внутриклеточный транспорт Са2+ и передачу сигнала через β-адренорецепторы, индукцию апоптоза и стимуляцию генов, участвующих в ремоделировании миокарда [13]. Непрямой эффект провоспалительных медиаторов в патогенезе ХСН может состоять в угнетении костномозгового кроветворения с развитием анемии, неадекватной активации эндотелия и угнетения сократимости скелетной мускулатуры.
Классический маркер острого воспаления и ответа острой фазы — С-реактивный белок (СРБ) — исследовали у 188 пациентов с идиопатической дилатационной кардиомиопатией [14]. У всех из них фракция выброса (ФВ) ЛЖ была снижена на 40% или больше. Ряд пациентов умерли в течение 5-летнего периода наблюдения, причем в этой группе концентрация СРБ по сравнению с теми, кто выжил, была существенно выше. В большой группе из 4202 пациентов с СН показано, что повышенные уровни СРБ коррелируют с тяжестью симптомов и неблагоприятным исходом болезни [15].
Противовоспалительный цитокин IL-10 уменьшает продукцию TNF-α, IL-1 и IL-6 в стимулированных липополисахаридом моноцитах больных с СН [16]. Концентрация IL-10 в плазме крови больных с ХСН может варьировать в разных направлениях по сравнению со средним значением у здоровых людей, однако внутривенное введение иммуноглобулина-40 пациентам с ХСН увеличивало содержание IL-10 в плазме крови и способствовало увеличению ФВ [17].
Профибротический и противовоспалительный цитокин TGF-β1 может играть существенную роль в регуляции функции фибробластов и ремоделировании внеклеточного матрикса при ХСН. Угнетение эффектов TGF-β1 на поздней стадии экспериментального инфаркта миокарда уменьшало дилатацию ЛЖ и сократительную дисфункцию, обусловленную гипертрофией кардиомиоцитов и интерстициальным фиброзом [18].
Таким образом, при ХСН стимулируется образование ряда провоспалительных цитокинов — TNF-α, IL-6, IL-1β и др., которые могут служить предикторами тяжести состояния больного. С той же целью, как предполагается, можно использовать и соответствующие растворимые рецепторы цитокинов. Концентрация растворимых рецепторов для TNF-α (s-TNF-R) и ряда других членов TNF-рецепторного семейства, таких как CD27, Fas и остеопротегерин, в норме значительно выше, чем самих лигандов, и еще больше возрастает при СН [19].
Хроническое злоупотребление алкоголем вызывает значительный дисбаланс про- и противовоспалительных цитокинов с преобладанием провоспалительных типов. Этот дисбаланс часто усугубляется сопутствующей алкогольной болезнью печени [20]. В настоящей работе проведено сравнительное исследование содержания провоспалительных цитокинов, биомаркеров воспалительного процесса, плазменных маркеров СН и гемодинамических параметров у больных с сердечной недостаточностью на фоне АКМП и ишемической болезни сердца.

Материал и методы
Всего обследованы 62 пациента мужского пола с клинической картиной СН III—IV функционального класса по классификации NYHA. Возрастной диапазон обследованных составил от 35 до 70 лет, средний возраст — 56,8±8,2 года.
Злоупотребление алкоголем устанавливали со слов пациентов или с помощью опросника CAGE, а также по наличию клинических и лабораторных признаков хронической алкогольной интоксикации. Из исследования исключали больных с лихорадкой, с наличием в анамнезе инфаркта миокарда, пороков сердца и диффузных заболеваний соединительной ткани. Помимо основной группы в исследование была включена группа сравнения, в которую вошли 17 больных ИБС с диагнозом «постинфарктный кардиосклероз» и клинической картиной СН III—IV функционального класса. Средний возраст пациентов группы сравнения составил 59,4±7,2 годы.
Эхокардиографию выполняли по стандартной методике на аппарате Vivid 7 («GE Health care», США). Среди параметров центральной гемодинамики рассчитывали следующие показатели: ФВ ЛЖ, конечный диастолический размер (КДР) ЛЖ, конечный систолический размер (КСР) ЛЖ, размер левого предсердия (ЛП), правого предсердия (ПП), правого желудочка (ПЖ), толщину межжелудочковой перегородки (ТМЖП) и толщину задней стенки (ТЗС) ЛЖ, давление в легочной артерии, индекс массы миокарда (ИММ) ЛЖ. Критерием гипертрофии ЛЖ считали ИММЛЖ >125 г/м2. Относительную толщину стенки (ОТС) ЛЖ рассчитывали как отношение суммы ТМЖП и ТЗСЛЖ к КДР.
Содержание цитокинов (IL-6, IL-8, IL-12) определяли методом твердофазного иммуноферментного анализа с использованием соответствующих реагентов; TGF-β1, TNF-α, s-TNF-R, а также СРБ — с использованием наборов. Определяли мозговой натрийуретический пептид. Уровень бактериального эндотоксина определяли в сыворотке крови с использованием хромогенного LAL-теста фирмы.
Статистический анализ данных настоящего исследования проводили с помощью пакета прикладных статистических программ Statistica 8.0.

Результаты и обсуждение
В табл. 1 приведены средние значения гемодинамических и морфофункциональных показателей сердца в общей группе больных АКМП и ИБС. Обращает внимание значительное снижение ФВ, свидетельствующее о СН и сочетающееся с характерными жалобами, отражающими нарушение функции сердечно-сосудистой системы: одышка при нагрузке и в горизонтальном положении, отеки нижних конечностей, тяжесть в правом подреберье, сердцебиение, ощущение перебоев в работе сердца. Следует отметить дилатацию всех камер сердца в обеих группах больных, более выраженную при АКМП. Размеры ЛП, ПП, ПЖ, а также КДР у больных АКМП достоверно на 9—27% выше, чем у больных ИБС. ИММЛЖ, отражающий величину гипертрофии ЛЖ, значительно увеличен у больных как АКМП, так и ИБС. При этом ОТС ЛЖ не выходит за пределы нормы, а у больных АКМП достоверно меньше, чем в группе ИБС. Это свидетельствует об эксцентрическом характере гипертрофии. Следует отметить существенное повышение давления в легочной артерии, особенно у больных АКМП, по-видимому, связанное с рефлекторным спазмом артериол в малом круге кровообращения в ответ на венозный застой крови.
В табл. 2 сравниваются гемодинамические показатели в группах больных АКМП и ИБС в зависимости от класса NYHA. Повышение класса NYHA сочетается со снижением ФВ (на 15%) и увеличением КДР, КСР и ПЖ (соответственно на 8, 12 и 17%) у больных АКМП, а у больных ИБС существенно увеличивается размер предсердий (на 31—33%). Следует также отметить, что межгрупповые различия показателей у больных IV ФК СН по NYHA достоверны только для ПЖ и среднего давления в легочной артерии. У больных с ХСН III ФК по NYHA имеются также различия между группами по размерам ЛП, КДР, ПП и ОТС, причем характер изменений свидетельствует о более выраженных морфофункциональных сдвигах в сердце при АКМП по сравнению с ИБС.
Биохимические показатели крови у больных ИБС соответствуют норме за исключением повышенной активности γ-глутамилтранспептидазы — ГГТП (табл. 3). Для больных АКМП характерно повышение маркеров злоупотребления алкоголем: аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), ГГТП, щелочной фосфатазы (ЩФ). Кроме того, в данной группе повышено содержание в крови общего билирубина, главным образом за счет конъюгированной фракции, что наряду с повышением активности ГГТП и ЩФ свидетельствует о холестазе. Несмотря на нормальные концентрации общего белка и альбумина в плазме крови больных АКМП, снижение протромбинового индекса и повышение международного нормализованного отношения указывают на дефицит факторов коагуляции, что свидетельствует об умеренном снижении белоксинтетической функции печени.
В плазме крови больных ИБС выявляется существенное количество эндотоксина (см. табл. 3) в соответствии с представлением о повышенной проницаемости кишечника при ХСН. Злоупотребление алкоголем является дополнительным фактором усиленного проникновения эндотоксина через стенку кишечника, о чем свидетельствует увеличение его концентрации у больных АКМП в 3 раза по сравнению с таковой у больных ИБС.
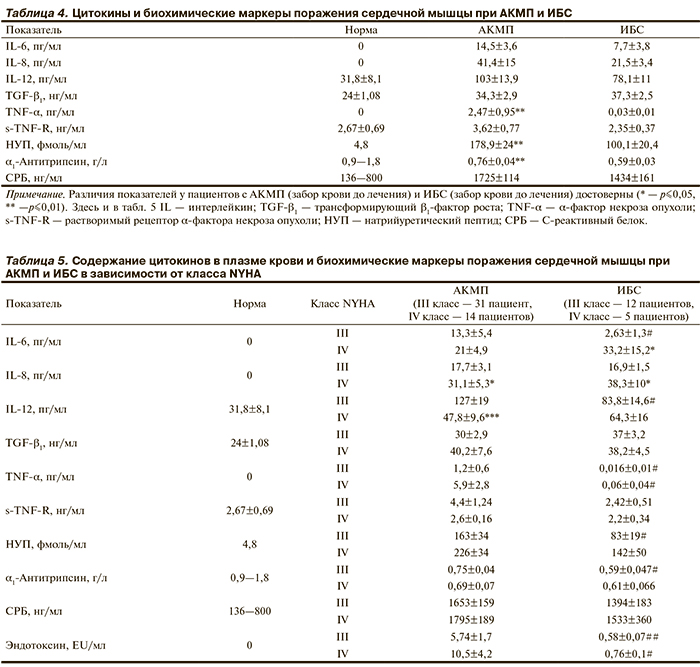
Концентрация в крови провоспалительных цитокинов IL-6, IL-8, IL-12, TNF-α и его растворимого рецептора s-TNF-R существенно повышается при АКМП (табл. 4). Это согласуется с двукратным увеличением концентрации фактора острой фазы воспаления — СРБ, но не α1-антитрипсина. Кроме того, в крови больных АКМП многократно возрастает концентрация маркера СН НУП. В группе больных ИБС также увеличены концентрации провоспалительных цитокинов IL-6, IL-8 и IL-12, но величины их в 1,5—2,0 раза ниже, чем в группе АКМП, а содержание в крови TNF-α и его растворимого рецептора s-TNF-R не отличается от нормы. Интенсивность общей воспалительной реакции, на основании содержания в крови СРБ и α1-антитрипсина, менее выражена у больных ИБС. Кроме того, у последних в меньшей степени увеличивается концентрация маркера поражения сердечной мышцы НУП. Разделение больных АКМП на подгруппы по классу NYHA позволило выявить более высокий прирост концентрации IL-6, IL-8,TNF-α и мозгового НУП, а также эндотоксина с увеличением тяжести СН (табл. 5). Сходные по характеру изменений результаты получены при сравнении больных с ХСН III и IV ФК на фоне ИБС, однако повышение концентрации в крови TNF-α, НУП и эндотоксина у больных с ХСН IV ФК было недостоверным. В обеих группах содержание IL-12, s-TNF-R, TGF-β1 и факторов острой фазы воспаления не отражает тяжесть проявлений СН.
Анализ результатов позволяет сделать вывод, что среди всех исследованных факторов содержание в плазме крови IL-6 в наибольшей степени отражает функциональную недостаточность миокарда у больных ИБС. Концентрация IL-6 в этой группе высоко и достоверно (p≤ 0,01) коррелирует с размерами ЛП (r=0,63), ПП (r=0,69) и ПЖ (r=0,72). Однако у больных АКМП корреляция со структурными параметрами сердца не выявляется. IL-6 — один из наиболее важных факторов острого воспаления, вырабатывается не только лимфоцитами и клетками моноцитарно-макрофагальной линии, но также эндотелием, гладкими мышечными клетками и ишемизированными кардиомиоцитами. Имеются сообщения, что концентрация IL-6 отрицательно коррелирует с ФВ ЛЖ и положительно — с величиной сосудистого сопротивления в системе легочной артерии [21]. Повышенные уровни IL-6 в плазме являются предикторами смерти больных ХСН в течение 24 мес [22].
Отсутствие корреляции между геометрическими параметрами сердца, обусловленными функциональной недостаточностью, и содержанием в крови IL-6 у больных АКМП свидетельствует о том, что патологические изменения в сердце не являются единственным фактором, определяющим секрецию IL-6. Мощным активатором экспрессии фагоцитами IL-6, TNF-α и других воспалительных цитокинов служит эндотоксин. У больных алкоголизмом существенно возрастает всасывание эндотоксина в кишечнике, о чем свидетельствует значительно более высокая концентрация этого бактериального продукта у больных АКМП по сравнению с таковой при ИБС (см. табл. 5). На экспериментальной модели показано, что при регулярном многократном воздействии этанола макрофаги увеличивают экспрессию ко-стимулирующих молекул CD80 и CD86, а также секрецию воспалительных цитокинов под воздействием эндотоксина [23]. Нами обнаружена корреляция средней силы между содержанием в крови TNF-α и эндотоксина (r=0,53) в группе с АКМП, но не ИБС. В то же время со структурными и функциональными параметрами сердца концентрация TNF-α и его растворимого рецептора s-TNF-R не коррелировала. Таким образом, при АКМП IL-6 и другие провоспалительные цитокины не могут служить надежным маркером СН, так как их суммарная продукция связана не только с функциональным дефицитом миокарда, но и динамикой алкогольного поражения печени. Нами показано, что у больных с алкогольной болезнью печени имеется последовательное и многократное возрастание содержания в плазме IL-2, IL-6, IL-8, IL-10 при прогрессировании патологии от алкогольного гепатита к циррозу печени и к циррозу печени с приступом острого гепатита [20].
Белки острой фазы воспаления в данном исследовании демонстрируют слабую связь с морфофункциональными параметрами сердца и классом ХСН. Концентрация в крови α1-антитрипсина остается в пределах нормы в обеих группах больных с ХСН. При этом содержание СРБ существенно увеличивается у больных АКМП и в меньшей степени при ИБС. Однако концентрация СРБ в крови не различается у больных ХСН III и IV ФК в обеих исследованных группах и, кроме того, не коррелирует с геометрическими и функциональными параметрами сердца.
Наиболее надежным маркером СН у больных АКМП представляется мозговой НУП, концентрация которого в крови отрицательно коррелирует с ФВ (r= –0,43). Подобная корреляция не обнаружена нами у больных ИБС. Продукция НУП возрастает на ранней стадии ХСН, что обусловлено повышенной нагрузкой на стенку камер сердца и последующей дилатацией предсердий. Имеются сообщения, что увеличение в крови концентрации мозгового НУП определяет прогноз СН, положительно коррелирует с ее стадией по классификации NYHA, величиной внутрижелудочкового давления, повышенным давлением в легочной артерии и отрицательно коррелирует с сердечным выбросом [24]. Высокую прогностическую ценность имеет и определение концентрации неактивного N-концевого фрагмента мозгового НУП (NT-proBNP), которая коррелирует с риском повторной госпитализации и смерти в течение 6 мес после выписки из больницы пациентов с декомпенсированной СН [25].
Интенсивное образование IL-6, IL-12 и TNF-α при АКМП в сочетании с повышенными концентрациями эндотоксина в крови создают условия для развития аутоиммунного миокардита. IL-6 считается важным медиатором воспалительного ответа при ряде аутоиммунных заболеваний, таких как ревматоидный артрит [26], а также при моделировании аутоиммунного миокардита. Мыши, у которых имеется дефект образования IL-6, резистентны к аутоиммунному миокардиту, инициируемому вирусной инфекцией [27]. Роль IL-6 в аутоиммунных реакциях обусловлена его эффектами, включающими усиленную дифференциацию лимфоцитов Тh17, а также повышенное выживание и пролиферацию эффекторных Т-лимфоцитов и клеток памяти [28]. Аналогично аутоиммунный миокардит не развивается у трансгенных мышей с дефектом рецептора для IL-12 [29] или при блокировании цитокинов IL-1 и TNF-α [30]. Эндотоксин оказывает адъювантное действие при аутоиммунных процессах. Введение эндотоксина резистентным к аутоиммунному миокардиту мышам линии В10.А, которых инфицировали вирусом Коксаки В3, приводило к тяжелой лимфоцитарной инфильтрации миокарда, некрозу кардиомиоцитов и усиленной экспрессии на их поверхности антигенов HLA класса II [31].
Вывод
Таким образом, факторы, вызывающие поражение миокарда и развитие сердечной недостаточности, активируют иммунные механизмы, связанные с усиленной продукцией провоспалительных цитокинов и факторов острой воспалительной реакции. Вначале такая реакция может носить адаптивный характер, но в последующем приобретает все более патогенный характер, способствующий прогрессирующему снижению насосной функции сердца. Знание тонких механизмов нарушения иммунитета у больных с хронической сердечной недостаточностью позволит разработать новые терапевтические стратегии для поддержания сократительной способности миокарда и угнетения апоптоза кардиомиоцитов.
Работа выполнена при поддержке гранта РГНФ № 13-06-00279.



