Гипертрофическая кардиомиопатия (ГКМП) представляет собой наследственное заболевание сердечной мышцы, характеризующееся выраженной гипертрофией преимущественно левого желудочка (ЛЖ) без признаков другой патологии сердца или системных заболеваний, ответственных за развитие гипертрофии [1—4]. В среднем распространенность ГКМП составляет 1 случай на 500 человек [1, 5]. Спустя 50 лет интенсивных изучений стало очевидным, что ГКМП является гетерогенным и непредсказуемым заболеванием в отношении клинических проявлений и естественного течения [2, 3, 6].
Основными причинами смертности при ГКМП служат внезапная сердечная смерть (ВСС), сердечная недостаточность (СН) и тромбоэмболические осложнения [7]. По данным ранних исследований, проведенных на небольших группах больных из специализированных центров, смертность от сердечно-сосудистых заболеваний (ССЗ) среди лиц, страдавших ГКМП, составляла примерно 6% в год. Однако в более поздних работах, основанных на обследовании амбулаторных больных, отмечено более благоприятное клиническое течение заболевания, при этом общая смертность от ССЗ оценивалась примерно 2% в год [7]. По современным оценкам, ВСС регистрируется с частотой около 0,8% в год, достигая максимального значения у молодых лиц [5, 8].
До недавнего времени практически отсутствовали эффективные меры для предотвращения ВСС. Вместе с тем последние данные свидетельствуют, что имплантируемые кардиовертеры-дефибрилляторы (ИКД) могут предупреждать ВСС, в связи с чем появилась необходимость выявлять и стратифицировать пациентов, имеющих высокий риск такой смерти [9]. Кроме того, с наступлением «эры ИКД» появилась возможность выявления более достоверных факторов риска (ФР) развития этого трагического исхода [5, 10—17].
Представленный обзор посвящен вопросам эпидемиологии ВСС при ГКМП, патогенеза опасных для жизни тахиаритмий, идентификации больных, имеющих высокую вероятность фатальных событий. Особое внимание уделено проблемам предупреждения трагических эпизодов, в частности оценке роли ИКД.
Эпидемиология. ВСС во многих случаях является первым и единственным симптомом патологии сердца. Ежегодная частота ВСС в США по разным сообщениям варьируется от 300 000 до 350 000 случаев в год [18, 19]. Существенный разброс значений обусловлен, в частности различными ресурсами данных, разнообразием определений «ВСС» и критериев установления самого случая, неоднородностью методов оценки результатов [19]. Данные о наиболее частых причинах, ответственных за ВСС, значительно разнятся и зависят, главным образом, от возрастной категории, пола жертв, их физической активности, географической зоны проживания и других факторов. При исследовании причин ВСС у детей и лиц молодого возраста частота выявления ГКМП, по результатам аутопсий, варьируется от 7 до 25% (табл. 1).
ГКМП — наиболее частая причина ВСС у тренированных спортсменов [2, 3, 5, 13—16, 27], и ее доля среди всех причин составляет от 35 до 50% (рис. 1, см. цветную вклейку) [7]. Реже эту форму кардиомиопатии находят на аутопсии молодых военнослужащих, умерших внезапно во время выполнения интенсивных физических нагрузок, что свидетельствует о специфической связи между ВСС и гипертрофией миокарда у лиц, занимающихся спортом [21, 29].
В рапорте Национального центра по изучению катастрофических спортивных повреждений за 10-летний период F. Mueller и соавт. идентифицировали 56 случаев явной или вероятной ГКМП, послужившей причиной внезапной смерти молодых спортсменов [28]. При этом 55 трагедий произошло у юношей и лишь одна — у девушки. B. Maron и соавт. обнаружили, что из 48 случаев ВСС среди молодых спортсменов, страдавших ГКМП, лишь 2 произошли у женщин [5]. Полученные результаты резко контрастируют с клиническими характеристиками больных ГКМП, свидетельствующие об отсутствии половой предрасположенности к этому заболеванию [1].
Среди людей, перенесших остановку сердца или ВСС во время занятий спортом, существенно преобладают также лица мужского пола. В течение 5-летнего периода изучения 820 лиц с установленным фактом остановки сердца в возрасте от 15 до 75 лет во время умеренных или интенсивных занятий спортом женщин было лишь 43 (5,2%) [30].
 Интересными представляются наблюдения, свидетельствующие о низкой частоте ВСС среди юных спортсменов (младше 13 лет), хотя в этом возрасте число детей, занимающихся различными видами спорта, достаточно велико. При этом у детей регистрируется как ГКМП, так и ВСС. Полагают, что занятия спортом у детей младшей возрастной группы связаны с меньшим гипертрофическим ответом миокарда на физические нагрузки; вероятно, это и является причиной редких случаев трагического исхода у детей, страдающих ГКМП [29].
Интересными представляются наблюдения, свидетельствующие о низкой частоте ВСС среди юных спортсменов (младше 13 лет), хотя в этом возрасте число детей, занимающихся различными видами спорта, достаточно велико. При этом у детей регистрируется как ГКМП, так и ВСС. Полагают, что занятия спортом у детей младшей возрастной группы связаны с меньшим гипертрофическим ответом миокарда на физические нагрузки; вероятно, это и является причиной редких случаев трагического исхода у детей, страдающих ГКМП [29].
Выраженная предрасположенность юношей-спортсменов с ГКМП к ВСС, особенно при физической нагрузке, предполагает существенную роль андрогенной стимуляции в инициации событий. Анаболические эффекты тестостерона и его аналогов, оказываемые на мышечную ткань, хорошо изучены, а экспериментальные исследования на животных подтвердили влияние андрогенов на кардиомиоциты (КМЦ), характеризующееся, в частности клеточной гипертрофией, увеличением специфичной активности цитохромоксидазы [31].
Факторы, тесно связанные с риском ВСС при ГКМП во время занятия спортом, являются нетипичными для этого заболевания в общей популяции. Полученные данные указывают, что занятия спортом, тренировки, пол, уровень полового созревания и расовые особенности в целом оказывают влияние на эти события, хотя не выявлено отклонений среди всех больных ГКМП. Каждый из этих факторов обладает скорее одним общим аспектом — установленной связью с гипертрофией ЛЖ. Обсуждая полученные данные, резонно предположить, что большинство случаев ВСС среди спортивной молодежи, вероятно, связаны с фатальными аритмиями при наличии гипертрофированного миокарда вследствие физических перегрузок, а не со скрытой ГКМП как таковой [29]. Кардиомиопатия при этом может рассматриваться лишь как одно из проявлений гипертрофического ответа миокарда, не ограниченного исключительно самой нозологической сущностью.
Таким образом, учитывая сопоставимую заболеваемость ГКМП, схожесть клинических проявлений, характер течения у мужчин и женщин, можно утверждать, что высокая частота ВСС среди тренированных спортсменов, страдающих ГКМП, обусловлена скорее большей выраженностью самой гипертрофии ЛЖ, высоким симпатико-адренергическим и андрогенным воздействием на сердце именно у мужчин.
ВСС при ГКМП происходит без предвестников в основном у молодых пациентов без симптомов или со слабо выраженными симптомами [2, 3, 5, 13, 14, 16, 27, 32]. По данным I. Östman-Smith и соавт., при сравнении частоты ВСС у больных ГКМП по возрастным группам наиболее часто трагические исходы отмечаются в возрасте 8—16 лет, причем самый высокий уровень смертности отмечен в периоде 9—12 лет (9,7% в год), резко снижаясь (до 2,4% в год) в группе 16—19 лет [33].
Несмотря на то что риск ВСС снижается в зрелые и пожилые годы, вплоть до уровня долголетия, как таковой «иммунитет» к развитию внезапного летального исхода не формируется в течение жизни больного [5]. Риск ВСС у больных ГКМП сохраняется в среднем возрасте, однако в меньшей степени и существенно снижается у пациентов старше 60 лет. Снижение удельного веса ВСС как непосредственной причины смертности среди более старшей возрастной категории больных связано, прежде всего, с прогрессирующей гибелью КМЦ, развитием фиброза, что приводит к диастолической и систолической дисфункции. У пожилых больных осложнения и смертность в основном не связаны с ГКМП как таковой, а чаще являются следствием других болезней сердца и некардиальных сопутствующих заболеваний [34].
Аритмогенный субстрат. Имеется множество данных, собранных из архивов электрокардиограмм (ЭКГ), доказывающих, что случаи ВСС при ГКМП происходят вследствие устойчивых желудочковых тахиаритмий (желудочковая тахикардия — ЖТ, фибрилляция желудочков — ФЖ) [10—12, 35]. Нет убедительных фактов о патогенетической роли брадиаритмий при ВСС. Хотя и имеются данные, что атриовентрикулярная блокада высокой степени может приводить к трагическим событиям, однако точный механизм развития ВСС при нарушениях проводимости до конца не известен [36]. Несмотря на то, что пусковые механизмы потенциально летальных тахиаритмий недостаточно изучены, эпизоды синусовой тахикардии все же рассматриваются в качестве инициирующего ритма в части случаев. Это дает возможность предположить, что высокий симпатический тонус выступает в роли аритмогенного фона, отчасти объясняя механизм ВСС у профессиональных спортсменов с ГКМП [29, 37].
Анализ ЭКГ свидетельствует, что большинство желудочковых тахиаритмий возникает на фоне нормального синусового ритма за счет желудочковых экстрасистол [37]. Кроме того, данные, полученные из случайно снятых ЭКГ, свидетельствуют о том, что ФЖ может наступать вследствие пароксизмов ЖТ, тахисистолической формы фибрилляции предсердий (ФП) и даже при синдроме преждевременного возбуждения желудочков [35, 38].

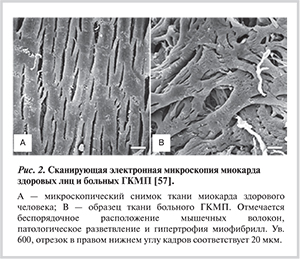
Морфологические изменения, лежащие в основе миокардиального субстрата кардиомиопатии, представлены выраженной разнонаправленностью мышечных волокон, при которой миоциты и миофиламенты располагаются между собой под острыми и прямыми углами, представляя дезорганизованную архитектонику миокарда, что обеспечивает аномальное проведения возбуждения, формируя петлю re-entry (рис. 2) [6, 39, 40].
При ГКМП также отмечается поражение мелких артерий, характеризующееся утолщением мышечного слоя и сужением просвета сосудов. Полагают, что структурно измененные интрамуральные артериолы ответственны за эпизоды безболевой микроваскулярной ишемии миокарда, гибель КМЦ — все это в итоге приводит к замещению фиброзной тканью [6].
При ГКМП часто наблюдается прохождение передней нисходящей КА в толще миокарда межжелудочковой перегородки — так называемый миокардиальный мостик. Так, в патологоанатомическом исследовании C. Basso и соавт. этот феномен обнаружен у 12% больных, страдавших аортальным стенозом, осложненным гипертрофией ЛЖ, и у 41% больных ГКМП, при этом в последней подгруппе внезапно умерли 43% пациентов [41]. Авторы полагают, что такое расположение артерии может приводить к ишемии миокарда и остановке сердца. Особое внимание при этом уделяется патофизиологическим последствиям интрамурального расположения КА, при котором развивается ее постоянная диастолическая компрессия, что уменьшает коронарный кровоток в фазу диастолы и снижает вазодилатирующий резерв.
Высказывается предположение, что дезорганизация структуры миокарда, разрастание фиброзной ткани наряду с увеличением интерстициального матрикса представляют морфологический субстрат, обусловливающий состояние электрической нестабильности миокарда и предрасполагающий к возникновению аритмий по типу re-entry [42].
Кроме того, задержанная постдеполяризация, за счет поступления кальция (Са2+) из саркоплазматической сети, обеспечивает повышенную чувствительность миокарда к пусковым стимулам. Исследования на трансгенных мышах выявили патофизиологическую значимость повышенной чувствительности миофиламентов к Са2+, приводящей к укорочению эффективного рефрактерного периода и увеличенной дисперсии реполяризации, способной формировать функционирующие круги re-entry [43]. Нарушение связывания катионов Са2+ также ингибирует пути физиологической протеолитической деградации и приводит к персистированию протеинов, связывающих Са2+, что так или иначе обусловливают электрофизиологическую дисфункцию КМЦ [44].
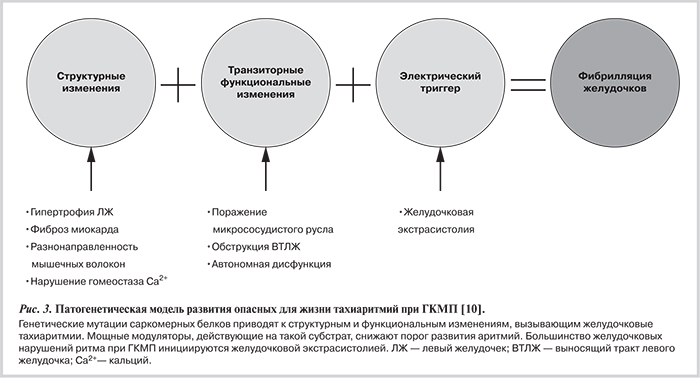
 Несмотря на указанные морфологические изменения и нарушения электрофизиологических процессов, как отмечалось выше, частота ВСС при этом заболевании относительно низкая. Возможно, что желудочковые аритмии развиваются лишь в случае, если аритмогенный субстрат становится «созревшим» благодаря транзиторным патофизиологическим факторам, таким как ишемия миокарда и обструкция выносящего тракта ЛЖ (ВТЛЖ, рис. 3). Более точное понимание аритмогенного субстрата и его модуляторов имеет, таким образом, решающее значение в идентификации восприимчивых больных и разработке критериев стратификации риска ВСС [9].
Несмотря на указанные морфологические изменения и нарушения электрофизиологических процессов, как отмечалось выше, частота ВСС при этом заболевании относительно низкая. Возможно, что желудочковые аритмии развиваются лишь в случае, если аритмогенный субстрат становится «созревшим» благодаря транзиторным патофизиологическим факторам, таким как ишемия миокарда и обструкция выносящего тракта ЛЖ (ВТЛЖ, рис. 3). Более точное понимание аритмогенного субстрата и его модуляторов имеет, таким образом, решающее значение в идентификации восприимчивых больных и разработке критериев стратификации риска ВСС [9].
Выявление больных, имеющих высокий риск ВСС. Первым шагом в предупреждении ВСС является выявление лиц, имеющих достаточно высокий риск ее наступления, для оправданного применения профилактических мероприятий. Необходимость своевременного выявления лиц с высоким риском приобрела особую важность в связи с доступностью и доказанной эффективностью ИКД в предотвращении ВСС. Модель первичной профилактики, основанная на оценке неинвазивных клинических маркеров (наиболее применимых у пациентов моложе 50 лет), идентифицирует больных ГКМП, установка которым ИКД максимально оправдана [3, 6, 10, 11, 13, 45, 46].
В настоящее время даже не обсуждается необходимость установки ИКД с целью вторичной профилактики ВСС у больных после перенесенной остановки сердца или страдающих устойчивой формой ЖТ [3, 4, 6]. Данные о стратификации риска получены, главным образом, из проспективных многолетних исследований групп больных с применением многофакторного анализа выживаемости для определения различных клинических характеристик и их взаимосвязи с ВСС [9]. На основании анализа выделено 5 клинических признаков, рассматриваемых международными рабочими группами в качестве главных ФР, явившихся предметом недавнего системного мета-анализа (табл. 2) [3, 4]. Многофакторный анализ 5 главных ФР ВСС при ГКМП позволил выявить 6-летнюю выживаемость больных ГКМП без ВСС на уровне 95% в отсутствие ФР, в то время как наличие одного, 2 или 3 ФР снижало выживаемость до 93, 82 и 36% соответственно [14].
Неустойчивая ЖТ является распространенным нарушением ритма сердца, обнаруживаемая по данным холтеровского мониторирования ЭКГ у 20—30% больных, однако короткой (менее 10 сокращений), не частой (менее 5 эпизодов в течение суток) и в целом бессимптомной аритмией [46, 47]. Наиболее часто она наблюдается при выраженной гипертрофии, ассоциирующейся с фиброзом миокарда и разнонаправленным расположением мышечных волокон [13, 47].
Результаты двух небольших сравнительных исследований свидетельствуют о том, что неустойчивая ЖТ наиболее часто отмечалась у больных, умерших внезапно [48, 49]. Все исследования, отметившие значимую ассоциацию между неустойчивой ЖТ и ВСС, определяют саму форму тахиаритмии как ≥3 последовательных желудочковых сокращений с частотой ≥120 уд/мин и длительностью менее 30 сек. [46, 50—52]. Выявленные эпизоды неустойчивой ЖТ у лиц моложе 30 лет ассоциируются с 4-кратным увеличением риска ВСС [46]. Желудочковая аритмия, индуцируемая физической нагрузкой, выявляется приблизительно у 2% больных и также независимо связана с 3-кратным увеличением риска ВСС [52].
Выраженная гипертрофия ЛЖ. Массивная гипертрофия ЛЖ (толщина стенки ≥30 мм) может играть роль в развитии ВСС вследствие негативного эффекта на архитектуру миокарда, увеличения его потребности в кислороде, возрастания миокардиального сосудистого сопротивления и капиллярной плотности. Выраженная гипертрофия ЛЖ, оцениваемая по максимальной толщине стенки желудочка ≥30 мм при эхокардиографии ассоциируется с ВСС [13, 14, 46, 50]. Однако часто плохое эхокардиографическое окно может ограничивать обследование пациента, препятствуя точному измерению толщины всех миокардиальных сегментов. Более того, толщина одного сегмента может не отражать распространенность гипертрофии всех отделов желудочка.
Ответ артериального давления (АД) на физическую нагрузку. Физическая нагрузка связана с физиологическим усилением симпатической активности, уменьшением вагусного тонуса и перераспределением кровотока из висцеральных органов в работающую скелетную мускулатуру. В норме отмечается физиологический прирост систолического АД (примерно на 7—10 мм рт.ст. в перерасчете на метаболический эквивалент) с достижением пика повышения на максимуме физической нагрузки [53]. Гипотензия, возникшая при физической нагрузке (в отсутствие лечения антигипертензивными препаратами, включая β-адреноблокаторы, выраженной брадикардии и исключении ортостатической гипотензии), является редким состоянием и, как правило, признаком тяжелой патологии сердца [53, 54].
При выполнении физической нагрузки в вертикальном положении примерно у 1/3 взрослых больных ГКМП развивается аномальный ответ систолического АД, характеризующийся нарастающей гипотензией или отсутствием прироста АД [55]. Гемодинамические исследования показывают, что аномальный ответ систолического АД развивается вследствие падения системного сосудистого сопротивления во время нагрузки и неспособностью адекватного увеличения сердечного выброса [50, 55, 56]. Патологический ответ систолического АД на физическую нагрузку следует выявлять как можно раньше, до появления у больных ГКМП лимитирующих симптомов ее выполнения, в отсутствие любых препаратов, способных потенциально влиять на гемодинамический ответ [9]. Такая реакция АД ассоциируется с ВСС у больных моложе 40 лет, но не является независимым предиктором в многофакторном анализе [14, 46, 50, 52].
ВСС в семейном анамнезе. Еще в 1958 г. D. Teare в своей фундаментальной работе по ГКМП отметил повышенную частоту случаев ВСС в семьях больных такой кардиомиопатией [57]. В дальнейшем B. Maron и соавт. описали 8 семей с ГКМП и высокой частотой ВСС [58], а позже W. McKenna и соавт. продемонстрировали, что у больных ГКМП отмечались позитивные анамнестические данные, связанные с непредсказуемыми фатальными событиями среди родственников [59]. Влияния семейного анамнеза в качестве предиктора ВСС были изучены на основании ряда исследований [14, 32, 46, 50—52, 60—62]. По результатам четырех из них с различными определениями «семейного анамнеза ВСС» было показана существенная связь данных такого анамнеза и ВСС [50, 51, 61].
Выявление точной причины смерти среди членов семей часто бывает проблематичным. Показания очевидцев, свидетельства о смерти и данные аутопсии не всегда доступны, и их интерпретация зависит от опыта лечащего врача или патологоанатома. Большинство исследований отмечали возрастной рубеж умерших в 40—50 лет и рассматривали лишь ряд ближайших родственников (родители, дети, родные братья и сестры).
Влияние семейного анамнеза на риск ВСС тесно связано с генетической природой заболевания, тем более что больные родственники имеют не только аналогичные генетические дефекты, но и в определенной степени схожие факторы окружающей среды. Так, мутации гена тропонина I связаны с высокой частотой ВСС, несмотря на более мягкую степень гипертрофии [63]. Однако, до сих пор не уточнено, может ли генетическая информация использоваться для стратификации риска ВСС в качестве дополнения к фенотипическим маркерам заболевания [39].
Синкопальные состояния. Синкопе как временная потеря сознания вследствие полной транзиторной гипоперфузии головного мозга представляет в определенной степени сложный клинический диагноз. Существуют многочисленные причины синкопальных состояний при ГКМП: ФП, наджелудочковая тахикардия, брадаритмии, устойчивая и неустойчивая, патологический сосудистый ответ, развитие обструкции ВТЛЖ при физической нагрузке, митральная регургитация, ишемия миокарда, нейроопосредованное синкопе (вазовагальное, ситуационное, синкопе каротидного синуса) и ортостатическая гипотензия [45—47, 55, 64, 65]. P. Spirito и соавт. определяют необъяснимое синкопе как «неизвестного происхождения, возникшее при обстоятельствах, явно не обусловленных нейроопосредованными событиями, т.е. без очевидного объяснения в покое или во время обычной повседневной активности, либо в течение интенсивного напряжения» [45]. При установлении факта синкопального состояния идентификация причины обморока базируется в основном на анамнестических данных пациента или очевидцев.
Другие клинические характеристики, связанные с увеличенным риском ВСС. Следует отметить, что в многофакторном анализе выживаемости ряд других фенотипических характеристик независимо связан с ВСС. Например, риск ВСС возрастает при выраженной обструкции ВТЛЖ [50, 66], дилатации левого предсердия, хронической форме ФП, а снижается с возрастом больных [45]. Фракционирование стимулированной правожелудочковой электрограммы также ассоциируется с ВСС, но инвазивный характер теста делает его бесперспективным для стратификации риска.
Другие клинические признаки ГКМП также сочетаются с ВСС при однофакторном анализе или в сравнительных исследованиях (например, апикальная аневризма ЛЖ), однако ограниченность имеющихся данных делает сложным оправдание их повседневного использования. Подобное ограничение также относится к результатам изучения генотипических особенностей из-за существенной внутри- и межсемейной вариабельности, неубедительных корреляциях генотип-фенотип, а ограниченная доступность клинического генетического тестирования не позволяет использовать полученную информацию для прогнозирования риска [67].
Особенности позднего гадолиниевого контрастирования при магнитно-резонансной томографии (МРТ) также изучались в качестве возможного ФР ВСС. Установлено, что позднее гадолиниевое контрастирование отражает внеклеточное отложение коллагена в миокарде больных ГКМП и сочетается в свою очередь с другими ФР ВСС, особенно с неустойчивой ЖТ [68—70]. В частности, была выявлена связь между поздним гадолиниевым контрастированием как маркером фиброза миокарда с желудочковыми тахиаритмиями, по данным холтеровского мониторирования ЭКГ [68]. По результатам оценки экстенсивности распределения позднего гадолиниевого усиления (≥15% миокарда ЛЖ) при проведении контрастной МРТ исследовательской группе R. Chan и соавт. удалось выявить подгруппу пациентов с ГКМП с увеличенным риском ВСС (даже в отсутствие традиционных маркеров риска) [69]. Результаты многофакторного анализа подтвердили, что распространенность позднего гадолиниевого контрастирования независимо ассоциировалась с увеличенным риском внезапной смерти даже после коррекции традиционных ФР ВСС. В связи с полученными данными, таких больных также целесообразно рассматривать в качестве кандидатов для имплантации дефибрилляторов [69].
Суммировав результаты ряда работ, посвященных прогностической оценке позднего гадолиниевого контрастирования при МРТ у больных ГКМП, J. Green и соавт. сделали вывод, что в целом этот критерий обладает существенной прогностической значимостью в прогнозировании тяжелых кардиальных осложнений (смерть от всех причин и от ССЗ, а также вследствие СН) [71]. Использование различных параметров МРТ может увеличить прогностическую ценность положительного результата теста при выявлении пациентов — кандидатов для применения более агрессивного подхода лечения.
В целом алгоритм расчета ФР, используемый при ГКМП, все еще несовершенен. То, что даже лица, имеющие низкий риск, умирают внезапно, подчеркивает необходимость поиска дополнительного или наиболее доминирующего маркера риска (сравнимого с фракцией изгнания при ишемической болезни сердца) [6, 14, 34, 72].
Предупреждение ВСС. Так как ГКМП является нередкой причиной смерти тренированных спортсменов, международные рекомендации советуют исключить больных с этим заболеванием из занятий спортом и отговаривать их от выполнения интенсивной физической нагрузки [3, 4].
К сожалению, риск ВСС у больных ГКМП не снижается при применении фармакологических средств, включая амиодарон [73]. Кроме того, амиодарон при длительном приеме дает много осложнений и зачастую плохо переносится, особенно молодыми больными. Как показал анализ, антиаритмический препарат первой группы — дизопирамид, ранее часто применявшийся у пациентов с симптоматической обструкцией ВТЛЖ, также не оказывает существенного влияния на снижение риска ВСС [9]. Профилактический эффект β-адреноблокаторов (даже в высоких дозах) по снижению риска ВСС у юных больных без симптомов пока не подкреплен доказательствами [34]. Таким образом, в настоящее время отсутствуют убедительные данные, подтверждающие целесообразность назначения антиаритмических препаратов для предотвращения ВСС при ГКМП.
ИКД. Главным достижением в профилактике ВСС как осложнения желудочковых тахиаритмий явилось разработка ИКД в 80-х гг. прошлого века. ИКД используются у больных ГКМП в течение последних 15 лет [10] и в настоящее время признаны наиболее эффективными средствами предупреждения ВСС у пациентов группы высокого риска. В настоящее время такие имплантируемые устройства являются единственными, способными в любой момент купировать летальные желудочковые тахиаритмии у больных ГКМП [10, 11]. ИКД являются «золотым стандартом» как для первичной, так и вторичной профилактики ВСС у больных этой категории. ИКД способны автоматически генерировать необходимый шоковый импульс для купирования потенциально опасных для жизни желудочковых тахиаритмий — ЖТ и ФЖ [11, 74—78].
Пациенты, чудом выжившие после эпизода ФЖ или ЖТ, имеют высокий риск последующих летальных аритмий и нуждаются в установке ИКД в первую очередь [38]. В клинической практике эта группа больных относительно небольшая, так как большинство из них не выживают при остановке кровообращения в амбулаторных условиях, и установка ИКД нередко является у них единственной надеждой на спасение. Тем не менее учитывая, что большинство больных ГКМП не имеют в анамнезе данных, свидетельствующих об остановке сердца, выявление лиц, имеющих высокую вероятность ВСС, могла бы принести несомненную пользу при установке ИКД с целью первичной профилактики. Имплантация устройства для предупреждения трагических событий у лиц с высоким риском ВСС в настоящее время считается вполне оправданной и снимает обеспокоенность как пациентов, так и врачей [9].
В 2007 г. опубликованы данные многоцентрового международного исследования по оценке эффективности ИКД у 506 пациентов с ГКМП и ФР ВСС [11]. Дефибрилляторы, установленные больным в среднем в возрасте 42 лет, купировали ЖТ или ФЖ с восстановлением синусового ритма у 103 (20%) больных. Уровень коррекций ритма составил 10,6% в год для вторичной профилактики после эпизода остановки сердца в анамнезе (5-летняя кумулятивная вероятность 39%) и 3,6% в год для первичной профилактики (5-летняя кумулятивная вероятность 17%) [11].
В исследовании P.A. Vriesendorp и соавт. сообщаются результаты наблюдения за течением основного заболевания у 134 больных с оценкой частоты коррекции ритма с помощью ИКД и количеством осложнений [79]. Вмешательства имплантируемого устройства для купирования желудочковых тахиаритмий были отмечены у 38 больных (6,8% в год), причем частота таких вмешательств ассоциировались с вторичной профилактикой ВСС и мужским полом. Сравнимые цифры приводятся и в другой работе, причем уровень коррекций ритма с помощью ИКД был сопоставим у детей и подростков с массивной гипертрофией ЛЖ [34].
Клинические рекомендации. Даже если принять установку ИКД для вторичной профилактики ВСС как безоговорочный метод, отбор больных для первичной профилактики представляет сложную задачу, обусловленную обширной гетерогенностью заболевания [3, 4]. Идеальная стратегия по стратификации риска должна основываться на использовании алгоритма, предусматривающего четкое и клинически приемлемое определение больных ГКМП, имеющих высокую угрозу ВСС, для оправдания риска, связанного с установкой ИКД [39].
В 2003 г. Американская коллегия кардиологов (АСС) и Европейское общество кардиологов (ESC) совместно опубликовали документ клинического экспертного консенсуса по ГКМП [3]. Для выявления больных, имеющих высокий риск ВСС с целью первичной профилактики, консенсус рекомендует рассматривать 5 главных ФР: наличие неустойчивой ЖТ, необъяснимых синкопальных состояний, аномального ответа АД на физическую нагрузку, ВСС в семейном анамнезе и выраженную гипертрофию ЛЖ [3]. При наличии 2 ФР и более эксперты полагают, что «риск ВСС представляет существенную значимость» для оправдания профилактической установки ИКД, в то время как в отношении пациентов, имеющих всего один ФР, «должно быть проведено взвешенное обсуждение профилактической установки ИКД» [3]. С момента публикации этих рекомендаций проведено 8 исследований выживаемости больных ГКМП, в 3 из которых проанализирована и подтверждена высокая прогностическая значимость вышеназванных 5 главных ФР ВСС [45, 50—52, 60, 62, 80, 81].
В руководстве по диагностике и ведению ГКМП, опубликованном в 2011 г. Американской коллегией кардиологов/Американской ассоциацией сердца (АССF/AHA), имплантация ИКД считается целесообразной у пациентов с семейным анамнезом ВСС, максимальной толщиной стенки ЛЖ≥30 мм или недавно перенесенным синкопе [4]. При этом ИКД могут быть полезными у пациентов с неустойчивой ЖТ или аномальным ответом АД на физическую нагрузку при наличии других установленных или интермиттирующих ФР [4]. Этот подход отличается от рекомендаций ACC/ESC 2003 г., основанных на полученных доказательствах из неселективных групп больных ГКМП и указывающих, что суммирование ФР отражает более высокий риск ВСС, а индивидуальные ФР в отдельности имеют низкую прогностическую ценность [13, 14, 50, 82].
Отсутствие четкой связи между частотой адекватных разрядов ИКД и профилем ФР в исследованиях больных ГКМП с установленными ИКД не может оправдать новые подходы, так как сами работы, посвященные оценке имплантируемых устройств, выполнены на базе отобранных пациентов, а целевым критерием эффективности является именно регистрация эффективного разряда ИКД, а не предупреждение ВСС как таковой [11, 77, 78]. Предположение, что все эффективные разряды ИКД эквивалентны купированию внезапных трагических событий, оказалось ошибочным. Более того, даже несмотря на то что неустойчивая ЖТ оказывает максимальное влияние при расчете вероятности ВСС, особенно у молодых больных, эта аритмия не отражена в рекомендациях АССF/AHA 2011 г., в которых ее значимость как ФР явно занижена.
Главный недостаток всех имеющихся стратегий по стратификации риска заключается в том, что они не предоставляют расчета индивидуализированного абсолютного риска, а опираются на относительные его оценки, что имеет ограниченное значение в персональном прогнозировании течения заболевания. К тому же ни один из этих подходов не был подтвержден во времени или географически [39]. Больные, отобранные для первичной или вторичной профилактики с помощью ИКД в соответствии с имеющимися рекомендациями, имеют низкий уровень адекватных шоковых разрядов (4,6% в год при 95% ДИ от 3,1 до 6,1%) с высокой частотой неадекватных разрядов и существенным числом осложнений [78]. Даже если последняя модель ИКД, располагающегося полностью подкожно, может помочь снизить частоту осложнений, обусловленных имплантируемыми устройствами, следует и в дальнейшем улучшать систему оценки стратификации их риска.
При выборе ИКД должна быть учтена частота развития типичных и распространенных осложнений, связанных с имплантацией устройства. На основе крупного исследования, оценивающего широкий спектр побочных эффектов у 161 470 больных различными заболеваниями сердца с установленными ИКД, тяжелыми осложнениями были пневомоторакс (0,51%), остановка сердца (0,34%), расслоение кардиальной вены (0,15%), гемоторакс (0,10%), тампонада сердца (0,09%). Из легких осложнений наиболее часто отмечались смещение электрода (1,09%) и гематома (1,06%) [83].
По результатам суммарного анализа эффективности и осложнений при установке ИКД 2190 больным ГКМП A. Schinkel и соавт. сообщают, что ежегодная смертность от кардиальных причин составила 0,6 пациента в год, а уровень адекватных вмешательств с помощью дефибриллятора — в среднем 3,3 случая в 1 год. Информация об осложнениях, связанных с ИКД, была доступна для 1691 больного [84]. В целом те или иные осложнения отмечены у 260 (15,4%) человек, при этом наиболее частыми являлись нарушение работы электрода — в 118 (7%), инфекции, связанные с установкой устройства, — в 59 (3,5%) и смещение позиционирования электрода — в 28 (1,7%) случаях [84].
Перед имплантацией ИКД пациентов следует поставить в известность о возможности неадекватных шоковых разрядов, развитии специфических осложнений в связи с установкой устройства, социальных и профессиональных ограничениях. Больные ГКМП с установленными ИКД эффективно защищены от ВСС, но не от других осложнений, связанных с основным заболеванием, таких как СН и тромбоэмболии. Реципиенты ИКД должны проходить регулярное обследование для оценки динамики симптомов заболевания и функционирования имплантированного устройства.



