Гипертрофическая кардиомиопатия (ГКМП) — заболевание, характеризующееся относительно высоким риском внезапной сердечной смерти (ВСС). Частота ВСС в общей популяции больных ГКМП составляет около 1% в год, по данным специализированных центров — до 6% [1]. При естественном течении заболевания от 50 до 90% всех смертей происходит внезапно [2]. У большинства больных ГКМП клинические проявления болезни отсутствуют, а ВСС может быть ее первым и единственным симптомом [3, 4]. В настоящее время установлены факторы риска (ФР) ВСС, 2 из которых можно отнести к показаниям к вторичной профилактике желудочковых тахиаритмий (остановка сердца в анамнезе и спонтанная устойчивая желудочковая тахикардия) и 5 — к показаниям к первичной профилактике (случаи ВСС в семье, гипертрофия левого желудочка — ГЛЖ 30 мм или более, необъяснимые синкопе, спонтанная неустойчивая желудочковая тахикардия — нЖТ, гипотензивный ответ на физическую нагрузку). Наличие одного или нескольких этих, так называемых больших ФР, служит показанием к имплантации кардиовертера-дефибриллятора [1]. Однако, по данным большинства авторов, частота мотивированных срабатываний имплантированного кардиовертера-дефибриллятора (ИКД) у больных ГКМП, отобранных на основании известных критериев, составляет 4—5% в год [5, 6]. Таким образом, в течение срока службы ИКД до истощения источника питания (в среднем 6—7 лет) у 70—80% больных это дорогостоящее и небезразличное для пациента устройство оказывается невостребованным. Данное обстоятельство обусловливает необходимость совершенствования методов стратификации и определения дополнительных ФР ВСС у больных ГКМП. Такими дополнительными предикторами могли бы стать новые неинвазивные электрофизиологические (электрокардиографические) показатели, в частности турбулентность ритма сердца (ТРС) и микровольтная альтернация зубца Т (mTWA), хорошо зарекомендовавшие себя у пациентов, перенесших инфаркт миокарда (ИМ), и включенные в рекомендации по стратификации риска ВСС у больных, перенесших ИМ [3]. Однако оценке особенностей этих показателей у больных ГКМП посвящены единичные исследования. Остаются недостаточно изученными значимость данных параметров, их взаимосвязь с известными ФР ВСС и морфофункциональными особенностями сердца (степенью гипертрофии миокарда, наличием обструкции выводного отдела левого желудочка — ЛЖ).
Целью нашего исследования явилось изучение особенностей mTWA и ТРС у больных ГКМП.
Материал и методы
В основную группу были включены 50 пациентов с ГКМП (среди них 25 мужчин, средний возраст 40,6±18,3 года). Критериями включения были ГКМП [7]; возраст старше 15 лет. Критерии исключения: ишемическая болезнь сердца; постоянная форма фибрилляции или трепетания предсердий; наличие имплантированного электрокардиостимулятора, кардиовертера-дефибриллятора; синдром Вольфа—Паркинсона—Уайта; атриовентрикулярная блокада II—III степени; онкологическое заболевание; некомпенсированный тиреотоксикоз; выраженная анемия (уровень гемоглобина менее 90 г/л).
Обструктивная форма ГКМП диагностирована у 15 (28%) пациентов, средний градиент давления составил 45 (39; 74) мм рт.ст. У 23 (46%) пациентов имелись «большие» ФР ВСС: толщина стенки ЛЖ 3 см и более у 7 (14%), ВСС в семье — у 6 (12%), пароксизмы нЖТ — у 16 (32%), обмороки неясного генеза в анамнезе — у 5 (10%). У 9 (18%) пациентов имелось сочетание двух, а у 1 пациентки — трех «больших» ФР. У 9 (18%) больных диагностирована наследственная форма ГКМП, 7 (14%) страдали пароксизмами фибрилляции предсердий (ФП). Кроме того, у 7 (14%) пациентов имелись признаки хронической сердечной недостаточности (ХСН): I функционального класса (ФК) – у одного больного, II ФК — у 4, III ФК — у 2.
Терапия β-адреноблокаторами проводилась 40 (80%) пациентам, в основном бисопрололом в средней дозе 2,5 (2,5—5) мг — 19 (38%), метопролола тартратом в дозе 75 (31—100) мг — 13 (26%), по 2 пациента принимали карведилол и метопролола сукцинат, по одному больному — небиволол, пропранолол, надолол и соталол. Амиодарон в поддерживающей дозе 200 мг/сут принимали 10 (20%) больных, блокаторы кальциевых каналов — 22% (из них 4 — верапамил, остальные — дигидропиридиновые препараты), ингибиторы ангиотензинпревращающего фермента — 32%, блокаторы ангиотензиновых рецепторов — 10%. Два пациента, страдающие обструктивной формой ГКМП, соответственно за 1 и 8 лет до включения в исследование перенесли алкогольную аблацию межжелудочковой перегородки (МЖП).
Сопоставимая по половому составу и возрасту контрольная группа включала 50 лиц без сердечно-сосудистых заболеваний (26 мужчин, средний возраст 38,6±20 лет).
Всем пациентам, включенным в исследование, проводилось обследование, включавшее первичный опрос, осмотр, эхокардиографию (ЭхоКГ), при которой определяли конечный диастолический размер (КДР) ЛЖ, конечный систолический и диастолический объемы ЛЖ, фракцию выброса (ФВ) ЛЖ, толщину задней стенки (ТЗС) ЛЖ, толщину межжелудочковой перегородки (ТМЖП), толщину миокарда в области верхушки (при верхушечном варианте ГКМП), массу миокарда ЛЖ (ММЛЖ), рассчитываемую по методу, рекомендованному Американским обществом ЭхоКГ [8], и индекс массы миокарда (ИММ), определяемый как отношение ММЛЖ к площади поверхности тела. При анализе использовали также показатель «максимальная толщина миокарда ЛЖ» (МТ ЛЖ), определяемый как максимальный из трех размеров — ТМЖП, ТЗС и толщина миокарда в области верхушки у пациентов с верхушечным вариантом ГКМП.
Всем пациентам проводили холтеровское мониторирование (ХМ) электрокардиограммы в течение 24 ч с определением максимальной, минимальной и средней частоты сердечных сокращений (ЧСС) днем и ночью, числа желудочковых экстрасистол (ЖЭ), пароксизмов нЖТ, показателей вариабельности ритма сердца (ВРС) (SDNN и pNN50), mTWA и ТРС. Для ТРС определяли показатели turbulence onset (ТО) — начало турбулентности (величину учащения синусового ритма после ЖЭ) и turbulence slopе (TS — наклон турбулентности, т.е. интенсивность замедления синусового ритма после его учащения в постэкстрасистолическом периоде). За патологические значения принимали ТО>0, TS<2,5 мс/RR [9].
В отсутствие ЖЭ, пригодных для анализа (у 17 пациентов), ТРС считали нормальной. mTWA рассчитывали с помощью программного обеспечения Cardioday Getemed (General Electric) по методу модифицированной скользящей средней [10] в двух холтеровских отведениях. По методике, ранее описанной нами [11, 12], определяли следующие значения mTWA: максимальное значение в течение суток (mTWAmax), значение при ЧСС 100 уд/мин (mTWA100) и в 05.00 ч (mTWA05:00). Использовали фактор актуализации (ФА — число комплексов QRS, для которого проводится усреднение) 1/8 и 1/32. Таким образом, для каждого пациента определяли 12 показателей mTWA. Наблюдение за больными осуществляли в течение 12 мес.
Статистический анализ. Для нормального распределения данные представлены в виде среднее значение±стандартное отклонение, в иных случаях указана медиана (25-й процентиль; 75-й процентиль). Достоверность различий оценивали с помощью двустороннего t-критерия (при нормальном распределении), критерия Манна—Уитни или критерия χ2. Достоверными считали различия при p<0,05. Корреляции исследовали с помощью коэффициента ранговой корреляции Спирмена. Все расчеты осуществляли с помощью программного обеспечения Биостатистика версии 4.03 и SPSS версии 17.0.
Результаты
По данным ЭхоКГ, пациенты с ГКМП по сравнению с контрольной группой закономерно характеризовались достоверно более высокими значениями ТМЖП, ТЗС, ММЛЖ, ИММ. При этом КДР и ФВ ЛЖ отличались недостоверно (табл. 1).
Обнаружена тенденция к большей частоте выявления патологических значений ТРС всех типов (p=0,083) в группе больных ГКМП по сравнению со здоровыми лицами. Суммарно нарушения ТРС первого (патологические значения либо ТО, либо TS) и второго (нарушения и ТО, и TS) типов в основной группе встречались у 18% пациентов, в то время как в группе контроля лишь у одного пациента, включенного в исследование, выявлено нарушение ТО. При этом частота выявления патологических значений ТО в основной группе была достоверно выше (суммарно 16%), чем в контрольной (2%; p<0,05). Средние абсолютные значения ТО и TS в группах были сопоставимы.
Не получено по частоте выявления патологических значений ТРС при анализе в подгруппах пациентов с наличием и отсутствием «больших» ФР, пароксизмов нЖТ, обструкции выводного отдела ЛЖ.
Не выявлено также различий по ММЛЖ, ИММ, ТМЖП, ТЗС и МТ ЛЖ у пациентов с нормальной и нарушенной ТРС и корреляции показателей ТРС со степенью гипертрофии.
Обнаружена слабая корреляция между показателями ТРС и ВРС. Значение ТО обратно коррелировало с SDNN (rs=-0,348; р=0,048) и pNN50 (rs=-0,474; р=0,006), а для TS связь с SDNN (rs=0,420; р=0,016) и pNN50 (rs=0,426; р=0,014) была прямой.
Показатели ВРС у больных ГКМП были несколько ниже, чем в контроле, но различия не достигали статистической значимости. При этом у пациентов с обструктивной формой ГКМП показатель SDNN хотя и не отличался от такового в подгруппе с необструктивой формой, но имел тенденцию к меньшим значениям по сравнению с контрольной группой (p=0,058). Не обнаружено также различий по показателям ВРС у пациентов с наличием «больших» ФР и нЖТ или без таковых. Однако у 9 пациентов с нЖТ, зарегистрированной с помощью ХМ при включении в исследование (т.е. именно в те же сутки, когда анализировалась ВСР), показатели SDNN и pNN50 оказались достоверно ниже, чем у оставшегося 41 пациента, — соответственно 125 (102; 142) мс против 165 (110; 213) мс (p=0,026) и 5% (2; 11%) против 13% (7; 29%) (p=0,028). У больных основной группы не выявлено корреляции показателей толщины миокарда и ВСР за исключением слабой обратной связи ТЗС и SDNN (rs=-0,393; р<0,05).
При анализе показателей mTWA обнаружено, что больные ГКМП характеризовались достоверно более высокими значениями mTWA05:00 (при ФА 1/8 и 1/32 в первом мониторном отведении и при ФА 1/8 во втором отведении) по сравнению с группой контроля (табл. 2).
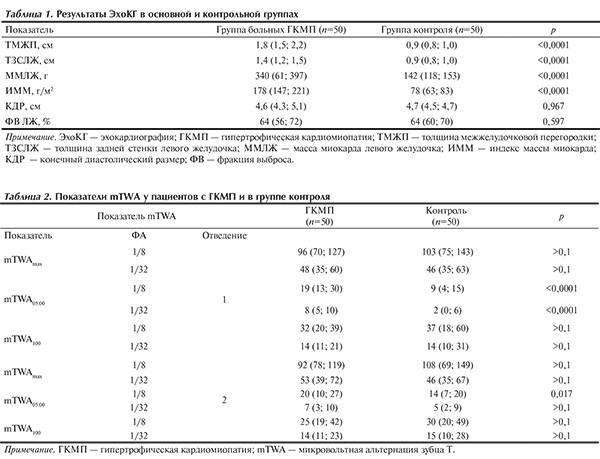
При этом выявленные различия с контрольной группой были характерны как для пациентов с обструктивной, так и необструктивной формой ГКМП, а также не зависели от наличия «больших» ФР ВСС, ХСН, пароксизмов нЖТ и ФП. Остальные показатели mTWA у пациентов с ГКМП по сравнению с контролем различались недостоверно.
Дополнительно проанализированы показатели mTWA у пациентов с ГКМП в зависимости от наличия или отсутствия обструкции выходного тракта ЛЖ, «больших» ФР ВСС, пароксизмов нЖТ, ФП и ХСН. В целом результаты измерения mTWA в подгруппах были сопоставимы, за исключением достоверно более высоких значений mTWA05:00 при ФА 1/32 в первом отведении у пациентов с необструктивной формой ГКМП по сравнению с подгруппой обструктивной формы mTWAmax, а также при ФА 1/8 во втором отведении у пациентов с наличием «больших» ФР по сравнению с их отсутствием. Однако значение mTWAmax у пациентов с «большими» ФР ВСС достоверно не отличалось от контрольной группы, а различие с подгруппой пациентов без ФР было обусловлено достоверно меньшим значением показателя у последних по сравнению с контролем.
Ранее в группе пациентов, перенесших ИМ, нами показано прогностическое значение для риска сердечно-сосудистой смерти превышения 18,5 мкВ показателем mTWA05:00 при его измерении с ФА 1/8 в первом мониторном отведении [12]. C учетом этих данных мы разбили всю группу пациентов с ГКМП на подгруппы с mTWA05:00 19 мкВ или более (n=27) и менее 19 мкВ (n=23). При сопоставлении данных подгрупп по частоте выявления обструкции выводного отдела ЛЖ, «больших» ФР, пароксизмов нЖТ, синкопе, толщины миокарда более 3 см, случаев ВСС в семье, пароксизмов ФП, ХСН, а также по величине показателей ВСР и ГЛЖ, числу ЖЭ достоверных различий не обнаружено. Тем не менее в целом в группе ГКМП превышение данного пограничного значения встречалось достоверно чаще (в 54% случаев), чем в контроле (16%; p<0,001).
Аналогичный расчет проведен для показателя mTWA100 (ФА 1/8, первое отведение), который ранее продемонстрировал прогностическое значение в стратификации риска ВСС у пациентов, перенесших ИМ [12]. Достоверных различий по частоте выявления отдельных ФР, показателям ХМ и ЭхоКГ, особенностям клинической картины заболевания в подгруппах пациентов с mTWA100 54 мкВ или более (n=7) и меньше 54 мкВ (n=43) не выявлено. При этом частота выявления превышения пограничных значений mTWA100 в контрольной группе была даже несколько выше (30%), чем в группе ГКМП (14%; p=0,091).
Ни у одного из пациентов в группе ГКМП не выявлено сочетания mTWA100 более 53 мкВ и нарушений ТРС, что в ранее проведенных нами исследованиях соответствовало максимальному риску ВСС у больных, перенесших ИМ [12]. Сочетание изолированного нарушения ТО и mTWA05:00 более 18 мкВ выявлено у 3 пациентов (все с необструктивной формой ГКМП), однако лишь у одного из них зарегистрированы пароксизмы нЖТ. Других «больших» ФР у этих пациентов не отмечалось.
При проведении корреляционного анализа не выявлено значимой связи показателей mTWA c толщиной миокарда ЛЖ, за исключением слабой обратной корреляции тМЖП и mTWA100 во втором отведении при ФА 1/32 (rs=-0,320; р<0,05).
Выявлена слабая положительная корреляция количества ЖЭ с mTWAmax в первом отведении при ФА 1/8 (rs=0,296; р=0,038) и при ФА 1/32 (rs=0,389; р=0,006). При этом число ЖЭ (зарегистрированы у 82% больных) в группе ГКМП было невелико — в среднем 17 (4; 62) в сутки, а максимальное — 810 в сутки, однако достоверно выше, чем в группе контроля — у 29% пациентов (p<0,001) и их среднее число составляло 5 (2; 9) в сутки (p=0,012), а максимальное — 233 в сутки.
Число пароксизмов нЖТ за сутки у наших пациентов колебалось от 1 до 4, в группе контроля данный вид аритмии не зарегистрирован. Выявлена слабая корреляция mTWAmax в первом отведении при ФА 1/8 с количеством пароксизмов нЖТ, зарегистрированных с помощью ХМ при включении пациентов в исследование (rs=0,359; р=0,011). В этом случае отсутствие пароксизмов нЖТ принималось за ноль. Если же из анализа исключались пациенты, у которых нЖТ при включении в исследование не зарегистрирована (т.е. подгруппа анализа составляла 9 пациентов, у которых нЖТ регистрировалась в сутки определения mTWA), то связь с числом пароксизмов за сутки становилась сильной (rs=0,812; р=0,01) и, кроме того, обнаруживалась связь с mTWA100 при ФА 1/8 (первое отведение) (rs=0,762; р=0,019) и 1/32 (rs=0,729; р=0,027) (второе отведение).
За время наблюдения 8 пациентам были имплантированы ИКД с целью профилактики ВСС. Ни у одного из них в течение года мотивированных срабатываний ИКД не зарегистрировано. Двум пациентам с выраженной обструкцией выводного отдела ЛЖ выполнена миотомия гипертрофированной МЖП и папиллярных мышц ЛЖ. Еще двум пациентам с синдромом слабости синусного узла имплантированы электрокардиостимуляторы. В течение года после включения в исследование в группе ГКМП зарегистрирован 1 случай ВСС у пациентки с необструктивной формой заболевания и пароксизмами нЖТ, по данным ХМ. Таким образом, смертность в нашем исследовании составила 2%. Необходимо отметить, что пациентка отказалась от имплантации ИКД и самостоятельно отменила назначенный ранее амиодарон. При включении в исследование нарушений ТРС у больной не было выявлено, из 12 показателей mTWA 4 превышали средние значения в группе, однако в основном не выходили за пределы 75-го процентиля (за исключением mTWA100 при ФА 1/8 в первом отведении).
Обсуждение
Оценивая полученные нами результаты, необходимо отметить, что в настоящее время ни одна из изучаемых электрокардиографических методик при ГКМП (в отличие от пациентов с ишемической болезнью сердца), по сути, не доказала своей значимости в прогнозировании ВСС. Однако обращает внимание, что работы выполнялись с участием относительно небольших когорт пациентов. Максимальное число больных, включенных в исследование, составляло 100—150 (а чаще 50—60), что объясняется редкостью самой патологии. В ряде исследований заключение о значимости той или иной методики в стратификации риска ВСС сделано на основании выявления связи изучаемых неинвазивных электрофизиологических предикторов с наличием пароксизмов нЖТ. По нашему мнению, это не совсем корректно, так как нЖТ является лишь ФР ВСС и не тождественна устойчивым желудочковым тахиаритмиям, приводящим к летальному исходу.
Из рассмотренных в нашем исследовании методик относительно изученной при ГКМП можно считать лишь ВРС. Большинство авторов отмечают, что ГКМП по сравнению с нормальным миокардом характеризуется снижением как временны'х [13], так и спектральных [14—16] характеристик ВРС. Имеются противоречивые данные о преимущественном снижении как симпатической [17], так и парасимпатической активности [16, 18], а также о равной степени нарушения обоих звеньев вегетативной системы [19]. В части исследований обнаружена связь нарушений ВРС с наличием пароксизмов нЖТ [20—22], синкопальных состояний [21, 23], степенью обструкции [24], степенью гипертрофии миокарда [21, 25].
В исследовании G. Butera и соавт. показано, что снижение отношения LF/HF ассоциируется с большей частотой неблагоприятных исходов [14]. В другой работе [21] получен прямо противоположный результат: пациенты, умершие внезапно или реанимированные после остановки кровообращения, характеризовались достоверно более высоким значением LF/HF по сравнению с выжившими. Использовав нестандартные методики анализа ВРС, F. Сlariá и соавт. показали их различие у пациентов с низким риском ВСС и больных, переживших остановку сердца [5]. Однако большинство авторов не выявили связи между ВРС и частотой ВСС [17, 20, 26]. По мнению ряда исследователей, нарушения ВРС в большей степени связаны c тяжестью ХСН, а не c частотой ВСС [16, 24, 27]. В нашем исследовании более низкие значения ВРС у пациентов с ГКМП по сравнению с контролем были статистически недостоверны (общая группа) либо различия находились на грани достоверности (подгруппа обструктивной ГКМП). Наименьшими значениями SDNN и pNN50 характеризовались пациенты, у которых нЖТ регистрировались непосредственно в день измерения ВСР, а связь снижения ВСР со степенью ГЛЖ практически отсутствовала. Однако общая направленность изменений ВРС в сторону более низких значений у больных с более тяжелым течением заболевания (наличие ХСН, ФП, пароксизмов нЖТ, обструкции) заставляет предположить, что получению статистически значимых различий препятствовала, прежде всего, небольшая численность пациентов в отдельных подгруппах.
Исследованию ТРС при ГКМП посвящены единичные работы [26, 28—30]. T. Kawasaki и соавт. [29] при оценке ТРС у 104 пациентов с ГКМП не выявили различий по распространенности патологических значений по сравнению с контролем (при этом больные без ЖЭ исключались из исследования). При наблюдении за пациентами в течение 27±10 мес не обнаружено влияния нарушения ТРС на прогноз. Однако все конечные точки в этом исследовании были связаны с ХСН, а не с ВСС. В последующем авторы опубликовали результаты 10-летнего наблюдения за этой группой больных [26], которое также не подтвердило предположения о прогностическом значении ТРС для больных ГКМП. В связи с этим следует отметить, что в настоящее время феномен ТРС тесно связывается с активностью барорефлекса [31], а, по данным A. Katarzynska-Szymanska и соавт., барорецепторная чувствительность при ГКМП не отличается от таковой у здоровых лиц [32]. Тем не менее в нашем исследовании частота нарушения ТО у больных ГКМП была достоверно выше, чем в контроле. Мы не выявили достоверной связи нарушения ТРС с известными ФР ВСС, включая нЖТ. В то же время Т.Г. Вайханская и соавт. у пациентов с обструктивной формой ГКМП обнаружили более высокие значения ТО при наличии значимых желудочковых аритмий (устойчивая или неустойчивая ЖТ, частая ЖЭ) [28]. Это послужило основанием для включения показателя ТО в критерии отбора пациентов с ГКМП для проведения мероприятий, направленных на профилактику ВСС [33].
Наиболее сложно сопоставить результаты нашего исследования с ранее опубликованными данными других авторов в части изучения mTWA, поскольку использованный нами модифицированный метод скользящей средней (временнóй анализ) ранее у больных ГКМП не использовался. Даже среди пациентов, перенесших ИМ или проходившим нагрузочный тест по другим показаниям, методика его применения для оценки mTWA в покое и пограничные значения для определения группы высокого риска в различных исследованиях не совпадали [34, 35]. Мы использовали методику, разработанную нами ранее для пациентов, перенесших ИМ. Единственным показателем, достоверно отличавшим больных ГКМП от пациентов контрольной группы, было mTWA05:00, причем данные различия были присущи ГКМП вне зависимости от ее формы или наличия ФР ВСС. Не удалось объяснить эти различия и тем, что отдельные пациенты с ГКМП принимали амиодарон (по нашим данным, этот препарат увеличивает mTWA [11]), поскольку анализ в подгруппах не выявил достоверных различий mTWA среди пациентов с ГКМП, принимавших и не принимавших этот препарат. Оценка mTWA в утренние часы ранее предложена нами, исходя из стандартных условий ее измерения (сон) и высокой частоты возникновения в это время сердечно-сосудистых осложнений, включая ВСС [11]. Однако необходимо отметить результаты исследования [36], в котором у больных ГКМП с ИКД лишь 27% всех аритмий, купированных ИКД, наблюдалось в ночное время, а пик приходился на 14—16 ч.
В целом на настоящий момент ни одно из малочисленных исследований не было направлено на непосредственную оценку значимости mTWA в прогнозировании риска ВСС у больных ГКМП. В работах, проведенных ранее с использованием спектрального анализа, для которого пограничные значения определены (правда, лишь для больных ишемической болезнью сердца), выявлена более высокая распространенность нЖТ у пациентов с положительным тестом mTWA [30, 37, 38]. Мы не выявили подобной закономерности, возможно, вследствие использования другого подхода: в силу отсутствия четко очерченных норм mTWA для больных ГКМП мы не использовали понятия «положительного» и «отрицательного» тестов, а попытка применения критериев, полученных у больных, перенесших ИМ, не оправдала себя. Тем не менее среди пациентов, у которых желудочковые аритмии регистрировались непосредственно в день измерения mTWA, мы обнаружили прямую корреляцию как числа нЖТ, так и числа ЖЭ с некоторыми показателями mTWA. Важно отметить, что больные именно этой подгруппы характеризовались наименьшими значениями ВРС. Таким образом, можно предполагать, что нарушение вегетативного статуса и электрическая нестабильность миокарда играют роль в генезе желудочковых нарушений ритма при ГКМП.
Связь mTWA с морфофункциональными особенностями ГКМП в настоящий момент не определена. Имеется указание на более высокую распространенность обструкции выводного отдела ЛЖ у пациентов с положительным тестом mTWA [30]. В нашем исследовании пациенты без обструкции имели даже более высокие средние значения mTWA05:00 по сравнению с больными обструктивной формой. Хотя наличие обструкции и относят к «малым» ФР ВСС [7], статистически значимых различий по частоте ВСС между группами больных с обструкцией выносящего тракта ЛЖ и без нее не обнаружено [39]. Кроме того, при помощи корреляционного анализа нам не удалось выявить зависимости mTWA от степени ГЛЖ. Единственная выявленная корреляция между показателями ГЛЖ и mTWA носила отрицательный характер. Это позволяет предположить, что степень ГЛЖ не является ключевым фактором, играющим роль в повышении mTWA у больных ГКМП. Данные литературы на этот счет противоречивы. Имеются сведения о более выраженной ГЛЖ (по результатам ЭхоКГ) у пациентов с положительным тестом mTWA [38]. В другом исследовании подобная закономерность не выявлена, но пациенты с положительным тестом mTWA отличались более выраженными изменениями миокарда (степенью дезорганизации кардиомиоцитов, выраженностью фиброза), обнаруженными при гистологическом исследовании [37].
Ограничениями нашего исследования являются относительно небольшое число пациентов и срок наблюдения за ними, что не позволило сделать выводы о значимости изучаемых ФР в прогнозировании ВСС. Исследование проводилось на фоне продолжающегося приема ранее подобранной терапии. Для многих изучаемых показателей отсутствуют строго определенные понятия нормы и патологии, подтвержденные при ГКМП. Группа больных характеризовалась разнородностью с точки зрения демографических (возраст) и клинических (обструктивная и необструктивная формы ГКМП, наличие или отсутствие ХСН, пароксизмов ФП) характеристик.
Выводы
Для больных гипертрофической кардиомиопатией по сравнению со здоровыми лицами характерны более высокие значения микровольтной альтернации зубца Т05:00 и бóльшая частота выявления патологических значений начала турбулентности. Наличие обструкции выводного тракта левого желудочка, а также факторов риска внезапной сердечной смерти не является решающим фактором в генезе повышения микровольтной альтернации зубца Т и нарушения турбулентности ритма сердца. У больных гипертрофической кардиомиопатией не выявлено значимой связи толщины миокарда левого желудочка с показателями микровольтной альтернации зубца Т, турбулентности ритма сердца и вариабельности ритма сердца. Микровольтная альтернация зубца Т прямо связана с числом желудочковых экстрасистол и числом пароксизмов неустойчивой желудочковой тахикардии. Пациенты с пароксизмами неустойчивой желудочковой тахикардии характеризуются меньшими значениями SDNN и pNN50 по сравнению с таковыми у больных без неустойчивой желудочковой тахикардии.



