Желудочковые аритмии (ЖА) в настоящее время остаются основной причиной внезапной сердечной смерти (ВСС) [1]. Оценочная частота ВСС в России составляет 200—250 тыс. случае в год [2]. Следует отметить, что ВСС может быть первым и последним проявлением заболевания [3]. Основной причиной желудочковых эктопий у лиц старше 30 лет, как правило, является ишемическая болезнь сердца (ИБС). В исследованиях, проведенных в последние годы, показано, что в 60% случаев ИБС клинически проявляется в виде острого инфаркта миокарда (ИМ), в 24% — в виде стабильной стенокардии и в 16% – в виде ВСС [4]. В большинстве случаев ВСС при патологоанатомическом вскрытии обнаруживаются коронарный тромбоз, острый или перенесенный, порой недиагностированный ИМ [5].
 Успешное применение имплантированных кардиовертеров-дефибрилляторов (ИКД) делает актуальным раннее распознавание ЖА. Исследования, проведенные ранее, продемонстрировали, что имплантация ИКД снижала смертность по причине ЖА у больных ИБС [6]. Поэтому в настоящее время имплантацию кардиовертеров-дефибрилляторов следует рассматривать в качестве основного метода лечения в первичной и вторичной ВСС, а также в случае неустранимых аритмий [7]. Холтеровское мониторирование (ХМ) электрокардиограммы (ЭКГ) является современной методикой диагностики нарушений ритма сердца (НРС). Проведение ХМ обязательно для пациентов с необъяснимыми синкопальными и пресинкопальными состояниями, у больных с жалобами на сердцебиение, боли в грудной клетке, причина которых на момент обследования не определена [8, 9].
Успешное применение имплантированных кардиовертеров-дефибрилляторов (ИКД) делает актуальным раннее распознавание ЖА. Исследования, проведенные ранее, продемонстрировали, что имплантация ИКД снижала смертность по причине ЖА у больных ИБС [6]. Поэтому в настоящее время имплантацию кардиовертеров-дефибрилляторов следует рассматривать в качестве основного метода лечения в первичной и вторичной ВСС, а также в случае неустранимых аритмий [7]. Холтеровское мониторирование (ХМ) электрокардиограммы (ЭКГ) является современной методикой диагностики нарушений ритма сердца (НРС). Проведение ХМ обязательно для пациентов с необъяснимыми синкопальными и пресинкопальными состояниями, у больных с жалобами на сердцебиение, боли в грудной клетке, причина которых на момент обследования не определена [8, 9].
Особое значение выявление ЖА имеет у пациентов, перенесших ИМ. В то же время, в соответствии с современными рекомендациями по амбулаторной ЭКГ у пациентов после ИМ с нормальной функцией левого желудочка (ЛЖ) в отсутствие очевидных или клинически проявляющихся НРС, абсолютных показаний к проведению ХМ нет [8, 9].
Выявление предикторов ЖА высоких градаций и стратификация риска развития фатальных осложнений — трудная клиническая задача. Необходимо отметить, что в настоящее время отсутствуют мощные и эффективные инструменты для выявления маркеров злокачественных ЖА в популяции, а показания к проведению ХМ требуют некоторой оптимизации, что делает актуальным изучение этого вопроса.
Цель настоящего исследования состояла в выявлении предикторов ЖА высоких градаций у популяции больных, включенных в Регистр проведенных операций коронарной ангиографии.
Материал и методы
 Из 15 283 пациентов, включенных в Регистр проведенных операций коронарной ангиографии [10] с 1991 по 2012 г., отобраны 993 пациента, которым проводилось ХМ (система «Кардиотехника-04», Инкарт, г. Санкт-Петербург). Доля мужчин в выборке составила 76,8%, средний возраст достигал 55,6±8,4 года. Из исследования исключали больных острым ИМ, нестабильной стенокардией, тяжелой хронической сердечной недостаточностью (ХСН), а также пороками сердца. Во время ХМ проводили 24-часовую запись 3 биполярных модифицированных отведений, отражающих потенциалы передней (V4м), боковой (V6м) и нижнедиафрагмальной (Y) стенок ЛЖ. Традиционно для оценки тяжести желудочковой экстрасистолии (ЭС) использовали классификацию, разработанную B. Lawn и N. Wolff в 1971 г. Согласно классификации, к низкой градации ЖА отнесены редкие и частые монотопные и политопные ЭС, к высокой градации — парные, ранние ЭС, пробежки желудочковой тахикардии (ЖТ) [11]. ЖТ определялась как 3 комплекса QRS желудочкового происхождения и более с частотой более 100 в 1 мин [12].
Из 15 283 пациентов, включенных в Регистр проведенных операций коронарной ангиографии [10] с 1991 по 2012 г., отобраны 993 пациента, которым проводилось ХМ (система «Кардиотехника-04», Инкарт, г. Санкт-Петербург). Доля мужчин в выборке составила 76,8%, средний возраст достигал 55,6±8,4 года. Из исследования исключали больных острым ИМ, нестабильной стенокардией, тяжелой хронической сердечной недостаточностью (ХСН), а также пороками сердца. Во время ХМ проводили 24-часовую запись 3 биполярных модифицированных отведений, отражающих потенциалы передней (V4м), боковой (V6м) и нижнедиафрагмальной (Y) стенок ЛЖ. Традиционно для оценки тяжести желудочковой экстрасистолии (ЭС) использовали классификацию, разработанную B. Lawn и N. Wolff в 1971 г. Согласно классификации, к низкой градации ЖА отнесены редкие и частые монотопные и политопные ЭС, к высокой градации — парные, ранние ЭС, пробежки желудочковой тахикардии (ЖТ) [11]. ЖТ определялась как 3 комплекса QRS желудочкового происхождения и более с частотой более 100 в 1 мин [12].
В рамках клинического комплексного обследования всем больным выполнена двухмерная эхокардиография (ЭхоКГ) в соответствии с рекомендациями Европейского общества ЭхоКГ [13] с использованием ультразвуковых аппаратов. Анализ локальной сократимости основывался на условном разделении ЛЖ на 16 сегментов [14]. Показатель фракции выброса (ФВ) ЛЖ рассчитывали с помощью вычисления объемов по формуле Симпсона в апикальной четырехкамерной или двухкамерной позиции. Всем больным проведена селективная коронарография (КГ) по методу Judkins (1967) с использованием ангиографических комплексов.
 Статистическую обработку полученных данных проводили с помощью пакета статистических программ SPSS 12.0. Распределение переменных определяли с помощью критерия Колмогорова—Смирнова. Для выявлений различий между группами использовали парный t-критерий Стьюдента и непараметрический тест Манна—Уитни. При анализе качественных показателей применяли критерий χ2. Количественные данные при нормальном распределении представлены в виде среднего и стандартного отклонения (М±SD). Многофакторный анализ проводили методом пошаговой логистической регрессии с вычислением отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Для оценки информативности построенной модели применяли расчет показателей информативности диагностического теста: диагностическая чувствительность, диагностическая специфичность. Качество модели логистической регрессии оценивали с помощью ROC-анализа. Показателем точности прогноза являлась площадь под ROC-кривой [15]. Статистически значимыми считали различия при p<0,05.
Статистическую обработку полученных данных проводили с помощью пакета статистических программ SPSS 12.0. Распределение переменных определяли с помощью критерия Колмогорова—Смирнова. Для выявлений различий между группами использовали парный t-критерий Стьюдента и непараметрический тест Манна—Уитни. При анализе качественных показателей применяли критерий χ2. Количественные данные при нормальном распределении представлены в виде среднего и стандартного отклонения (М±SD). Многофакторный анализ проводили методом пошаговой логистической регрессии с вычислением отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Для оценки информативности построенной модели применяли расчет показателей информативности диагностического теста: диагностическая чувствительность, диагностическая специфичность. Качество модели логистической регрессии оценивали с помощью ROC-анализа. Показателем точности прогноза являлась площадь под ROC-кривой [15]. Статистически значимыми считали различия при p<0,05.
Результаты и обсуждение
Все пациенты были разделены на 2 группы в зависимости от наличия или отсутствия ЖА высоких градаций, по данным ХМ. В 1-ю группу вошли 268 (28,7%) больных ЖА, 2-ю группу составили 665 (71,3%) пациентов без ЖА высоких градаций. Основные клинико-функциональные характеристики изучаемых групп больных представлены в табл. 1.
Больные 1-й группы по сравнению с пациентами 2-й группы были старше, имели более длительный анамнез по ИБС; кроме того, в этой группе статистически значимо чаще отмечались 2 перенесенных ИМ и более. Однако статистически значимых межгрупповых различий по частоте выявления ИБС, а также по тяжести течения стенокардии напряжения выявлено не было. При сравнении обследованных групп по полу в 1-й группе отмечалось отчетливое преобладание мужчин. Следует отметить, что у больных с ЖА чаще встречалась тяжелая (III—IV ФК) ХСН по классификации Нью-Йоркской ассоциации сердца (NYHA).
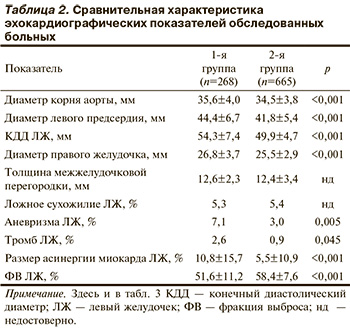
 При анализе показателей ЭхоКГ (табл. 2) установлено, что у пациентов 1-й группы была достоверно ниже средняя ФВ ЛЖ, а размер асинергии миокарда ЛЖ был достоверно бóльшим. Следует также отметить, что средняя ФВ ЛЖ в группе больных ЖА была ниже нормы [16]. Кроме того, у пациентов 2-й группы размер левого предсердия (ЛП), а также конечный диастолический диаметр (КДД) ЛЖ были достоверно больше, чем у больных 2-й группы. По данным ЭхоКГ, у больных 1-й группы аневризма и тромб ЛЖ встречались достоверно чаще, чем во 2-й группе. Диаметр правого желудочка, а также диаметр корня аорты были статистически значимо больше в 1-й группе, но не выходили за пределы нормы [16].
При анализе показателей ЭхоКГ (табл. 2) установлено, что у пациентов 1-й группы была достоверно ниже средняя ФВ ЛЖ, а размер асинергии миокарда ЛЖ был достоверно бóльшим. Следует также отметить, что средняя ФВ ЛЖ в группе больных ЖА была ниже нормы [16]. Кроме того, у пациентов 2-й группы размер левого предсердия (ЛП), а также конечный диастолический диаметр (КДД) ЛЖ были достоверно больше, чем у больных 2-й группы. По данным ЭхоКГ, у больных 1-й группы аневризма и тромб ЛЖ встречались достоверно чаще, чем во 2-й группе. Диаметр правого желудочка, а также диаметр корня аорты были статистически значимо больше в 1-й группе, но не выходили за пределы нормы [16].
По результатам логистического регрессионного анализа, статистически значимыми показателями для прогноза развития ЖА высоких градаций являются возраст, увеличение КДД ЛЖ и снижение ФВ ЛЖ (табл. 3).
На основании полученных данных вероятность развития ЖА, при точке разделения 0,212, может быть рассчитана по формуле, которая для данной выборки имеет вид: P=-4,216+(-0,048) EF+0,082 × LV+0,032 × возраст, где Р — вероятность развития ЖА; EF — фракция выброса ЛЖ, LV — диаметр ЛЖ. Чувствительность и специфичность модели составили 78 и 49,5% соответственно. Площадь под ROC-кривой в модели предикторов ЖА высоких градаций составила 0,713 (95% ДИ от 0,67 до 0,75; p<0,001) (см. рисунок), что свидетельствует о хорошем качестве построенной модели.
Отсутствие значимых межгрупповых различий по исходной медикаментозной терапии свидетельствует о том, что возможное влияние препаратов на ЖА было сопоставимо.
Проблема угрожающих жизни аритмий — одна из наиболее актуальных в кардиологии. Для врачей клинической практики важной задачей является поиск факторов, способных выявить и достоверно прогнозировать возможность развития угрожающих жизни НРС. В ряде работ показано, что курение, прием алкоголя в высоких дозах, артериальная гипертония, сахарный диабет увеличивают случаи ВСС по причине ЖА [17—19], однако имеют низкую прогностическую ценность, а, следовательно, не могут использоваться в качестве критериев стратификации риска ВСС [7].
Одним из основных факторов, повышающих риск возникновения аритмий, является возраст, при увеличении которого прогрессируют склеротически-дегенеративные процессы в миокарде и проводящей системы сердца, возрастает количество экстракардиальной патологии, что приводит к формированию аритмогенного субстрата. Эти наблюдения нашли отражение и в нашем исследовании: пациенты 1-й группы были достоверно старше, а возраст являлся независимым предиктором развития ЖА. При вычислении ОШ установлено, что каждый последующий год жизни увеличивал риск возникновения ЖА на 1,2%.
Полученные нами результаты свидетельствуют о том, что ЖА чаще регистрировались у больных с увеличенным КДД ЛЖ и сниженной ФВ ЛЖ. Кроме того, установлена независимая связь между этими параметрами и наличием ЖА высоких градаций, иными словами, диаметр ЛЖ и ФВ являлись предикторами развития ЖА. По результатам многофакторного анализа установлено, что при увеличении размеров полости ЛЖ на 1 мм риск развития ЖА возрастает на 4,2%, в то время как при снижении ФВ ЛЖ на 1% — увеличивается на 7%. Полученные результаты согласуются с результатами ранее проведенных исследований, в которых показано, что нарушение функции ЛЖ ассоциировалось с увеличением частоты эпизодов ЖТ и ВСС по причине аритмий [20, 21].
В настоящее время одним из основных эффективных методов лечения ВСС является применение ИКД. Согласно современным рекомендациям, при отборе кандидатов для имплантации этих устройств основной упор делается на ФВ ЛЖ≤35% (класс рекомендаций I) [22]. Однако результаты исследований, полученные ранее, продемонстрировали низкую специфичность (54%) сниженной ФВ ЛЖ (<40%) в прогнозировании аритмических осложнений и свидетельствовали о том, что ФВ≤40% не следует использовать в качестве основного и единственного критерия в отборе пациентов для имплантации ИКД [23]. По нашим данным, у больных с ЖА ФВ ЛЖ ниже 35% отмечалась лишь в 4,3% случаев, что свидетельствует об относительности этого критерия. Иными словами, только величина ФВ ЛЖ недостаточна для прогнозирования опасных для жизни ЖА, однако в сочетании с дилатацией ЛЖ прогностическая ценность этого показателя значительно возрастает.
Ранее показано, что ВСС является, по сути, главной причиной смертности больных ХСН. В зависимости от выраженности недостаточности кровообращения от 33 до 64% больных ХСН умирают по причине ВСС из-за фатальных НРС [24]. Более 90% больных ИБС с ХСН II—IV ФК имеют выраженные ЖА [25]. По нашим данным, у больных с ЖА достоверно чаще наблюдалась ХСН ФК III—IV, что согласуется с результатами других авторов. В настоящее время ИКД-терапия как самостоятельно, так и в сочетании с ресинхронизирующей терапией (РТ) является стандартом лечения больных ХСН. Имеются данные о том, что РТ дает антиаритмический эффект, оказывая положительное влияние на частоту возникновения фатальных аритмий [26]. Снижение ФВ ЛЖ является обязательным условием для проведения РТ [27, 28]. В ряде ранних многоцентровых исследований в качестве дополнительного критерия отбора больных для РТ использовалось увеличение КДД ЛЖ, при этом в качестве отрезной точки брались различные величины этого показателя [29]. Однако с 2005 г. после утверждения европейских показаний к РТ [27] увеличение КДД ЛЖ не используется в качестве критерия отбора. Согласно результатам нашего исследования, размер ФВ ЛЖ и КДД ЛЖ — параметры, независимо связанные с ЖА, в связи с чем можно сделать вывод, что КДД ЛЖ целесообразно учитывать как вспомогательный критерий при отборе кандидатов для РТ-ИКД-терапии.
Размеры ЛП в обеих группах превышали норму [16], однако в группе ЖА размер полости ЛП был достоверно больше, что, вероятно, обусловлено наличием более выраженной дисфункции ЛЖ как следствие перенесенных ИМ и постинфарктного ремоделирования левых отделов сердца.
Известно, что вследствие некротического повреждения сердечной мышцы происходит «выключение» части миокарда из эффективной работы сердца, а это приводит к значительным изменениям массы сердечной мышцы, формы и размеров полостей сердца, снижению силы сокращения ЛЖ [30]. Выявленные у больных 1-й группы более низкая ФВ ЛЖ, больший размер асинергии миокарда ЛЖ и бóльшая частота формирования аневризмы ЛЖ свидетельствуют о процессах ремоделирования сердца, которые тесно связаны с НРС и лежат в основе угрожающих ЖА и ВСС [31].
По нашему мнению, при ИБС, перенесенном ИМ, сопровождающихся даже незначительным снижением ФВ ЛЖ и умеренной дилатацией ЛЖ, чрезвычайно актуальны проведение 24-часового ХМ и более детальное обследование больных с целью выявления аритмических осложнений. Особенно если речь идет о пациентах старшей возрастной группы, нуждающихся в более интенсивном наблюдении и лечении.
Заключение
Таким образом, у больных, направленных на коронарографию, в качестве независимых предикторов развития желудочковых аритмий высоких градаций идентифицированы снижение фракции выброса левого желудочка, увеличение конечного диастолического диаметра левого желудочка и возраст.



