Внезапная сердечная смерть (ВСС) — одна из самых частых причин кардиальной летальности. В США ВСС уносит ежегодно около 325 000—350 000 жизней [1], что составляет 50—100 случаев на 100 000 населения [2]. В России ежегодная частота внезапных смертей составляет приблизительно 200 000—250 000 случаев [3]. Эта цифра несколько ниже мировых данных. Но, учитывая имеющиеся в нашей стране трудности в оказании экстренной помощи, обусловленные в первую очередь большими расстояниями и низкой плотностью населения в большинстве российских регионов, можно предполагать, что реальная частота ВСС, включая незарегистрированные случаи, значительно превышает данные американских и европейских регистров. Как известно, наиболее частой причиной ВСС служат желудочковые тахиаритмии, развившиеся на фоне ишемической болезни сердца (ИБС), и особенно часто – острого коронарного синдрома, в том числе как первого проявления заболевания. Интересны результаты статистического исследования заболеваний сердца и инсультов («Heart Disease and Stroke Statics — a 2013 update»), по данным которого, Россия лидирует по уровню смертности от коронарного атеросклероза среди других стран мира, в несколько раз опережая европейские страны и США [4]. Несмотря на огромный прогресс в оказании неотложной помощи за последние десятилетия, выживаемость после эпизодов злокачественных аритмий даже в экономически развитых странах не превышает 5% [5].
В настоящее время наиболее эффективным способом профилактики ВСС является имплантация кардиовертера-дефибриллятора (КВД) пациентам из группы высокого риска. Приборы, изобретенные в 1969 г. и впервые имплантированные человеку в 1980 г., в настоящее время широко и успешно применяются для первичной и вторичной профилактики ВСС [6]. Однако антиаритмические устройства способны помочь лишь небольшому числу больных, у которых высокий риск ВСС может быть определен до первого эпизода угрожающей жизни аритмии [2].
Накоплено немало данных о самых разных потенциальных предикторах ВСС, в том числе неинвазивных показателях электрической нестабильности миокарда; биохимических маркерах воспаления, повреждения, перегрузки миокарда; параметрах современных методов визуализации [7]. Однако на практике для отбора пациентов на имплантацию КВД с целью первичной профилактики ВСС используется лишь несколько показателей. Согласно действующим национальным (ВНОА, 2013) и международным рекомендациям (ACCF/AHA/HRS, 2012), это — перенесенный инфаркт миокарда — ИМ (не менее 40 дней назад); фракция выброса (ФВ) левого желудочка (ЛЖ) ≤35%; сердечная недостаточность II—III функционального класса (ФК) по классификации NYHA (или ФВ ЛЖ ≤30% и I ФК по классификации NYHA) (класс I, уровень доказанности А) [1, 8].
Небольшое число предикторов определяет относительно широкий круг больных, нуждающихся в антиаритмическом устройстве. При этом клинико-терапевтические показания ограничены финансово-экономическими сложностями. Несмотря на то что имплантация КВД снижает смертность у больных с низкой ФВ ЛЖ [9, 10], при долгосрочном наблюдении за этими пациентами выявлены ограничения современного подхода к отбору кандидатов на имплантацию КВД [11]. В связи с перечисленными сложностями проблема стратификации риска ВСС остается нерешенной. Отсутствие данных о первичной профилактике среди российских исследований говорит само за себя. Так, согласно данным ведущей российской аритмологической клиники — Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН, все 165 аппаратов КВД, имплантированные 117 пациентам с 1993 г. по 2004 г., были направлены на вторичную профилактику ВСС [6]. С 2005 г. по 2008 г. этими же авторами с целью первичной профилактики были выполнены 22 имплантации [12]. Совершенно очевидна необходимость новых предикторов ВСС, позволяющих изменить подход к первичной профилактике и сделать ее более доступной. Первоочередной задачей являются совершенствование и оптимизация неинвазивных методов стратификации факторов риска.
Материал и методы
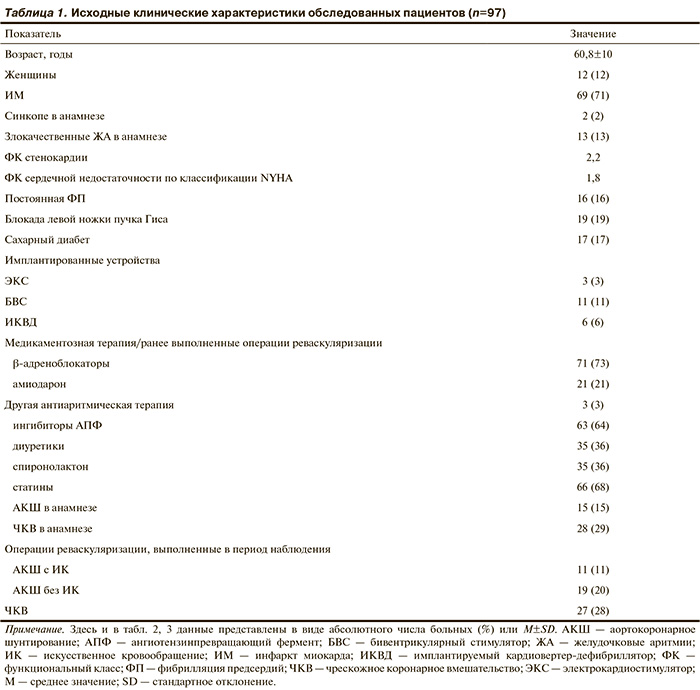
Характеристики пациентов. Обследованы 108 пациентов с ИБС в возрасте от 38 до 81 года, находившихся на стационарном лечении и амбулаторном обследовании в отделении неинвазивной аритмологии и хирургического лечения комбинированной патологии или отделении малоинвазивного хирургического лечения ИБС НЦ ССХ им. А.Н. Бакулева РАМН в период с марта 2009 г. по апрель 2011 г. Диагноз верифицирован на основании данных коронарографии. Средний период наблюдения составил 25±11 мес. Все пациенты дали информированное согласие на участие в исследовании. После выписки из стационара длительно наблюдались 97 пациентов, которые и составили основную исследуемую группу. По причине потери регулярного контакта с клиникой из исследования выбыли 11 человек, дальнейшая судьба их неизвестна. У 61% пациентов диагностирована сердечная недостаточность II—III ФК по NYHA, признаки сердечной недостаточности (ФК 0) отсутствовали у 26%. Средняя ФВ ЛЖ составила 50±13%, у 20% пациентов — ≤35% (табл. 1, 2). ИМ перенесли 69 (71%) пациентов, у 14% имелась постинфарктная аневризма левого желудочка; у 4% — состояние после хирургической аневризмопластики, выполненной до включения в исследование.
По данным коронарографии, у 49% пациентов имелись многососудистое поражение коронарных артерий (КА), у 29% — гемодинамически значимые стенозы 2 КА, у 22% — стеноз одной артерии, у 17% — поражение ствола левой КА. Аортокоронарное шунтирование (АКШ) в анамнезе имелось у 15% больных; 31% больных перенесли АКШ в течение периода наблюдения. Коронарная ангиопластика была выполнена 29% больным, 28% перенесли стентирование в течение периода наблюдения. Таким образом, в период наблюдения операциям реваскуляризации подверглись 62 из 108 пациентов; под длительным наблюдением находились 57 из них. Изолированную медикаментозную терапию получали 11% больных.
В исследуемую группу вошли 13 (13%) пациентов, перенесших злокачественные аритмии (фибрилляцию желудочков или устойчивую желудочковую тахикардию); у 6 из них имелись имплантированные антиаритмические устройства. На момент обследования 21 (22%) пациент постоянно принимал амиодарон и 3 (3%) — другие антиаритмические средства; 73% пациентов находились на постоянной терапии β-адреноблокаторами.

Критериями включения в исследование были: ИБС; данные коронарографии не более 2-летней давности или выполненной в течение периода наблюдения; регулярный контакт пациента с клиникой. Критериями исключения считались острый коронарный синдром давностью менее 40 дней, врожденные пороки сердца, тяжелые приобретенные пороки сердца, синдром предвозбуждения желудочков, врожденные синдромы удлиненного или укороченного интервала QT, медикаментозное удлинение интервала QT (более 500 мс при стандартной электрокардиографии).
Всем пациентам была выполнена стандартная эхокардио-графия с вычислением диастолических размеров и объемов ЛЖ; размеров левого предсердия (ЛП); ФВ ЛЖ; митральной регургитации; зон нарушения локальной сократимости миокарда.
Расчет турбулентности ритма сердца (ТРС). Наряду с другими показателями электрической нестабильности миокарда ТРС определяли при 24-часовом холтеровском мониторировании (ХМ) электрокардиограммы (ЭКГ) с использованием 3- или 12-канальных рекордеров и программного обеспечения системы Astrocard (ЗАО «Медитек», Россия). Для расчета ТРС были использованы участки ЭКГ, содержащие 3—5 синусовых интервалов RR, идущих подряд до желудочковой экстрасистолы (ЖЭ), и 15—20 интервалов, следующих за компенсаторной паузой. Из анализа исключали следующие интервалы RR:<300 мс; >2000 мс; имеющие разницу между предшествующими синусовыми интервалами >200 мс; имеющие отличие >20% от среднего из 5 последовательных синусовых интервалов. Кроме того, к оценке ТРС допускали только ЖЭ с индексом преждевременности >20% и постэкстрасистолическим интервалом, который был длиннее среднего RR на 20% и более.
 В качестве математического эквивалента ТРС использовали 2 показателя: turbulence onset (ТO), или начальное учащение ритма, и turbulence slope (TS) — линия постепенного возвращения частоты ритма к исходным величинам в течение 20 следующих за ЖЭ циклов. Расчет параметров производился следующим образом:
В качестве математического эквивалента ТРС использовали 2 показателя: turbulence onset (ТO), или начальное учащение ритма, и turbulence slope (TS) — линия постепенного возвращения частоты ритма к исходным величинам в течение 20 следующих за ЖЭ циклов. Расчет параметров производился следующим образом:
TO = [(RR1 + RR2) – (RR2’ + RR1’)] / (RR2’ + RR1’) × 100, где RR2’ и RR1’ — два интервала перед ЖЭ, а RR1 и RR2 — первые два интервала, следующие за ЖЭ.
TS соответствует величине наклона линейной регрессии для каждой последовательности из 5 циклов, следующих за ЖЭ.
Показатели ТРС были измерены автоматически для каждой ЖЭ и представлены средним значением со стандартным отклонением. Средние значения были получены отдельно для дневного и ночного периодов и в целом за сутки. Патологическими считали среднесуточные значения ТО ≥0 и TS ≤2,5 мс/RR. В последующий анализ данные были включены в виде патологических или нормальных значений.
Другие неинвазивные электрофизиологические тесты. Помимо ТРС при ХМ были рассчитаны следующие неинвазивные электрофизиологические показатели:
- микровольтная альтернация Т-волны (MTWA);
- показатели ЭКГ высокого разрешения (ЭКГ-ВР):
- поздние желудочковые потенциалы;
- fQRS — длительность фильтрованного интервала QRS (мс);
- HFLA (мс) — high frequency low amplitude signal — длительность высокочастотных низкоамплитудных сигналов (<40 мВ) в конце желудочкового комплекса;
- fP — длительность фильтрованной Р-волны (мс);
- длительность корригированного интервала QT (мс) и его суточная динамика;
- показатели вариабельности ритма сердца (ВРС):
- SDNN (мс) — стандартное отклонение всех интервалов NN;
- SDANN (мс) — стандартное отклонение интервалов NN, усредненное за каждые 5-минутные интервалы;
- pNN50 (%) —доля интервалов NN, которые отличаются от предшествующего интервала более чем на 50 мс.
Методология выполнения расчетов каждого из указанных показателей и критерии оценки результатов представлены в предыдущих публикациях [7].
Расчет мозгового натрийуретического пептида (BNP). Измерение концентраций BNP выполняли в плазме крови. Для получения плазмы пробы крови забирали в пробирки с ЭДТА, после чего тщательно перемешивали путем переворачивания пробирок. Затем пробы центрифугировали со скоростью 1000 об/мин в течение 10 мин. Анализ проводили сразу после получения пробы иммуноферментным методом на аппарате Architect i1000sr («Abbott», CША).
Из других лабораторных показателей в анализ были включены креатинин и С-реактивный белок в сыворотке крови; NT-proBNP; тропонин Т в плазме. Клиренс креатинина рассчитывали по формуле MDRD.
Конечные точки. Наблюдение за пациентами осуществлялось при телефонном опросе или при очной консультации, по крайней мере, каждые 6 мес. Конечными точками исследования послужили развитие угрожающих жизни аритмий, а именно: ВСС, успешные реанимационные мероприятия, разряд КВД или кратковременные синкопальные состояния, в том числе те, аритмическая природа которых не была подтверждена с помощью ЭКГ.
У умерших пациентов причину смерти верифицировали на основании клинических данных и результатов ауто-псии. В случае смерти вне стационара проводили подробный опрос родственников об обстоятельствах смерти и предшествующем состоянии больного. К ВСС относили случаи смерти, развившиеся в течение 1 ч после начала острых симптомов без предшествующего ухудшения состояния. В анализ были включены эпизоды кратковременной потери сознания без зарегистрированной ЭКГ, случившиеся при свидетелях, без предшествующего ухудшения состояния у пациентов без сопутствующих нарушений проводимости и/или фибрилляции предсердий.
Статистический анализ. Статистическая обработка данных выполнена на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel, и пакета прикладных программ IBM SPSS Statistics v. 21.0. Для каждого количественного параметра были определены среднее значение (М) и среднеквадратическое отклонение (SD); для качественных данных рассчитаны частоты (%). Для сравнения числовых данных использовали критерий t Стьюдента для 2 независимых выборок. Для сравнения непараметрических данных применяли критерий Манна—Уитни (для 2 групп) для несвязанных совокупностей. Для нахождения различий между качественными показателями использовали метод χ2 с поправкой Йетса на непрерывность, а также точный критерий Фишера для небольших выборок. Статистически значимыми считали различия при р<0,05. Отношение шансов (ОШ), отношение рисков (OP) возникновения опасных аритмий и их 95% доверительные интервалы рассчитывали по стандартным формулам. С целью определения «критических значений» для количественных показателей были построены характерологические кривые (ROC-кривые). Качество выбранной модели оценивали в зависимости от значения площади под кривой (AUC): 0,9—1,0 — отличное; 0,8—0,9 — очень хорошее; 0,7—0,8 — хорошее; 0,6—0,7 — среднее; ниже 0,6 — неудовлетворительное. Статистически значимой считали модель при р<0,05. Каждый из показателей, достоверно связанных с конечной точкой, подвергался анализу выживаемости при помощи метода Каплана—Мейера. Достоверность оценивали с помощью логрангового критерия. Все показатели, достоверно ассоциированные с аритмическими событиями при однофакторном анализе, были включены в многофакторный регрессионный анализ Кокса для выявления независимых предикторов.
Результаты
 Эпизоды аритмии в течение периода наблюдения. В течение среднего периода наблюдения 25±11 мес (от 1 до 45 мес) из 97 наблюдаемых больных умерли 15 (15%). Кардиальная летальность составила 8% (8 больных) — из них 3 (3%) умерли внезапно без предшествующего ухудшения состояния. Гемодинамически значимые желудочковые тахиаритмии были зарегистрированы у 8 (8%) пациентов, в том числе 4 (4%) пациента перенесли эффективные разряды КВД, 2 (2%) — успешные реанимационные мероприятия, и 2 (2%) — кратковременные эпизоды потери сознания без электрокардиографических данных. Таким образом, комбинированная конечная точка, включившая случаи ВСС и эпизоды угрожающих жизни аритмий, зарегистрирована у 11 (11%) пациентов.
Эпизоды аритмии в течение периода наблюдения. В течение среднего периода наблюдения 25±11 мес (от 1 до 45 мес) из 97 наблюдаемых больных умерли 15 (15%). Кардиальная летальность составила 8% (8 больных) — из них 3 (3%) умерли внезапно без предшествующего ухудшения состояния. Гемодинамически значимые желудочковые тахиаритмии были зарегистрированы у 8 (8%) пациентов, в том числе 4 (4%) пациента перенесли эффективные разряды КВД, 2 (2%) — успешные реанимационные мероприятия, и 2 (2%) — кратковременные эпизоды потери сознания без электрокардиографических данных. Таким образом, комбинированная конечная точка, включившая случаи ВСС и эпизоды угрожающих жизни аритмий, зарегистрирована у 11 (11%) пациентов.
Среди 62 оперированных больных в раннем послеоперационном периоде умерли 4: 2 — от осложнений острого кровотечения; один — в результате мезентериального тромбоза и один — от острой сердечной недостаточности. Острый тромбоз стента наблюдался в 2 случаях (среди 27 выполненных процедур ангиопластики), один из них закончился летально.
Данные инструментальных и лабораторных методов исследования. Согласно данным эхокардиографии, средняя ФВ ЛЖ в обследуемой группе варьировала от 22 до 75% и в среднем составила 50±13%. Доля больных с ФВ ЛЖ ≤35% достигала 20%. Средний КДО ЛЖ равнялся 171,5±61,2 мл; иКДО — 86,2±31,6 мл/м2 (см. табл. 2).
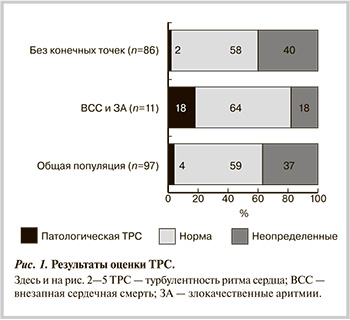
По данным ХМ, у 54% больных имелась желудочковая экстрасистолия высоких градаций по Lown. Результаты MTWA продемонстрировали довольно высокий процент неопределенных значений — 29%. Положительный результат отмечался чаще отрицательного (41 и 30% соответственно). Поздние желудочковые потенциалы были отмечены в 33% случаев. Сочетание патологических показателей ТО и TS (ТРС) зарегистрировано у 4% больных. Показатель ТО отличался от нормы значительно чаще — в 23% случаев (см. табл. 2). Следует отметить, что тест на ТРС удалось выполнить лишь у 64% больных, у остальных пациентов расчет был ограничен наличием постоянной формы фибрилляции предсердий, навязанным ЭКС ритмом или отсутствием ЖЭ (рис. 1). Средние значения биохимических показателей представлены в табл. 2.
Предикторы эпизодов аритмии в течение периода наблюдения. Согласно одномерному анализу, статистически значимо связаны со злокачественными аритмическими событиями, развившимися в течение 25±11 мес наблюдения, оказались следующие показатели: злокачественные аритмии или синкопе в анамнезе (р=0,02); чрескожное коронарное вмешательство (ЧКВ) в анамнезе (р=0,03); ФВ ЛЖ ≤47% (р=0,01); размер ЛП ≥4,7 см (р=0,03); индексированный размер ЛП (р=0,01); длительность fQRS (р=0,03); ТРС (χ2=6,2; р=0,01); патологический TS (χ2=9,5; р=0,002); BNP ≥158 пг/мл (р=0,003); NT-proBNP ≥787 пг/мл (χ2=4,4; р=0,04) (табл. 3). Критические значения для количественных показателей получены при построении ROC-кривых. ROC-анализ выполнен для всех показателей, имевших достоверные межгрупповые различия при сравнении средних величин. На рис. 2 (см. цв. вклейку) представлены ROC-кривые для ФВ ЛЖ и BNP. Результаты расчета микровольтной альтернации Т-волны, ВРС, поздних желудочковых потенциалов, продолжительности и суточной динамики интервала QT, а также таких биохимических показателей, как креатинин, клиренс креатинина, С-реактивый белок и тропонин Т, значимо не влияли на возникновение событий конечной точки.
Для выявления наиболее значимых предикторов был выполнен многофакторный регрессионный анализ Кокса, по результатам которого угрожающие жизни аритмии или синкопе в анамнезе, а также патологический тест на ТРС и уровень BNP ≥158 пг/мл оказались независимыми предикторами злокачественных аритмий в течение 45 мес наблюдения (р=0,001 для каждого из показателей).
На рис. 3 представлены кривые Каплана—Мейера, отображающие свободу от угрожающих жизни аритмий, в зависимости от 3 независимых факторов риска. Группа пациентов без злокачественных аритмий и синкопе в анамнезе, с нормальными уровнями BNP и ТРС составила 58% всех обследованных пациентов (n=56). Ежегодная частота изучаемых неблагоприятных исходов в этой группе оказалась крайне низкой и составила 0,9%. Промежуточная группа с одним патологическим показателем из 3 составила 35 (36%) больных. Ежегодная частота неблагоприятных аритмических исходов в этой группе составила 7,4%. Два патологических показателя из 3 наблюдались у небольшой группы пациентов — 6 (5%). Частота опасных аритмий у этих больных равнялась 44% в год. Все 3 патологических показателя одновременно не встречались ни в одном случае. Модель с одним фактором риска обладала чувствительностью 27%; специфичностью 65%; прогностической ценностью положительного результата теста 9% и прогностической ценностью отрицательного результата теста 97%. Чувствительность модели с двумя факторами риска составила 55, 99, 86 и 94% соответственно.
Сплошной линией обозначена кривая выживаемости при трех нормальных показателях (без злокачественных аритмий; нормальном тесте на ТРС и BNP ≤158 пг/мл). Пунктирной линией обозначена кривая выживаемости при патологическом значении одного из трех показателей. Точечной линией обозначена кривая выживаемости при патологических значениях двух показателей.
С целью оптимизации подхода к первичной профилактике угрожающих жизни аритмий был выполнен анализ свободы от аритмий в зависимости от выявленных независимых предикторов и фракции выброса ЛЖ ≤35% как основного показателя, влияющего на отбор кандидатов для имплантации антиаритмического устройства. На рис. 4 (см. цв. вклейку) представлены кривые Каплана—Мейера для пациентов, имеющих 1 из 2 дополнительных предикторов злокачественных аритмий — патологическую ТРС или BNP ≥158 пг/мл — и ФВ ЛЖ >35% (оранжевая кривая); ФВ ЛЖ ≤35% (красная кривая). Согласно тесту с применением логрангового критерия, две указанные кривые достоверно не отличаются друг от друга (р>0,05), что лишний раз наглядно доказывает, что пациенты, имеющие 1 дополнительный фактор риска и более, имеют высокий риск тяжелых аритмических событий, независимо от ФВ ЛЖ. При этом свобода от аритмий достоверно отличается между группами с факторами риска (красная и оранжевая кривая) и без них (синяя кривая) (р<0,01 в обоих случаях) (см. рис. 4 на цв. вклейке). Модель с 1 из 2 патологических тестов (ТРС или BNP) обладает чувствительностью 64%; специфичностью 74%, прогностической ценностью положительного результата теста 22% и прогностической ценностью отрицательного результата теста 98%.
Для оценки влияния дополнительных предикторов на возникновение опасных аритмий в группе пациентов с исходно высоким риском ВСС, т.е. с ФВ ЛЖ ≤35%, мы сравнили свободу от аритмий для пациентов с нормальными ТРС и BNP (кривая синего цвета на рис. 5, см. цв. вклейку) и имеющих 1 или более дополнительных предикторов — ТРС или BNP (кривая красного цвета). Согласно тесту с применением логрангового критерия, кривые статистически значимо отличались друг от друга (р<0,05). Более того, среди пациентов с ФВ ЛЖ ≤35%, не имеющих дополнительных предикторов угрожающих жизни аритмий (BNP или ТРС), не было зарегистрировано ни одного эпизода тяжелой аритмии.
Обсуждение
Оптимизация современного подхода к отбору кандидатов для имплантации антиаритмических устройств обусловливает необходимость поиска новых, доступных, неинвазивных и, главное, диагностически надежных предикторов. Не вызывает сомнений польза имплантируемых КВД в отношении вторичной профилактики ВСС. Это подтвердили крупные рандомизированные испытания, посвященные данному вопросу (AVID, CASH, CIDS). В нашем исследовании пациенты, перенесшие в прошлом злокачественные аритмии или эпизоды потери сознания, также имели высокий риск возникновения угрожающих жизни аритмий, независимо от других факторов. Поскольку все антиаритмические устройства среди наших больных были установлены для вторичной профилактики ВСС, наличие КВД также ассоциировалось с развитием желудочковых тахиаритмий в течение периода наблюдения (ОР 39,1 при 95% ДИ от 5,0 до 304,7; р<0,0001).
Что касается прогнозирования опасных аритмий у пациентов, не переносивших подобных эпизодов ранее, в настоящем исследовании были выявлены два независимых предиктора: патологический тест на ТРС и уровень BNP в плазме ≥158 пг/мл. Прогностическая модель, включившая хотя бы один из двух предикторов, обладала достаточной прогностической ценностью отрицательного результата теста для выявления пациентов с низким риском возникновения желудочковых тахиаритмий.

ТРС фактически служит отражением барорефлекторной чувствительности, т.е. изменения частоты ритма сердца в ответ на колебания артериального давления. В норме ЖЭ сопровождается резким укорочением интервалов RR (первые 2—4 комплекса после экстрасистолы), вероятно, вследствие некоторого снижения артериального давления с последующим постепенным их удлинением (за 5—20 сердечных циклов). Влияние патологической ТРС на кардиальную летальность и угрожающие жизни аритмии у постинфарктных больных было неоднократно показано в современных испытаниях. Значение ТРС в числе других показателей вегетативной дисфункции (барорефлекторной чувствительности, ВРС) у больных с недавно перенесенным ИМ (<28 дней) было показано в исследовании ATRAMI [13, 14]. Показатель TS и его комбинация с TO значительно повышали риск развития фатальных и нефатальных желудочковых тахиаритмий (ОР 4,1 и 6,9 соответственно; р<0,0001 в обоих случаях). В дальнейшем клинические исследования, посвященные изучению восстановления вегетативной регуляции ритма сердца после перенесенного ИМ: REFINE (Risk Estimation Following Infarction, Noninvasive Evaluation), CARISMA (Cardiac Arrhythmias and Risk Stratification After Acute Myocardial Infarction), ISAR-Risk (Improved Stratification of Autonomic Regulation for risk prediction), продемонстрировали прогностическое значение показателей ТРС в отношении угрожающих жизни аритмий в более поздние сроки после ИМ [15—18]. В нескольких последующих исследованиях ТРС и количественный метод определения альтернации Т-волны — TWA-MMA, являлись независимыми предикторами как кардиальной летальности, так и фатальных аритмий при длительном наблюдении среди постинфарктных больных [19, 20].
Таким образом, неблагоприятные последствия нарушенной вегетативной регуляции ритма сердца у пациентов после ИМ, продемонстрированные как в клинических, так и в экспериментальных исследованиях [21], можно считать доказанными. Однако в нашем исследовании ИМ в анамнезе имелся у 77 (68%) пациентов. Вероятно, этим объясняется ограниченная роль других показателей вегетативного контроля ритма сердца, таких как суточная ВРС, и интервала QT в отношении прогноза у наших больных. Тем не менее ТРС оказывает влияние на неблагоприятные события в отдаленном периоде наблюдения и сохраняет свое значение в отношении опасных аритмий при многофакторном регрессионном анализе Кокса (р<0,01).
Наиболее заманчивым направлением в области прогностических исследований, особенно популяционных, является изучение биохимических маркеров. Именно лабораторные исследования были бы максимально удобны при диспансерном обследовании популяции в целом для выявления лиц, подверженных риску ВСС. Наиболее изученными в этом отношении являются нейрогуморальные показатели — мозговые натрийуретические пептиды, показавшие свою эффективность в отношении прогнозирования тяжелых аритмий в ряде небольших исследований. Согласно крупному мета-анализу этих работ, включивших более 4500 пациентов, повышенный уровень BNP (или NT-proBNP) служит маркером ВСС у широкого круга больных без КВД и злокачественных желудочковых аритмий после имплантации КВД [22]. У пациентов без КВД повышенный уровень BNP/NT-proBNP сопровождается повышением риска ВСС почти в 4 раза, при имеющемся заболевании сердца риск возрастал более чем в 4,5 раза. У пациентов с имплантированными антиаритмическими устройствами наблюдалось более чем двукратное увеличение риска эффективных разрядов при BNP/NT-proBNP выше нормы. Следует отметить, что критические уровни натрийуретических пептидов для прогнозирования желудочковых аритмий и внезапной смерти сильно варьируют от исследования к исследованию: от 187 до 265 пг/мл для BNP и от 130 до 4500 пг/мл для NT-proBNP по данным крупного мета-анализа 6 испытаний, включившего 3543 пациентов [22]. Вероятно, BNP является более воспроизводимым показателем. В недавнем израильском исследовании, включившем 94 пациентов с ишемической дисфункцией ЛЖ и имплантированным КВД, повышенный уровень BNP также служил единственным независимым предиктором желудочковых тахиаритмий в течение 3,5 года наблюдения [23].
Результаты спектрального метода расчета микровольтной альтернации Т-волны, поздние желудочковые потенциалы, среднесуточная длительность и динамика корригированного интервала QT, ВРС, согласно результатам нашего исследования, не влияют на возникновение опасных аритмических осложнений, в том числе ВСС, в течение 2-летнего периода наблюдения. Не влияют на аритмические осложнений также такие биохимические показатели, как креатинин сыворотки, клиренс креатинина, тропонин Т и С-реактивный белок.
Ограничения исследования
Относительно небольшое число неблагоприятных аритмических событий, зарегистрированных за время наблюдения. Для изучения предикторов ВСС требуются большее число больных и более длительный период наблюдения.
Клиническая гетерогенность набранной группы больных.
Изменяемость параметров во времени. У пациентов, перенесших реваскуляризацию, все изучаемые параметры оценивались однократно до операции.
В наше исследование были включены пациенты с постоянной или пароксизмальной фибрилляцией предсердий, нарушениями проведения по правой или левой ножкам пучка Гиса, с имплантированными устройствами, в том числе с постоянно навязанным ритмом. Таким больным выполнялось стандартное ХМ без дополнительного анализа альтернации Т-волны, ТРС и ВПС, динамики интервала QT и вычисления показателей ЭКГ высокого разрешения (ЭКГ ВР). Результаты теста на MTWA у таких больных считались неопределенными.
Заключение
В отношении развития внезапных желудочковых тахи-аритмий при 2-летнем наблюдении больных со стабильной формой ишемической болезни сердца в настоящем исследовании выявлено 3 независимых предиктора: злокачественные аритмии или синкопе в анамнезе; турбулентность ритма сердца и уровень мозгового натрийуретического пептида в плазме ≥158 пг/мл. Два последних показателя крайне интересны с точки зрения совершенствования подхода к первичной профилактике внезапной сердечной смерти. Пациенты, имеющие положительным хотя бы один из двух названных параметров, обладали повышенным риском развития злокачественных нарушений ритма, независимо от фракции выброса левого желудочка — основного стратифицирующего фактора риска, согласно действующим рекомендациям. Эти простые в исполнении, недорогие и неинвазивные тесты могли бы стать дополнительными стратифицирующими факторами при отборе кандидатов для имплантации кардиовертера-дефибриллятора с целью первичной профилактики внезапной сердечной смерти.
Статья опубликована при поддержке гранта Правительства Российской Федерации для государственной поддержки научных исследований, проводимых под руководством ведущих ученых в российских научных учреждениях и государственных научных центрах Российской Федерации «Молекулярные механизмы фибрилляции предсердий» (№ 14.Z50.31.0026)



