В течение последних 30—40 лет в индустриально развитых странах достигнуто значительное, а в ряде стран многократное снижение заболеваемости и смертности от сердечно-сосудистых заболеваний (ССЗ), в том числе от ишемической болезни сердца (ИБС). Эта положительная тенденция связана не только с высоким уровнем лечения ИБС, но и, в первую очередь, с проведением мероприятий первичной профилактики, дающих наиболее выраженный популяционный эффект [1, 2]. Тем не менее даже в этих странах ИБС остается основной причиной смерти среди всех заболеваний, составляя около 50% всей смертности от ССЗ [3]. В связи с этим у многих специалистов возникает вопрос о том, каковы пути дальнейшего совершенствования подходов к предупреждению ИБС.
В Российской Федерации смертность от ИБС в конце 2000-х годов (426 на 100 тыс.) значительно превосходила таковую в Северной Америке и большинстве европейских стран (144 на 100 тыс. в США, 100—150 на 100 тыс. в Южной и Центральной Европе) [4, 5]. Это отражает общемировую тенденцию к снижению смертности от данного заболевания в экономически развитых странах и повышению ее в странах развивающихся и находящихся в «переходной» стадии развития. Согласно прогнозу к 2020 г. на долю последних будет приходиться 7,8 млн из 11 млн. случаев смерти от ИБС во всем мире [3]. В связи с этим проблемы первичной профилактики ИБС чрезвычайно актуальны для нашей страны.
Первичная профилактика ИБС заключается в мероприятиях по коррекции традиционных факторов риска (ФР) в популяции, а также в выявлении лиц с высоким риском развития ССЗ и проведении у них активной профилактики, в том числе медикаментозной («стратегия высокого риска») [1]. Однако, если взаимосвязь традиционных ФР и ИБС, целесообразность и эффективность существующих подходов к воздействию на ФР в популяции не вызывает сомнений, то стратегии индивидуального выявления высокого риска, а более точно, прогнозирования развития ССЗ у конкретного пациента, эффективны не во всех случаях и являются предметом дискуссии.
В обзоре обсуждаются основные подходы к индивидуальному прогнозированию риска развития ССЗ и рассматриваются их возможности и недостатки.
Использование отдельных согласованных ФР в прогнозировании ИБС
Атеросклероз является полиэтиологичным заболеванием, а разнообразных ФР развития атеросклероза, и, соответственно, ИБС, насчитывается более 200. Хорошо известен ряд важнейших (традиционных) ФР, включенных в наиболее распространенные количественные шкалы и разработанные на их основе «калькуляторы» индивидуального риска.
Крупнейшие популяционные исследования показали выраженную прямую корреляцию между концентрацией общего холестерина (ОХС) в крови и смертностью от ИБС [6]. Аналогичная прямая зависимость доказана для всех уровней повышенного систолического и диастолического АД при совокупном анализе 61 проспективного исследования с участием более 1 млн. пациентов [7, 8]. В исследовании INTERHEART выявлено 6 основных модифицируемых ФР: дислипидемия, курение, артериальная гипертензия (АГ), абдоминальное ожирение, психосоциальные факторы (стресс, социальная изоляция, депрессия), сахарный диабет (СД). Было выделено и 3 фактора антириска: достаточное потребление овощей и фруктов, регулярный прием малых доз алкоголя и регулярная физическая активность. Воздействием этих 9 факторов объяснялось 90% случаев инфаркта миокарда (ИМ) у мужчин и 94% случаев у женщин независимо от региона [9]. Фактором высокого риска развития ИБС считается хроническая болезнь почек [10].
Р. Greenland и соавт. [11] проанализировали 3 крупнейших проспективных когортных исследования, в том числе MRFIT и Фрамингемское, включавшие в целом более 70 тыс. пациентов. Изучалось наличие хотя бы одного ФР (СД, курение, ОХС более 6,2 ммоль/л, АД более 140/90 мм рт.ст.) у пациентов, впоследствии умерших от ИБС или перенесших нефатальный ИМ. У больных, умерших от ИБС, хотя бы 1 ФР выявлялся в 87—100% случаев. У пациентов, перенесших впоследствии нефатальный ИМ, 1 ФР выявлялся в 92% случаев у мужчин и в 87% у женщин. Авторы делают вывод о том, что традиционными ФР объясняются большинство случаев ИБС.
Тем не менее в крупных проспективных исследованиях выявлено значительное сопоставление групп здоровых лиц и людей, у которых развивается ССЗ, в частности ИБС, по исходному уровню основных принимаемых в расчет ФР. В связи с этим выделить среди больных в отсутствие симптомов заболевания тех, у кого заболевание может развиться, и тех, кому оно не угрожает, используя ФР в качестве предикторов, затруднительно.
Этот факт обращает внимание даже при анализе данных, которые использовались при разработке шкалы SCORE: в то время как значения важнейших ФР в странах с высоким и низким риском развития ССЗ не имели закономерных различий, уровень ССЗ и смертности от ИБС различался в разы [12].
В проспективном исследовании BUPA (21 520 мужчин) [13] проведено сравнение лиц, умерших от ИБС, с соответствующей по возрасту группой контроля в отношении основных общепринятых ФР, а также уровня основных апобелков липопротеинов. Авторы продемонстрировали ожидаемую взаимосвязь между смертностью от ИБС и уровнем ФР (липопротеины, АД, курения). В то же время разница между распределением ФР в группе лиц с ИБС и контролем оказалась очень мала. Спектры распределения ФР у больных и здоровых в значительной степени накладывались друг на друга (рис. 1).
В результате в качестве предикторов индивидуального прогноза изучаемые ФР оказались неэффективными. Авторы рассчитали прогностическую ценность каждого ФР как процент случаев смерти от ИБС среди лиц с положительным результатом скрининга на данный ФР. Для ОХС она составила 11,6%, для апо-В — 17%. Суммарная прогностическая ценность комбинации изучавшихся ФР составила 28%. Это означает, что в большом числе случаев у лиц, имеющих ФР, изучаемое событие не развивалось, что свидетельствует о низкой специфичности ФР при их использовании для прогнозирования ИБС. Чтобы измерить распределение уровня риска события (смерти от ИБС) в популяции, авторы определяли отношение риска при уровне ФР, соответствующем 90-му процентилю распределения, к его риску при уровне ФР, соответствующем 10-му процентилю (RO10—90). Этот показатель при оценке сочетания всех ФР был равен 13. Авторы отмечают, что для достижения прогностической ценности 50%, RO10—90 должен быть равен 68, что гораздо выше, чем его наблюдаемые значения для любых «больших» ФР в популяции или их сочетаний.
Эти результаты согласуются с анализом уже упоминавшейся работы Р. Greenland и соавт. [11], проведенным А.Weissler [14]. Автор рассчитал соотношение частоты наличия предиктора среди лиц, у которых развилось прогнозируемое событие, к частоте наличия предиктора среди тех, у кого оно не развилось (отношение правдоподобия, ОП). Предиктором было наличие 1 ФР или более, прогнозируемым событием — смерть от ИБС или нефатальный ИМ. Такой способ позволяет оценить прогностическую ценность показателя (ФР) независимо от его распространенности. Показатель ОП находился в диапазоне 1,07—1,39, в то время как высокая прогностическая ценность характеризуется значениями ОП более 9,0. Таким образом, отмечает автор, исследование Р. Greenland и соавт. демонстрирует, что основные ФР действительно часто встречаются у больных ИБС, но они обладают довольно низкой прогностической ценностью у лиц без заболевания.
Расчет суммарного риска и его роль в прогнозировании ИБС
Ключевым элементом стратегии высокого риска является расчет «суммарного риска» на основании учета отдельных ФР у пациента с помощью различных предлагаемых для этого шкал, которых насчитывается более 100 [15]. Самые известные из них Фрамингемская шкала риска, или ФШР (США), шкала PROCAM (Германия), шкала UKPDS для пациентов с СД, европейская шкала SCORE в модификациях для популяций с низким и высоким риском развития ССЗ и др. При использовании шкал помимо модифицируемых принимают во внимание и хорошо известные немодифицируемые ФР: возраст, мужской пол, семейный анамнез ранней ИБС. Обязательный расчет суммарного риска в целях скринингового обследования для выявления ССЗ рекомендуют как зарубежные стандарты, так и Российские национальные рекомендации по профилактике ССЗ [1, 2, 16]. В России рекомендована шкала SCORE для популяций высокого риска. Уровень риска по шкале SCORE ≥5% считается высоким — обычно такой показатель наблюдается при наличии множественных ФР [1]. Тем не менее накапливаются данные о том, что расчет суммарного риска по шкалам с прогностической целью у лиц без ССЗ точен не во всех случаях.
Как указывают P. Brindle и соавт. [17], проанализировавшие результаты использования ФШР для прогнозирования риска развития заболеваний сердца в 27 исследованиях с суммарным участием более 71 тыс. пациентов, прогностическая точность ФШР непостоянна и зависит от уровня риска в исследуемой популяции. Применительно к риску развития ИБС отношение прогнозируемых случаев к фактически наблюдавшимся колебалось от 0,43 при 95% доверительном интервале (ДИ) от 0,27 до 0,67 в популяциях с высоким риском до 2,87 при 95% ДИ от 1,91 до 4,31 в популяциях с низким риском.
Сходные данные получены при анализе результатов использования шкалы SCORE, которое сопровождалось отношением фактически наблюдавшихся к прогнозируемым исходам от 0,53 до 3,24 в разных популяциях, несмотря на использование версий модели, соответствующих уровню риска страны [15]. Следует отметить, что добавление в модель SCORE холестерина липопротеидов высокой плотности (ХС ЛВП) практически не повышало ее ценности. Так, по данным, полученным в проекте SCORE, использование вместо ОХС отношения ОХС/ХС ЛВП в 98% случаев давало уровни риска, различающиеся не более чем на 1% 121].
T.H.S. Dent [18] объясняет полученные результаты применением изучавшейся шкалы риска в популяциях иных, нежели та, в которой она была разработана. Неточность прогноза он связывает с имеющимися различиями между популяциями, разной их восприимчивостью к действию ФР, отсутствием учета ряда мощных ФР (семейный анамнез, социально-экономические факторы). В связи с этим более адекватным было бы разработать отдельную шкалу риска для каждой страны (и для этого осуществить программу, адекватную по масштабу Фрамингемскому проекту) или рекалибровать стандартную шкалу с учетом имеющихся в стране тенденций заболеваемости ССЗ, распространенности ФР, лечебных вмешательств и т.д. [16, 19]. В случае РФ очевидна большая гетерогенность ее популяции в отношении перечисленных факторов, которая делает недостатки использования шкал риска трудно устранимыми.
Другой, и еще более важный аспект проблемы, связанной с использованием шкал, охарактеризовал анализ K.O. Akosah и соавт. [20]. У относительно молодых лиц (мужчины моложе 55 лет, женщины моложе 65 лет), у которых развился острый ИМ как первое проявление ИБС, был рассчитан риск по ФШР. Согласно полученным результатам лишь 25% пациентов до развития ИМ соответствовали бы критериям начала медикаментозной терапии дислипидемии. Аналогичным образом, по данным исследования NHANES, в 74,9% случаев острые осложнения ИБС развивались у лиц, имеющих низкий расчетный риск по ФШР, а у женщин 95% случаев первого ИМ происходило в группе низкого расчетного риска [21].
Эти данные свидетельствуют о возможности выраженной недооценки вероятности развития ИБС при скрининговом обследовании пациентов с расчетом суммарного риска по стандартной шкале. Первичные коронарные исходы нередко происходят у лиц с низким расчетным уровнем риска, к которым относится большинство обследуемых относительно молодого возраста, особенно женщин. Следует заметить, что такие результаты на самом деле никак не противоречат данным Р. Greenland и соавт. [11], поскольку наличие 1 или даже 2 ФР, особенно у женщин или молодых пациентов может соответствовать низкому расчетному риску.
Попытки решения проблемы недостаточной прогностической способности традиционных методов оценки риска осуществляются по двум направлениям. Первое предполагает привнесение в существующие системы стратификации дополнительных биохимических маркеров и данных анамнеза, которые позволили бы повысить их прогностическую ценность. Второе направление заключается в выявлении с помощью методов прямой визуализации преклинических атеросклеротических изменений сосудов и использовании этих данных при расчете риска развития ССЗ.
Возможности дополнительных ФР в повышении точности прогнозирования ИБС
Липидные ФР. Среди липидных субстанций в качестве потенциальных ФР наиболее часто обсуждались триглицериды, липопротеин — Лп (а), малые частицы липопротеинов низкой плотности (ЛНП), подтипы ЛВП, апобелки липопротеинов, в первую очередь В и А-I.
Значение триглицеридов как ФР подвергается сомнению. Их уровень коррелирует с концентрацией ОХС и ХС ЛВП и при учете воздействия известных больших ФР самостоятельная прогностическая ценность триглицеридов оказывается невысокой. Очевидно, их использование не улучшает качества прогнозирования [22].
По данным, полученным на основе Фрамингемского исследования, использование для прогноза соотношения апо В/апо А-I имело равную ценность по сравнению со стандартными липидными показателями (ОХС/ХС ЛВП, ХС ЛНП/ХС ЛВП). Добавление значения концентрации апобелков к стандартной Фрамингемской прогностической модели не сопровождалось повышением ее ценности [23].
Известно, что частицы (субфракции) ЛНП малого размера обладают повышенной атерогенностью. Например, у лиц с увеличенной долей частиц ЛНП размером менее 250 A (и, соответственно, увеличенным абсолютным количеством частиц ЛНП) наблюдается 6-кратное повышение риска развития ИБС по сравнению с людьми, у которых доля таких частиц находится в пределах нормы [24]. При совокупном анализе 24 исследований увеличение количества частиц ЛНП было признано независимым прогностическим фактором, однако по сравнению с традиционными ФР преимущества при прогнозировании не показано [2].
К сожалению, имеются расхождения в отношении анализа уровня Лп (а). В работах ряда авторов, например, S. Sharma и соавт. [25], показано, что он положительно коррелирует с уровнем ХС ЛВП и не является независимым ФР развития ССЗ. В результате, в 2010 г. в документе Рабочей группы ACCF/AHA измерение липидных параметров, в том числе липопротеидов, аполипопротеидов, размера частиц и их плотности, помимо стандартного липидного профиля, для оценки риска развития ССЗ у пациентов в отсутствие симптомов не рекомендовано [2]. В то же время Европейское общество атеросклероза рекомендует рассматривать Лп (а) как независимый ФР и у пациентов с умеренным и высоким риском развития ССЗ проводить его скрининговое определение [26], что нашло отражение и в российских рекомендациях [1]. Тем не менее дополнительная ценность Лп (а) в суммарном расчете прогноза ИБС пока неясна.
Нелипидные ФР. Скрининговое определение множества дополнительных нелипидных ФР, потенциальное значение которых активно изучалось в последние годы, либо однозначно не рекомендуется (класс III), либо может рассматриваться, но его эффект сомнителен (класс IIb). Это же относится к целому ряду широко назначаемых неинвазивных тестов, направленных на диагностику ИБС (табл. 1).
Таблица 1. Целесообразность скринингового определения ряда дополнительных ФР и диагностических исследований для оценки риска развития ИБС согласно Рекомендациям ACCF/AHA 2010 г. [2]
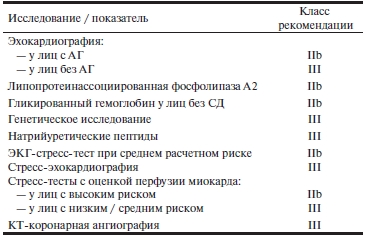
Примечание. ФР — фактор риска; ИБС — ишемическая болезнь сердца; АГ — артериальная гипертензия; СД — сахарный диабет; ЭКГ — электрокардиография; КТ — компьютерная томография.
Следует обратить внимание на то, что электрокардиографический стресс-тест не имеет ценности при скрининговом обследовании лиц с низким расчетным риском развития ИБС. Стресс-эхокардиография показана лишь для дифференциальной диагностики симптомов, которые могут указывать на дебют состоявшейся ИБС или для оценки риска при верифицированном диагнозе ИБС, и также не подходит для скрининга. Не признано целесообразным использование ряда относительно новых лабораторных маркеров и генетического анализа. Мультиспиральная компьютерная томография (МСКТ) с контрастированием коронарных артерий эффективна у пациентов, имеющих высокий риск развития ИБС или симптомы, требующие ее исключения [27], но не рекомендована как скрининговый метод.
C-реактивный белок. Пожалуй, наиболее часто в качестве самого перспективного «нового» ФР» в последние годы обсуждался определяемый высокочувствительным методом С-реактивный белок (СРБ). К середине 2000-х годов были накоплены данные, позволяющие рассматривать его как независимый предиктор ССЗ, равный по значению таким ФР, как ХС ЛНП, ХС ЛВП, АГ или курение [28, 29]. Как и в случае других больших количественных ФР, таких как уровень ХС ЛНП или систолическое АД, повышение концентрации СРБ сопровождается линейным повышением риска развития ССЗ [30].
Объединив данные двух крупных европейских исследований с общим числом пациентов более 4500 (NPHSII и EAS), T. Shah и соавт. [31] продемонстрировали, что при концентрации СРБ на уровне верхнего терциля распределения по сравнению с нижним терцилем отношение риска развития ИБС составляет от 1,87 (при 95% ДИ от 1,21 до 2,89) до 2,22 (при 95% ДИ от 1,50 до 3,30). Тем не менее прогностическая ценность СРБ как самостоятельного предиктора ИБС оказалась низкой: прогностическая ценность положительного результата теста (т.е. повышение СРБ более 3 мг/л) составляла от 8,7 до 20%.
Следующим шагом стало выяснение того, насколько оценка уровня СРБ улучшает качество прогнозирования при добавлении к стандартной шкале риска.
Чтобы оценить, в какой мере изучаемый ФР улучшает качество прогнозирования по сравнению с традиционным способом (например, добавление СРБ к ФШР), существует ряд методик. Наиболее современная была предложена M.J. Pencina и соавт. [32] — метод реклассификации с расчетом индекса реклассификации (ИР). Реклассификацией называется смена категории риска пациента, рассчитанной обычным способом, при внесении в стандартную модель изучаемого ФР. Например, при оценке риска по ФШР пациент относился к группе низкого риска (<6%), однако после измерения концентрации СРБ был переведен в категорию среднего риска (6—20%).
Успешной реклассификация считается, если у пациента, переведенного в более высокую группу риска (реклассификация вверх), сердечно-сосудистый исход наступил, а также, если у пациента, переведенного в более низкую группу риска (реклассификация вниз), исход не наступил. Две обратные ситуации расцениваются как неудачная реклассификация.
Сумма процентов успешной реклассификации в группе состоявшихся сердечно-сосудистых исходов и в группе без исходов и представляет собой индекс реклассификации, т.е. фактически процент случаев, в котором удавалось добиться улучшения качества прогнозирования с помощью нового ФР. Дополнительно обычно рассчитывают так называемый клинический ИР — отдельно для пациентов из группы промежуточного риска.
P.W.F. Wilson и соавт. [33] проанализировали результаты добавления уровня СРБ к традиционной оценке суммарного риска развития ССЗ по ФШР (табл. 2). В таблице по диагонали от левой верхней до правой нижней ячеек представлено распределение случай/контроль в 3 категориях риска по ФШР у лиц, у которых реклассификация не произошла. Соответственно, справа от диагонали представлено то же распределение у лиц, переведенных в более высокие группы риска после учета СРБ, а слева — у переведенных в более низкие группы риска. Среди пациентов (n=241), у которых конечная точка была зарегистрирована, 20 были реклассифицированы вверх и 8 вниз. Доля успешной реклассификации составила (20—8)/241 × 100% = 5%. Из 2765 пациентов, у которых сердечно-сосудистый исход не наступил, 137 были реклассифицированы вниз и 120 вверх. Доля успешной реклассификации составила (137—120)/2765 × 100% = 0,6%. Таким образом, ИР оказался невысок: 5%+0,6% = 5,6%. Клинический ИР составил 14,7%.
Таблица 2. Распределение пациентов по категориям риска только по ФШР и после реклассификации с учетом СРБ (объяснение в тексте)
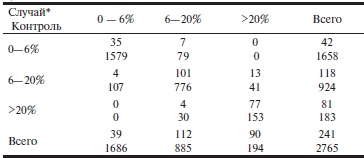
Примечание. * — все учитываемые сердечно-сосудистые исходы (стенокардия, транзиторная ишемическая атака, инсульт, перемежающаяся хромота); ФШР — Фрамингемская шкала риска; СРБ — С-реактивный белок.
Большинство реклассифицированных пациентов относилась к группе среднего риска. Так, добавление СРБ реклассифицировало в группе низкого (0—6%) риска по ФШР 5,1% пациентов, в группе среднего (6—20%) риска — 15,8% пациентов, в группе высокого (≥20%) риска — 12,9%.
Следует также отметить, что согласно представленным P.W.F. Wilson и соавт. данным [32], среди пациентов (n=241), у которых зарегистрирована конечная точка, к группе высокого риска по ФШР относился лишь 81 (33%). Это вполне согласуется с приведенными выше результатами [20, 21].
Таким образом, можно сделать вывод, что учет СРБ при составлении многофакторной модели риска лишь в очень небольшой мере уточняет результаты прогноза и мало влияет на успех прогнозирования у лиц с низким расчетным риском. Аналогичный вывод был сделан при обобщении данных 7 крупных исследований, где в качестве базовой модели риска использовалась ФШР [31]. Тем не менее в настоящее время американские рекомендации по первичной профилактике предлагают оценку уровня СРБ у мужчин старше 50 и женщин старше 60 лет с уровнем ХС ЛНП менее 130 мг/дл без факторов заведомо высокого риска (СД, клинически проявляющаяся ИБС, хроническая болезнь почек) или тяжелых воспалительных заболеваний, если потенциально возможно назначение статинов (класс рекомендованности IIa). Измерение уровня СРБ также может рассматриваться у более молодых лиц, имеющих промежуточный расчетный риск (класс IIb). Согласно мнению российских экспертов, использование СРБ как скринирующего метода для оценки риска развития ССЗ преждевременно [1].
Использование множественных «новых» ФР для улучшения качества прогнозирования
С учетом появления большого количества новых значимых ФР был предпринят ряд попыток создания многокомпонентных моделей расчета суммарного риска, включающих наряду с традиционными важнейшие «новые» ФР. Многокомпонентная шкала риска, ключевым усовершенствованием которой является учет уровня образования, была разработана, в частности, Р.Г. Огановым и соавт. [19].
Одним из крупнейших международных исследований такого рода стало Women’s Health Study, где в качестве потенциальных предикторов сердечно-сосудистых исходов было изучено 35 различных ФР у 24 558 здоровых женщин старше 45 лет [34]. По результатам 10-летнего наблюдения была разработана модель, обеспечивающая наилучшее прогнозирование на основе изученных ФР. В нее вошли возраст, систолическое АД, СРБ, аполипопротеид A-I, анамнез ИМ у родителей в возрасте моложе 60 лет, гликированный гемоглобин у лиц с СД и Лп (а) при уровне апо В-100 ≥100 мг/дл. Модель была опробована на выделенной из общей группы валидационной когорте (n=8158).
По сравнению с уровнем риска, оцененным с помощью ФШР, применение новой модели привело к реклассификации в группе низкого (<5%) риска по ФШР в 2,5% случаев, в группах 5—10% риска и 10—20% риска — в 43% случаев, в группе высокого риска (>20%) — в 32% случаев. Если проанализировать данные исследования с помощью метода Pencina, ИР составит 5,5%, что почти не отличается от результата, рассчитанного в других исследованиях, для добавления одного СРБ. Клинический ИР равняется 29,1%, т.е. в группе промежуточного риска улучшение прогноза оказывается более заметным.
Результатом Women’s Health Study стало создание прогностической модели Reynolds для женщин, упрощенной по сравнению с исходной «оптимальной» прогностической моделью, но практически ей не уступающей. Модель Reynolds значительно превосходит стандартные алгоритмы по прогностической ценности, однако это касается лишь пациентов с промежуточным и высоким риском — в отношении лиц с низким риском она практически не дает преимуществ по сравнению с ФШР. Между тем большинство пациентов, у которых рассматривается целесообразность первичной профилактики ССЗ, относятся именно к группе низкого расчетного риска (это справедливо и для российской популяции [35]). Среди женщин их доля особенно высока — так, в валидационной когорте Women’s Health Study низкий риск по ФШР определялся у 6954 (85%) участников. Благодаря этому, несмотря на низкий процент сердечно-сосудистых исходов в этой группе, именно в ней произошла наибольшая часть событий от общего их числа (44%).
Фактически при разработке модели Reynolds были рассмотрены все важнейшие обсуждаемые в последние годы «новые» ФР. Тем не менее даже их использование не устранило проблемы недооценки вероятности сердечно-сосудистых исходов, в том числе связанных с ИБС, в группе низкого расчетного риска, где развитие заболевания, по-видимому, связано с влиянием не учитываемых, но значимых для конкретного пациента, ФР.
дним из возможных путей решения этой проблемы является использование методик неинвазивной диагностики субклинического атеросклероза.
Неинвазивная диагностика субклинического атеросклероза
Методики неинвазивной диагностики субклинического атеросклероза занимают особое место в стратификации риска развития ИБС у пациентов в отсутствие симптомов. Наверное, можно утверждать, что они находятся на ступень выше, чем любые способы расчета риска, поскольку позволяют верифицировать атеросклеротический процесс коронарной или внекоронарной локализации у конкретного пациента, а не оценивают факторы, которые предрасполагают к атеросклерозу в популяции.
Российские и международные рекомендации совпадают в признании ценности двух важнейших методик неинвазивной диагностики субклинического атеросклероза: 1) ультразвукового исследования (УЗИ) сонных артерий (СА) — увеличение толщины интимы—медии (ТИМ) и/или наличие бляшек; 2) измерения коронарного кальциевого индекса (ККИ) при МСКТ. Роль измерения скорости распространения пульсовой волны как интегрального показателя сосудистой жесткости оценивается неоднозначно [1, 2].
Оценка субклинического атеросклероза СА
ТИМ СА при УЗИ в большинстве случаев измеряют в шести сегментах СА (дистальная часть общей СА, бифуркация и проксимальная часть внутренней СА билатерально) по задней стенке сосуда, после чего рассчитывают усредненный результат. Помимо измерения ТИМ оценивают наличие атеросклеротической бляшки (АСБ), определяемой как локальное утолщение сосудистой стенки более чем на 50% в сравнении с окружающими участками, или утолщение более чем 1,5 мм с протрузией в просвет сосуда [36, 37].
Корреляция показателя ТИМ СА и наличия в них АСБ и риска развития ИМ, сердечно-сосудистой смерти и инсульта показана во многих клинических исследованиях.
В крупнейшем исследовании ARIC (13 145 участников в возрасте 45—65 лет) показано повышение риска развития ИБС в 4,2 раза у мужчин и в 18,9 раза у женщин при увеличении усредненной ТИМ в диапазоне от 0,6 до 1 мм. Наличие ТИМ, соответствующей высшему квартилю, по сравнению с нижним квартилем ассоциировалось с двукратным увеличением риска [38].
Исследование NOMAS (The Northern Manhattan Study, 2189 участников) показало, что наличие АСБ увеличивало риск сосудистых катастроф в 2,8 раза [39]. Более точной для стратификации риска является количественная оценка АСБ — определение процента стенозирования, планиметрических данных (площадь, длина, объем) и качественных показателей (структура АСБ, плотность, состояние ее поверхности). В исследовании J.D. Spence и соавт. [40] в зависимости от величины суммарной площади АСБ (0,00—0,11 см2; 0,12—0,45 см2; 0,46—1,18 см2 и >1,19 см2) 5-летний риск развития ишемического инсульта, ИМ и сосудистой смерти составил 5,6, 10,7, 13,9 и 19,5% соответственно.
Результаты учета данных о ТИМ и наличии АСБ при оценке риска по стандартной шкале
Добавление данных о ТИМ и наличии АСБ в СА к информации, полученной из ФШР, привело к реклассификации в группах риска <5%, 5—10%, 10—20% и >20% у 17,4, 32,8, 36,6 и 25,2% мужчин и 5,1, 40,2, 38,4 и 24,9% женщин соответственно. Реклассификаций из группы низкого в группу высокого риска и наоборот не произошло [41]. ИР составил 9,9%, что вдвое превосходит результаты применения шкалы Reynolds. Клинический ИР был равен 21,7%.
Следует отметить довольно значительный по сравнению с использованием «новых» ФР, уровень реклассификации среди мужчин группы низкого риска. В то же время среди женщин с низким расчетным риском исследование СА давало мало дополнительной информации.
Современные отечественные и международные стандарты рекомендуют исследование ТИМ и АСБ СА у лиц с промежуточным риском (5—9% по SCORE); у пациентов, имеющих родственников первой линии с ранним развитием ССЗ (мужчины моложе 55 лет и женщины моложе 65 лет); лиц моложе 60 лет с одним резко выраженным ФР; у мужчин старше 40 лет и женщин старше 50 лет, имеющих 2 ФР и более [1, 2].
Оценка выраженности кальциноза коронарных артерий в стратификации риска
Морфологические исследования показали высокую корреляцию между выраженностью коронарного кальциноза и степенью атеросклеротического поражения артерий. Ранняя диагностика коронарного атеросклероза с помощью МСКТ основана на обнаружении и количественной оценке кальциноза коронарных артерий [42]. С этой целью наиболее часто используют оценку ККИ по A. Agatston [43].
Р. Greenland и соавт. [44] доказали, что ККИ позволяет прогнозировать коронарные исходы без учета традиционных ФР, включенных во Фрамингемскую модель. По сравнению с ККИ=0 значение ККИ>300 соответствовало отношению риска смерти от ИБС или развития нефатального ИМ 3,9 (при 95% ДИ от 2,1 до 7,3; р<0,001). Кроме того, учет ККИ улучшал результаты прогноза, когда использовалась ФШР. Внутри одной категории риска по ФШР возрастание ККИ сопровождалось достоверным увеличением числа коронарных исходов. Это было справедливо для всех больных, за исключением пациентов с уровнем 10-летнего риска <10% (рис. 2).
Возможности ККИ в этой последней категории пациентов были изучены в проекте Prospective Army Coronary Calcium (PACC), в который были включены здоровые военнослужащие (1627 мужчин и 356 женщин) в возрасте 40—50 лет [45]. У 95,6% мужчин и всех женщин расчетный риск по ФШР составлял <10%. В течение 3 лет наблюдения отмечено 9 коронарных исходов (острый ИМ, нестабильная стенокардия, смерть от ИБС), в том числе 4 у лиц с риском <6%, 5 — с риском 6—10%. В 5 из 9 случаев имел место отягощенный анамнез по ранней ИБС у родственников первой или второй линии. У 72 мужчин с риском >10% ишемических исходов не было.
Продемонстрировано, что коронарный кальциноз оказывает на прогноз гораздо более значительное влияние, чем оценка риска по ФШР и семейный анамнез. Ишемические осложнения отмечены у 7 из 264 мужчин, у которых был выявлен коронарный кальциноз (1,95%) против 2 из 1263 (0,16%) без кальциноза (p<0,0001). При этом наличие коронарного кальциноза любой выраженности сопровождалось увеличением риска развития острой формы ИБС в 10,75 раза при 95% ДИ от 2,23 до 51,84, в то время как для семейного анамнеза этот показатель составлял 2,53 при 95% ДИ от 1,03 до 6,20, а для балла по ФШР — 1,10 при 95% ДИ от 0,89 до 1,35 (p>0,05). Таким образом, помимо высокой информтивности ККИ, показано отсутствие прогностической ценности ФШР у молодых пациентов из группы низкого риска.
Анализируя результаты исследования MESA [46], T.S. Polonsky и соавт. [47] рассчитали ИР для добавления ККИ к ФШР. В целом ИР составил 25%, а для группы промежуточного риска — 55%. Реклассификация в группе низкого (0—2%) риска произошла в 11,6% случаев, в группе промежуточного (3—9%) риска — в 54,3% случаев, в группе высокого (≥10%) риска — у 35,8% пациентов.
Несмотря на то что не совсем корректно прямое сравнение ИР, рассчитанного в разных исследованиях для различных «новых» ФР, этот показатель для ККИ оказался намного выше, чем для остальных изучавшихся ФР.
Клинический ИР (у пациентов из группы промежуточного риска) оказался значительно выше, чем в когорте в целом, поэтому ценность использования ККИ у таких пациентов наиболее очевидна, что совпадает с текущими рекомендациями [1, 48]. При добавлении ККИ реклассифицируется более 50% пациентов этой категории в группы низкого или высокого риска, в которых тактика ведения более ясна.
Обобщенные данные по дополнительной ценности, которой обладают «новые» ФР по отношению к стандартным шкалам риска в прогнозировании ишемических событий, приведены в табл. 3.
Таблица 3. Сравнительная диагностическая ценность «новых» ФР в прогнозировании сердечно-сосудистых исходов
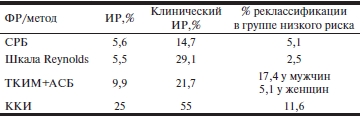
Примечание. ИР — индекс реклассификации; СРБ — С-реактивный белок; ТИМ — толщина интимы—медии; АСБ — атеросклеротическая бляшка; ККИ — коронарный кальциевый индекс.
Обсуждая применимость оценки ККИ у пациентов из группы низкого риска, по-видимому, следует признать наличие некоторых ограничений. По способности выявлять повышенный риск развития ИБС у лиц молодого возраста в отсутствие симптомов ККИ, очевидно, уступает результатам УЗИ СА, хотя и превосходит расчетные модели. По данным исследования РАСС, в котором пациенты с низким риском составляли более 95%, кальций в коронарных артериях был выявлен менее чем у 2%, а в исследовании MESA в группе низкого риска лишь 4 из 3746 пациентов были реклассифицированы в категорию высокого риска на основании ККИ.
Действительно, хотя выявление пациентов с ККИ=0 указывает на очень низкий уровень коронарной смерти (0,4% в течение 3—5 лет; в мета-анализе 6 исследований отмечено 49 исходов на 11 815 наблюдений [48]), вывод о хорошем долгосрочном прогнозе у всех таких пациентов будет некорректным. Это становится ясно при сравнении результатов МСКТ и УЗИ СА в одной и той же группе больных.
По данным клиники Мейо, среди 89 мужчин в возрасте 48,9±5,7 года с риском по ФШР <1% и ККИ=0 признаки атеросклероза СА были выявлены у 42 (47%), в том числе АСБ — у 30 (34%), а ТИМ выше 75-го процентиля — у 12 (13%). По данным других авторов, распространенность выявления АСБ в СА в аналогичной группе пациентов достигала 55% [49]. Это свидетельствует о том, что в диагностике субклинического атеросклероза УЗИ СА в целом чувствительнее, чем ККИ.
Такие данные ставят вопрос о соотношении цены и эффективности проведения широкого скринингового обследования пациентов этой категории с помощью исследования, имеющего высокую стоимость и подвергающего пациентов лучевой нагрузке. Кроме того, применение МСКТ ограничивается недостаточной доступностью оборудования.
Резюмируя данные ряда исследований, S.J. Lester и соавт. рекомендуют трактовать ККИ следующим образом: повышение его указывает на повышенный уровень риска развития сердечно-сосудистых осложнений, а если ККИ=0, можно предполагать низкий риск в краткосрочной перспективе (3—7 лет). Подобное заключение в отношении пациентов молодого и среднего возраста не очень информативно, поэтому для них оценка ТИМ и АСБ СА представляется наиболее подходящей скрининговой методикой [49]. Справедливость такого вывода подкрепляется наиболее высоким из всех методик уровнем реклассификации в этой категории пациентов, неинвазивностью, низкой стоимостью УЗИ и отсутствием лучевой нагрузки.
Заключение
Первичная профилактика лежит в основе мероприятий, направленных на снижение распространенности сердечно-сосудистых заболеваний, в том числе заболеваемости ишемической болезнью сердца, которая остается ведущей причиной смерти во всем мире, а в Российской Федерации по-прежнему находится на высоком абсолютном уровне. Выявление в крупнейших когортных исследованиях традиционных факторов риска заболеваний сердца и их последующая коррекция на уровне популяций способствовали значительному прогрессу, достигнутому во многих странах в профилактике ишемической болезни сердца. Вместе с тем принятые подходы к индивидуальному прогнозированию сердечно-сосудистых заболеваний, основанные на анализе традиционных факторов риска и расчете «суммарного риска», в ряде случаев малоэффективны. В первую очередь эта проблема касается пациентов с низким расчетным риском — в эту группу попадают большинство относительно молодых пациентов, лиц без множественных факторов риска, женщин. У этих пациентов развитие заболевания, по-видимому, связано с влиянием индивидуально значимых факторов риска, не учитываемых при применении стандартных шкал. Между тем среди кандидатов на проведение активной первичной профилактики эта группа низкого риска наиболее многочисленна, и именно за счет нее происходит наибольшее в абсолютных цифрах число первичных сердечно-сосудистых исходов.
Попытки улучшения прогностических свойств шкал риска, связанные с введением в них новых показателей, пока не привели к решающим изменениям, тем более что использование сложных многокомпонентных моделей в широкой практике ограничено возможностями определения входящих в их состав показателей.
Более перспективным представляется подход, принципиально отличный по сравнению с расчетом суммарного риска — инструментальная диагностика субклинического атеросклероза, в первую очередь на основе оценки толщины интимы—медии и атеросклеротической бляшки сонных артерий, а также коронарный кальциевый индекс. Диагностика субклинического атеросклероза превосходит методы расчета риска по способности прогнозировать сердечно-сосудистые исходы, особенно в наиболее проблемной группе низкого риска. С учетом неинвазивности, относительной доступности и высокой диагностической ценности в выявлении ранних проявлений атеросклероза, ультразвуковое исследование артерий можно считать исследованием выбора для скрининговой оценки риска развития ишемической болезни сердца у пациентов в отсутствие симптомов. Представляется, что хотя современные стандарты ограничивают применение диагностики субклинического атеросклероза категорией лиц с промежуточным риском, с решением вопросов стоимости и доступности ее скрининговое использование у лиц с низким расчетным риском следует рассматривать как следующий шаг в повышении эффективности первичной профилактики.



