Повышенный уровень холестерина (ХС) липопротеидов низкой плотности (ЛНП) — один из основных факторов риска (ФР) развития атеросклероза и ишемической болезни сердца (ИБС). Согласно последним рекомендациям, уровень ХС ЛНП у пациентов из группы повышенного риска не должен превышать 2,6 ммоль/л, а в некоторых случаях и 1,8 ммоль/л, что достигается с помощью агрессивной гиполипидемической терапии. Однако известно, что ЛНП представляют собой очень гетерогенную популяцию частиц, различающихся по своим физико-химическим свойствам [1].
Липопротеид(а) [Лп(а)] представляет собой сложный надмолекулярный комплекс, состоящий из ЛНП-подобной частицы, в которой молекула белка апоВ100 связана дисульфидной связью с молекулой сильно гликозилированного апобелка(а) [апо(а)]. Согласно многочисленным исследованиям, Лп(а) является независимым ФР возникновения и развития атеросклероза, ИБС и их осложнений [2]. В настоящее время нет ясного представления о метаболизме Лп(а), и в частности, понимания того, как происходит сборка частицы и какие ЛНП участвуют в этом процессе. Предполагают, что сборка Лп(а) может происходить внутриклеточно, на поверхности гепатоцитов или внеклеточно непосредственно в крови человека [3—6].
 Известно, что наиболее атерогенными являются мелкие плотные частицы ЛНП [7]; напротив, крупные частицы ЛНП присутствуют у пациентов без клинически значимого поражения коронарного русла [8]. Механизм высокой атерогенности Лп(а) также до конца неясен, несмотря на интенсивные исследования. Данные о связи Лп(а) с подфракциями других апоВ-содержащих липопротеидов, а также об их сочетанном влиянии на развитие атеросклероза и ИБС крайне ограничены [9, 10].
Известно, что наиболее атерогенными являются мелкие плотные частицы ЛНП [7]; напротив, крупные частицы ЛНП присутствуют у пациентов без клинически значимого поражения коронарного русла [8]. Механизм высокой атерогенности Лп(а) также до конца неясен, несмотря на интенсивные исследования. Данные о связи Лп(а) с подфракциями других апоВ-содержащих липопротеидов, а также об их сочетанном влиянии на развитие атеросклероза и ИБС крайне ограничены [9, 10].
Уровень Лп(а) в плазме крови контролируется генетически и устойчив к медикаментозной терапии, являясь одной из наиболее вероятных причин резидуального риска развития осложнений у пациентов, получающих оптимальную терапию статинами. Кроме того, существующая в настоящее время в клинической практике оценка ХС ЛНП не учитывает вклада Лп(а), что вносит достоверную погрешность в адекватную оценку этих параметров [11]. Таким образом, изучение связи Лп(а) с подфракциями апоВ-содержащих липопротеидов и их совместного влияния на риск развития ИБС представляется актуальной задачей.
Цель исследования: изучить взаимосвязь Лп(а) и под-фракционного состава апоВ-содержащих липопротеидов с наличием ИБС.
Материал и методы
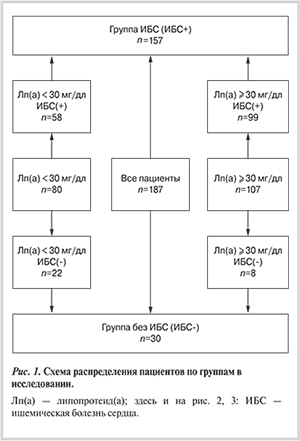
В исследование были включены 187 пациентов (средний возраст 58±9 лет), имеющих не менее одного ФР развития ИБС с уровнем Лп(а) не менее 3 мг/дл. Исходя из цели работы — изучить взаимосвязь Лп(а), подфракций атерогенных липопротеидов и наличия ИБС — в исследование были включены пациенты с условно нормальным (не более 30 мг/дл) и повышенным (более 30 мг/дл) уровнем Лп(а), таким образом, чтобы число лиц в группах было сопоставимо (рис. 1). Были включены мужчины (n=141; средний возраст 57±9 лет) и женщины (n=46; средний возраст 60±9 лет). Уровни общего холестерина (ОХС), триглицеридов (ТГ), ХС липопротеидов высокой плотности (ЛВП) в сыворотке крови определяли ферментативным колориметрическим методом коммерческими наборами «Biocon» (Германия). Содержание ХС ЛНП рассчитывали по формуле Фридвальда: ХС ЛНП = ОХС – ХС ЛВП – ТГ/2,2 (ммоль/л), корригированный уровень ХС ЛНП, учитывающий вклад ХС Лп(а): ХС ЛНПкорр = ХС ЛНП – 0,3×Лп(а)/38,5, где Лп(а) — концентрация Лп(а) в миллиграммах на децилитр [12]. Концентрацию Лп(а) во всех исследуемых образцах измеряли при помощи иммуноферментного анализа с использованием поликлональных антител к Лп(а) [13]. Метод был валидирован относительно коммерческих наборов (Immunozym Lp(a) и (TintElizeTM Lp(a). В качестве референсного стандарта использовали контрольный препарат Лп(а) (Technoclone), одобренный Международной Федерацией клинической химии.
Количественное содержание подфракций липопротеидов определяли с помощью системы (Lipoprint Quantimetrix). При этом образцы сыворотки крови больных для анализа хранили при температуре –70 °С, не допуская повторных циклов замораживания—оттаивания. Данные выражали как концентрацию (мг/дл) ХС в различных подфракциях липопротеидов [14].
Коронарографию проводили в лаборатории рентгенэндоваскулярных методов диагностики и лечения в амбулаторных условиях при научно-диспансерном отделе Института клинической кардиологии им. А.Л. Мясникова. Количественный анализ ангиограмм осуществляли с помощью интегрированной компьютерной программы Philips Medical Systems. Коронарный атеросклероз подтверждали при наличии стеноза более 50% по диаметру, по крайней мере, в одной магистральной артерии.
Статистическую обработку полученных данных проводили с использованием пакета MedCalc версия 5.00.020. Результаты представлены в виде среднего значения (М)±стандартное отклонение (SD) или 95% доверительный интервал (ДИ). При сравнении количественных показателей двух групп использовали критерий t Стьюдента или его непараметрический аналог — критерий суммы рангов Вилкоксона. Для сравнения частотных данных между группами применяли точный критерий Фишера. В целях установления связи между различными показателями использовали корреляционный анализ по Пирсону и Спирмену. Для оценки значимости связи изучаемых параметров с наличием ИБС в исследованной группе пациентов рассчитывали отношение шансов (ОШ) с 95% ДИ.
Результаты
Все пациенты, включенные в исследование, были разделены на группы по следующим показателям: по уровню Лп(а) менее (n=80) или больше, или равно (n=107) 30 мг/дл, наличию (n=157) или отсутствию (n=30) ИБС, подтвержденной результатами коронарографии (см. рис. 1).
 Группа пациентов с ИБС (основная группа) состояла из 128 мужчин и 29 женщин, в ней преобладали пациенты с повышенным уровнем Лп(а): 98 (62%) пациентов с Лп(а)≥30 мг/дл и 77 (49%) с Лп(а) ≥50 мг/дл. Многососудистое поражение коронарного русла и тяжелое течение ИБС имели 104 (82%) пациента. Контрольную группу (пациенты без ИБС) составили 13 мужчин и 17 женщин, среди них с повышенной концентрацией Лп(а) было 8 (27%), из них с уровнем 50 мг/дл и выше — 4 (13%).
Группа пациентов с ИБС (основная группа) состояла из 128 мужчин и 29 женщин, в ней преобладали пациенты с повышенным уровнем Лп(а): 98 (62%) пациентов с Лп(а)≥30 мг/дл и 77 (49%) с Лп(а) ≥50 мг/дл. Многососудистое поражение коронарного русла и тяжелое течение ИБС имели 104 (82%) пациента. Контрольную группу (пациенты без ИБС) составили 13 мужчин и 17 женщин, среди них с повышенной концентрацией Лп(а) было 8 (27%), из них с уровнем 50 мг/дл и выше — 4 (13%).
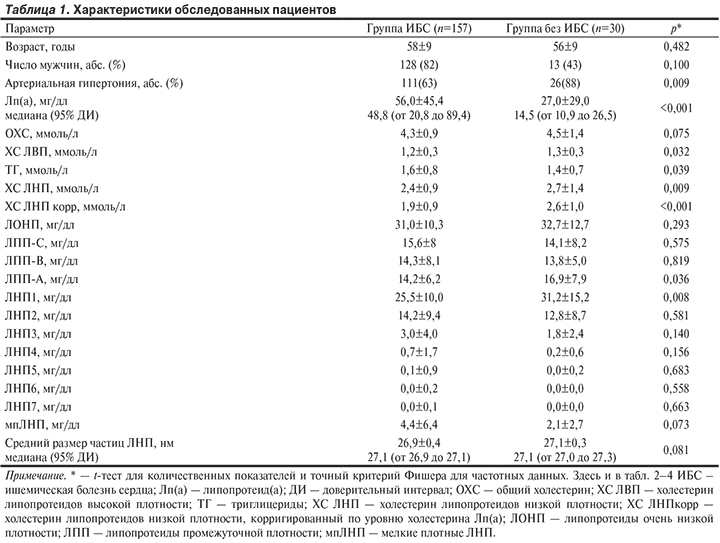
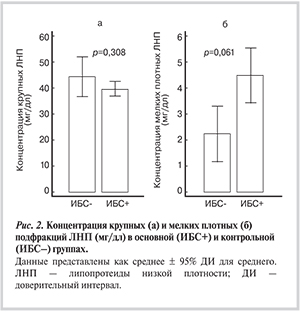
Пациенты с ИБС и без ИБС были сопоставимы по возрасту, полу, показателям липидного состава крови и подфракциям атерогенных липопротеидов, за исключением Лп(а), ЛПП-А, подфракций крупных (ЛНП1) и подфракций мелких плотных (мпЛНП) ЛНП (табл. 1, рис. 2).
Концентрация Лп(а) в общей группе обследованных пациентов не была связана ни с одним из ФР, концентрациями ОХС, ЛНП, ЛВП, подфракций липопротеидов. Подгруппы больных с нормальным и повышенным уровнем Лп(а) не различались по возрасту, полу, показателям липидов, среднему размеру частиц ЛНП, концентрациям подфракций ЛНП и ЛПП, а также липопротеидов очень низкой плотности (ЛОНП). Очевидные достоверные различия были обнаружены только по уровню ХС ЛНПкорр, учитывающему уровень ХС, который входит в состав Лп(а).
В общей группе обследованных пациентов наблюдалась взаимосвязь уровня ТГ в плазме с концентрацией мпЛНП (r=0,445; р<0,0001) и средним размером частиц ЛНП (r=–0,424; p<0,0001), максимальная корреляция наблюдалась для подфракций ЛНП3 и ЛНП4 (r=0,431 и r=0,386; p<0,00001 для обеих). Обратная корреляция обнаружена для ЛПП-А (r=–0,161; p=0,027), а прямая для ЛПП-С (r=0,211; р=0,0037). Концентрация крупных ЛНП1 не была связана с уровнем ТГ.
При дальнейшем анализе пациентов с различным уровнем Лп(а) оказалось, что в подгруппе с Лп(а) ≥30 мг/дл взаимосвязи между концентрацией ТГ с мпЛНП исчезают, тогда как у пациентов с нормальным уровнем Лп(а), наоборот, усиливаются.
Аналогично взаимосвязь ХС ЛВП с концентрацией крупных ЛНП1 наблюдалась только в общей группе и подгруппе с нормальным Лп(а) (r=0,186; p=0,010 и r=0,28; p=0,011 соответственно) и исчезала в подгруппе пациентов с Лп(а) более или равно 30 мг/дл. Однако по данным как однофакторного, так и многофакторного анализа с одновременным введением в модель концентрации ОХС, ТГ, ХС ЛНП, ХС ЛВП и Лп(а) в качестве независимых переменных, Лп(а) не был связан с уровнем крупных (ЛНП1 и ЛНП2) или мелких плотных (ЛНП3-7) ЛНП.
Исходя из полученных результатов, мы разделили пациентов на подгруппы в зависимости от уровня Лп(а) и ТГ и проанализировали различия по составу фракций ЛОНП, ЛВП и подфракций ЛНП и ЛПП (табл. 2).
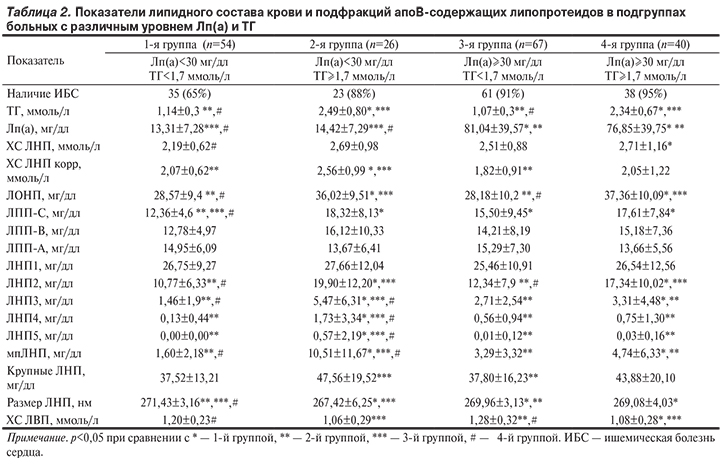
Мы обнаружили, что в подгруппе пациентов с концентрацией Лп(а) менее 30 мг/дл и гипертриглицеридемией наблюдалась максимальная концентрация мпЛНП. Минимальная концентрация крупных подфракций ЛПП-С, а также максимальный средний размер частиц ЛНП выявлены у пациентов с нормальным уровнем Лп(а) и ТГ. Между подгруппами пациентов, имеющих уровень Лп(а) выше 30 мг/дл и различный уровень ТГ, достоверных различий по подфракционному составу ЛНП и ЛПП выявлено не было. Не наблюдалось различий по уровню мелких и средних ЛПП-А и ЛПП-В, а также крупных ЛНП1.
Однофакторный анализ в общей группе больных выявил достоверную положительную связь ИБС только с полом (r=0,325; p<0,0001), концентрацией Лп(а) (r=0,271; p=0,0001) и уровнем ТГ (r=0,159; p=0,030), остальные ФР развития ИБС не были значимыми.
Многофакторный анализ связи подфракций ЛПП и ЛНП с наличием ИБС у пациентов с включением в модель в качестве предикторов концентрации Лп(а) и ХС ЛНПкорр показал значимость содержания крупных ЛНП1 и ЛПП-C только в подгруппе пациентов с нормальным уровнем Лп(а) (табл. 3).
Одновременное включение в модель уровня ТГ и подфракций ЛНП приводило к потере статистической значимости для всех анализируемых параметров, кроме Лп(а), что лишний раз доказывало зависимость данных показателей друг от друга.
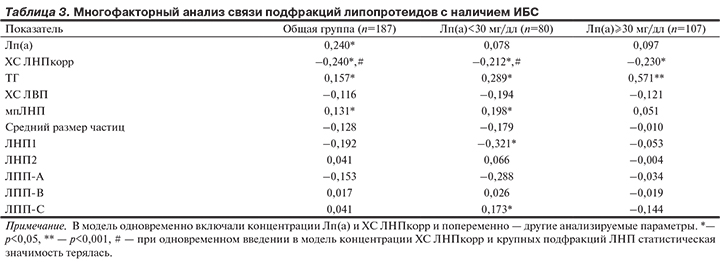
По результатам многофакторного анализа с одновременным включением в модель таких ФР развития ИБС, как пол, возраст, уровни ХС ЛНПкорр, ХС ЛВП и Лп(а), концентрация мпЛНП (β=0,131; р<0,05), наряду с Лп(а) (β=0,240; р<0,0001), ХС ЛНПкорр (β=–0,240; р<0,05) и мужским полом (β=0,319; р<0,0001) независимо связана с наличием ИБС у обследованных пациентов. Уровень ТГ также оказался независимым предиктором ИБС, если учитывался отдельно от концентрации мпЛНП (β=0,157; р<0,005). В подгруппе больных с нормальным уровнем Лп(а) концентрация крупных ЛНП1 проявила себя как независимый предиктор ИБС, оказывающий кардиопротективное действие (β=–0,321; р<0,05), более значимый, чем ХС ЛНПкорр.
Таким образом, было показано, что в исследуемой нами когорте пациентов уровни Лп(а) и мпЛНП, как и ТГ, являлись независимыми ФР развития ИБС.
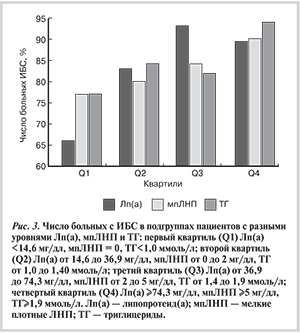 При анализе подгрупп больных, разделенных по квартилям изучаемых показателей, доля больных ИБС возрастала при увеличении концентрации мпЛНП, ТГ и Лп(а) (рис. 3). ОШ наличия ИБС у пациентов из подгрупп верхней квартили относительно нижней квартили каждого из анализируемых показателей составили для Лп(а) 7,27 (при 95% ДИ от 1,92 до 26,7), для ТГ 4,48 (при 95% ДИ от 1,16 до 17,29) и для мпЛНП 2,84 (при 95% ДИ от 0,94 до 8,63).
При анализе подгрупп больных, разделенных по квартилям изучаемых показателей, доля больных ИБС возрастала при увеличении концентрации мпЛНП, ТГ и Лп(а) (рис. 3). ОШ наличия ИБС у пациентов из подгрупп верхней квартили относительно нижней квартили каждого из анализируемых показателей составили для Лп(а) 7,27 (при 95% ДИ от 1,92 до 26,7), для ТГ 4,48 (при 95% ДИ от 1,16 до 17,29) и для мпЛНП 2,84 (при 95% ДИ от 0,94 до 8,63).
Согласно ROC-анализу, концентрация мпЛНП более 2 мг/дл была связана с наличием ИБС, как и концентрация крупных подфракций ЛНП (ЛНП1 и ЛНП2) ≤41,8 мг/дл и ЛНП1 ≤35 мг/ дл ассоциировалась с наличием ИБС в обследованной группе пациентов.
Учитывая полученные в многофакторном анализе данные о независимой взаимосвязи Лп(а) и подфракций ЛНП с ИБС, мы проанализировали ОШ наличия ИБС для подгрупп пациентов с различной концентрацией Лп(а), подфракций мелких и крупных ЛНП, наличием и отсутствием гипертри-глицеридемии, а также их сочетанием относительно группы с уровнем Лп(а) <30 4="" p="">
Таким образом, мы показали, что присутствие в плазме подфракций мпЛНП более 2 мг/дл (наличие у пациента атерогенного профиля В), а также статистически значимое снижение концентрации подфракций крупных ЛНП, особенно ЛНП1, достоверно увеличивает вероятность обнаружения инструментально подтвержденной ИБС у больных с повышенной концентрацией Лп(а).
Обсуждение
В нашем исследовании было показано, что концентрация Лп(а) выше 30 мг/дл является независимым ФР развития ИБС, что подтверждает современное представление о роли Лп(а) в развитии сердечно-сосудистых заболеваний (ССЗ) [2].
Взаимосвязь Лп(а) с другими апоВ-содержащими липо-протеидами изучается давно, однако полученные данные крайне противоречивы. Одно из объяснений — влияние ХС, входящего в состав Лп(а), на уровень ОХС и ХС ЛНП, мешающее получению адекватных результатов [11].
Мы не обнаружили корреляций уровня Лп(а) с концентрацией ХС ЛНП, ХС ЛВП, ТГ, ЛОНП, а также ни с одним из исследованных подклассов липопротеидов как в общей группе пациентов, так и в подгруппах больных с ИБС и без ИБС. Данные о взаимосвязи концентрации Лп(а) и мпЛНП ограничены и не согласуются друг с другом. При исследовании, проведенном с участием больных ИБС и практически здоровых добровольцев (109 и 102 человека соответственно), не обнаружено различий по среднему размеру частиц ЛНП и содержанию подфракций мпЛНП в подгруппах пациентов с уровнем Лп(а) больше и меньше 30 мг/дл как среди больных, так и здоровых [10]. При этом, как и в нашей работе, обнаружено достоверное увеличение риска развития ИБС у пациентов с наличием низкомолекулярных изоформ апо(а), ассоциированных с повышенной концентрацией Лп(а) и высоким уровнем мпЛНП. Напротив, в другом исследовании выявлена слабая положительная связь между концентрацией Лп(а) и подфракциями мпЛНП [9].
Одной из важных характеристик, отражающих гетерогенность ЛНП, является их средний диаметр; наиболее атерогенные частицы имеют диаметр менее 25,5 нм [15]. В нашем исследовании средний размер частиц варьировал от 24,7 до 27,7 нм в группе больных ИБС и от 26,3 до 27,6 нм у пациентов без ИБС, также уровень мпЛНП у пациентов с ИБС в 2 раза превышал данный показатель у пациентов без ИБС, но различия в обоих случаях не достигали статистической значимости (см. табл. 1 и рис. 2). Наиболее вероятным объяснением является снижение содержания мпЛНП в плазме всех обследованных пациентов за счет длительной терапии статинами.

Взаимосвязь уровня ТГ с концентрацией мпЛНП показана более 30 лет назад и верифицирована в большинстве работ [1, 8, 16]. Как и в нашей работе, наиболее выраженными эти корреляции были для подфракций ЛНП3 и ЛНП4 [8, 16]. Согласно имеющейся гипотезе, подфракции мпЛНП образуются из обогащенных ТГ частиц ЛОНП в результате липолиза, ослабленного снижением активности фермента липопротеинлипазы, а затем гидролиза оставшихся ТГ печеночной липазой [1, 7], при этом повышенная активность печеночной липазы играет ключевую роль в образовании мпЛНП у пациентов с повышенным уровнем ТГ [17]. Отсутствие связи между ТГ и подфракциями мелких ЛНП у пациентов с повышенной концентрацией Лп(а), обнаруженное в нашей работе, также может свидетельствовать о вовлечении Лп(а) в метаболизм ТГ, обогащенных ЛОНП. Косвенным подтверждением этого может служить способность препаратов, воздействующих на белок — переносчик эфиров ХС, влиять на концентрацию Лп(а) [18].
Показанное в настоящем исследовании увеличение вероятности наличия ИБС у пациентов с повышенной концентрацией Лп(а) и наличием мпЛНП или гипертриглицеридемией согласуется с данными, полученными в трехлетнем проспективном наблюдении, показавшем статистически значимое увеличение риска кардиологических исходов (смерть от ССЗ, нефатальный ИМ и эпизод нестабильная стенокардия, требующая госпитализации) у пациентов с ожирением при уровне Лп(а) более 24 мг/дл (относительный риск 3,94 (95% ДИ 2,11—7,35); р=0,000017). При наличии у таких пациентов однонуклеотидного полиморфизма гена LIPC, связанного с повышенной активностью печеночной липазы, наблюдалось трехкратное увеличение риска, обусловленного повышенной концентрацией Лп(а) [19]. Следует отметить, что как и в нашей работе, собственно повышенная активность печеночной липазы (приводящая к образованию мпЛНП) на фоне низкой концентрации Лп(а) не ассоциировалась с увеличением риска развития осложнений ССЗ.
Обнаруженная обратная взаимосвязь ИБС с концентрацией ЛНП1 независимо от концентрации ХС ЛНП и ХС ЛВП в группе пациентов с нормальным уровнем Лп(а) обусловливает необходимость дальнейших исследований. Учитывая, что все пациенты принимали статины и имели низкий уровень ХС ЛНП, полученные результаты делают актуальным проведение дальнейших исследований по оценке влияния гиполипидемической терапии на крупные частицы ЛНП, поскольку в настоящее время такие данные практически отсутствуют, а имеющиеся противоречивы [20].
Заключение
В результате нашего исследования показано, что липо-протеид (а) является независимым фактором риска развития атеросклероза коронарных артерий, более значимым, чем сдвиги в подфракционном составе апоВ-содержащих липо-протеидов. У пациентов с концентрацией липопротеида(а) не более 30 мг/дл выявляется прямая связь подфракций мелких плотных липопротеидов низкой плотности с концентрацией триглицеридов, а концентрация подфракций мелких плотных липопротеидов низкой плотности, крупных липопротеидов промежуточной плотности класса С напрямую связаны с наличием ишемической болезни сердца; в то же время уровни крупных липопротеидов низкой плотности класса 1 коррелируют с концентрацией холестерина липо-протеидов высокой плотности и, возможно, играют кардиопротективную роль.
Наличие подфракций мелких плотных липопротеидов низкой плотности (более 2 мг/дл) или гипертриглицеридемии (более 1,7 ммоль/л) статистически значимо увеличивало вероятность обнаружения инструментально подтвержденной ишемической болезни сердца у пациентов с повышенной концентрацией липопротеида(а) в обследованной группе больных. В то же время концентрация крупных липопротеидов низкой плотности класса 1 менее 35 мг/дл на фоне повышенной концентрации липопротеида(а) статистически значимо ассоциировалась с наличием ишемической болезни сердца.



