Гипертрофия левого желудочка (ГЛЖ), развивающаяся в ответ на артериальную гипертензию, предрасполагает к развитию аритмий и внезапной сердечной смерти, обусловленных изменениями реполяризации миокарда. Известно, что длительность потенциалов действия желудочковых кардиомиоцитов увеличивается при ГЛЖ различного генеза [1—7]. Однако эти сведения получены только для левожелудочковых кардиомиоцитов. Вместе с тем необходимо учитывать изменения реполяризационных свойств миокарда правого желудочка (ПЖ) при ГЛЖ, если таковые имеются, поскольку они вносят вклад в общую дисперсию реполяризации.
Цель данной работы состояла в изучении реполяризации эпикардиальной поверхности ПЖ при экспериментальном моделировании ГЛЖ, вызванной реноваскулярной гипертензией у крыс.
Материал и методы
Эксперименты проведены на 12 самках крыс Вистар в возрасте 6—8 мес и с массой тела 170—230 г, которая в ходе эксперимента не изменялась. Реноваскулярная гипертензия была вызвана сужением левой почечной артерии с помощью модифицированного нами способа [8] у 6 крыс, анестезированных эфиром; 6 других животных служили нормотензивным контролем. Способ сужения почечной артерии заключается во втягивании петли препарированного сосуда с помощью тонкой шелковой нити в цельную пластиковую трубочку с заданным внутренним диаметром.
Через месяц после операции животных, под эфирным наркозом и измеряли давление в брюшной аорте. Введенный в аорту катетер (внешний диаметр 0,5 мм; внутренний диаметр 0,3 мм) присоединяли к датчику давления SensoNor 840 (50 μV/V/cmHg). Давление регистрировали на мониторе EAGLE 1000 (Marquette Hellige GmbH, Германия). После измерения давления животных наркотизировали тиопенталом натрия (100 мг/кг внутрибрюшинно), переводили на искусственную вентиляцию легких, вскрывали грудную клетку по среднегрудинной линии и разрезали перикард. В дальнейшем температуру тела поддерживали на уровне 38—38,5 °C, сердце орошали теплым (38—39 °C) изотоническим раствором натрия хлорида. Картографирование эпикардиальной поверхности желудочков сердца проводили при синусно-предсердном ритме. Униполярные электрограммы (n=32; рис. 1) и ЭКГ в биполярных отведениях от конечностей регистрировали синхронно на 128-канальной компьютеризированной системе с полосой пропускания 0,05—1000 Гц и частотой дискретизации 4000 Гц.
В конце эксперимента вырезали сердце и взвешивали желудочки. Для оценки гипертрофии миокарда определяли относительную массу ЛЖ и ПЖ. Для оценки реполяризационных свойств миокарда вычисляли длительность интервалов активация—восстановление, определяемых как разность между временем локальной активации и реполяризации [9]. Время локальной активации определяли как минимум первой производной униполярной электрограммы в период комплекса QRS, время локальной реполяризации — как максимум первой производной униполярной электрограммы в период комплекса ST—T (см. рис. 1). Дисперсию интервалов активация—восстановление вычисляли как разность между максимальным и минимальным значениями интервалов активация—восстановление. Данные представлены в виде среднего ± стандартного отклонения. Статистический анализ полученных данных проводили с помощью критерия Манна—Уитни и критерия Вилкоксона.
Рис. 1. Распределение электродов по эпикардиальной поверхности желудочков у крысы.
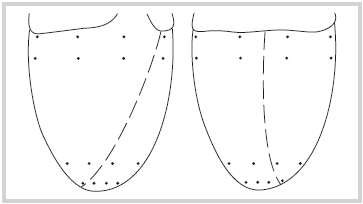
Пунктирной линией обозначена межжелудочковая борозда. ЛЖ — левый желудочек; ПЖ — правый желудочек.
Результаты
У крыс с суженной левой почечной артерией систолическое и среднее артериальное давление составило 155—186 (160±11) и 108—150 (117±12) мм рт.ст. соответственно, что значимо больше (p<0,001), чем у контрольных крыс (113±5 и 84±4 мм рт.ст. соответственно). Стеноз почечной артерии у крыс вызывал умеренную ГЛЖ. Относительная масса ЛЖ у гипертензивных крыс составила 0,34±0,02, что на 26% больше (p<0,001), чем у контрольных животных (0,27±0,03). Относительная масса ПЖ у гипертензивных (0,067±0,015) и контрольных (0,071±0,012) крыс не различалась. Различий по частоте сердечных сокращений между гипертензивной (290±45 уд/мин) и контрольной (269±64 уд/мин) группами животных не было выявлено (частота сердечных сокращений указана у животных со вскрытой грудной клеткой).
Длительность среднего интервала активация—восстановление на поверхности ЛЖ у крыс с ГЛЖ составила 24,1±0,7 мс, что значимо больше (p<0,001), чем у контрольных животных (14,0±5,0 мс). На поверхности ПЖ у крыс с ГЛЖ длительность среднего интервала активация—восстановление также была больше, чем у контрольных крыс (21,0±4,3 и 13,1±3,6 мс соответственно, p<0,001). Длительность интервалов активация—восстановление была увеличена как в основании, так и на верхушке обоих желудочков (рис. 2).
Рис. 2. Определение длительности интервала активация—восстановление.
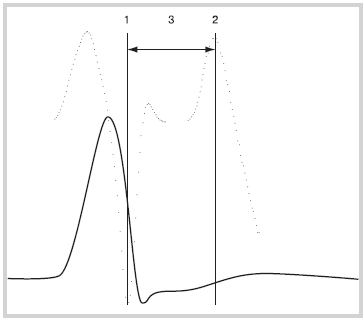
Толстая сплошная линия — униполярная электрограмма; пунктирная линия — график первой производной электрограммы; вертикальные линии 1 и 2 — момент активации и реполяризации, соответственно, в зоне регистрации электрограммы; 3 — интервал активация—восстановление.
У крыс с ГЛЖ и контрольных животных дисперсии интервалов активация—восстановление не различались на эпикардиальной поверхности как ЛЖ (14,3±6,6 и 14,4±6,7 мс), так и ПЖ (13,3±1,8 и 11,6±3,2 мс). Общая дисперсия интервалов активация—восстановление на обоих желудочках также не различалась: 18,0±5,5 мс у крыс с ГЛЖ и 15,4±5,6 мс у контрольных животных.
Обсуждение
Развитие гипертензивной ГЛЖ приводило к удлинению интервалов активация—восстановление в 1,7 раза на поверхности ЛЖ. Это согласуется с удлинением потенциалов действия субэпикардиальных кардиомиоцитов при ГЛЖ различного генеза [1—3, 5—7, 10]. Однако в данной работе нами впервые показано, что при ГЛЖ, вызванной реноваскулярной гипертензией, изменяется длительность реполяризации миокарда не только ЛЖ, но и ПЖ, причем интервалы активация—восстановление на поверхности ПЖ удлинялись также в 1,7 раза. Ранее было показано увеличение длительности потенциалов действия кардиомиоцитов обоих желудочков при экспериментальной констрикции аорты [11]. Однако эти изменения в длительности потенциалов действия кардиомиоцитов ПЖ происходили при наличии гипертрофии ПЖ. В нашем исследовании удлинение интервалов активация—восстановление выявлено без гипертрофии ПЖ. Это свидетельствует о том, что электрофизиологические эффекты реноваскулярной гипертензии связаны не только с развитием ГЛЖ.
Механизм изменения реполяризационных свойств миокарда ПЖ обусловлен, вероятно, действием на трансмембранные ионные токи в кардиомиоцитах ПЖ ангиотензина II и альдостерона, концентрация которых увеличивается при реноваскулярной гипертензии. Длительность реполяризации желудочковых кардиомиоцитов и, следовательно, длительность реполяризации миокарда желудочков у крысы обусловлена несколькими калиевыми реполяризующими токами — прежде всего, транзиторным выходящим током Ito, а также токами входящего (IK1) и задержанного (IKr, Isus) выпрямления [12], и деполяризующими токами — кальциевым током L-типа (ICa,L), натриевым током (INa) и током Na+/Ca2+-обмена (INaCa) [12, 13]. Кроме того, длительность потенциала действия в кардиомиоцитах модулируется хлорными токами [14]. Все эти токи подвержены влиянию ангиотензина II и/или альдостерона.
Ранее было показано, что хроническое повышение уровня ангиотензина II приводит к увеличению длительности потенциалов действия кардиомиоцитов через воздействие на реполяризующие калиевые токи IK1 [15], Ito [16] и Isus [17]. Вместе с тем блокада АТ1-рецепторов ангиотензина II лозартаном способствовала нормализации реполяризации миокарда ЛЖ, изменившейся в связи с развитием обусловленной реноваскулярной гипертензией ГЛЖ [18], и предотвращению развития ГЛЖ, и связанными с ней удлинением потенциалов действия и других электрофизиологических изменений [19]. Альдостерон также способствует удлинению потенциалов действия кардиомиоцитов [20, 21], в том числе за счет подавления тока Ito [22].
Другие возможные механизмы удлинения реполяризации при ГЛЖ могут быть связаны с ингибированием хлорных каналов [23, 24], усилением кальциевого тока ICa,L [22—26] и тока Na+/Ca2+-обмена INaCa [27, 28], а также с нарушением инактивации натриевого тока INa [29, 30]. Данные электрофизиологические эффекты обусловлены в основном действием ангиотензина II и альдостерона.
На основании изложенного можно предположить, что в наших экспериментах хроническое увеличение уровня ангиотензина II при реноваскулярной гипертензии вследствие сужения почечной артерии ингибирует большинство калиевых токов и активирует входящий кальциевый ток, увеличивая длительность потенциалов действия кардиомиоцитов обоих желудочков напрямую или/и через продукцию альдостерона параллельно или опережая развитие ГЛЖ. Однако эти предположения нуждаются в непосредственном экспериментальном подтверждении. Кроме того, необходимы дополнительные исследования для выяснения, какой из калиевых токов в кардиомиоцитах вносит больший вклад в пролонгирование реполяризации ПЖ при реноваскулярной гипертензии у крыс как широко распространенных животных для моделирования артериальной гипертензии и ГЛЖ. По-видимому, им является транзиторный выходящий калиевый ток Ito, поскольку его подавление в кардиомиоцитах ЛЖ при развитии ГЛЖ вследствие перегрузки давлением вносит больший вклад в удлинение потенциалов действия по сравнению с токами IK1 и IK [5]. Это согласуется с данными, полученными при сравнении трансмембранных калиевых токов у спонтанно гипертензивных и нормотензивных крыс [31]. Ввиду видоспецифичности электрофизиологии миокарда желудочков у позвоночных животных [12] полученные данные необходимо обобщать с осторожностью.
Дисперсия реполяризации эпикардиальной поверхности желудочков не отличалась у крыс с гипертензивной ГЛЖ и контрольных крыс. Возможны несколько объяснений этого. Во-первых, известно о модулирующем влиянии ангиотензина II на хлорный ток в желудочковых кардиомиоцитах кролика [32] и хлорном токе в клетках гипертрофированного миокарда у крысы [33], а появление и/или активация хлорных токов вносит вклад в укорочение потенциалов действия кардиомиоцитов [14]. Во-вторых, вследствие изменения баланса между калиевым Ito и кальциевым ICa,L токами при развитии ГЛЖ у крысы уменьшается межрегиональная гетерогенность реполяризации [34]. В-третьих, высокая частота сердечных сокращений ослабляет пролонгацию потенциалов действия кардиомиоцитов, возникающую при развитии ГЛЖ и сердечной недостаточности [35]. В связи с последним фактом изменение дисперсии реполяризации миокарда желудочков при реноваскулярной гипертензии у человека будет, вероятно, более выражено, чем обнаруженное нами у крысы.
О структурном и электрическом ремоделировании в гипертрофированном миокарде хорошо известно [13, 31, 36, 37]. Результаты представленной работы свидетельствуют о том, что при реноваскулярной гипертензии, приводящей к развитию ГЛЖ, происходит электрическое ремоделирование миокарда ПЖ без увеличения его массы.
Заключение
Таким образом, при экспериментальной гипертрофии левого желудочка у крыс, вызванной реноваскулярной гипертензией, увеличивается длительность реполяризации эпикардиальной поверхности не только левого, но и правого желудочка, что обусловлено, вероятно, системным действием ангиотензина II и/или альдостерона; дисперсия реполяризации эпикардиальной поверхности желудочков не изменяется.
Исследование поддержано Уральским отделениемРАН (Программа поддержки интеграционных проектов,выполняемых в УрО РАН совместно с ДВО РАН), Фондомсодействия отечественной науке.



