Коронарная ангиопластика (КА) — признанный и эффективный метод реваскуляризации миокарда. В случае клинической необходимости КА в настоящее время рассматривается в качестве первого метода реваскуляризации миокарда при изолированных однососудистых поражениях коронарного русла. В то же время применение коронарной ангиопластики при многососудистом поражении до сих пор остается предметом дискуссий [1—8]. Так, ранее проведенные исследования, в которых сравнивали коронарное шунтирование (КШ) с чрескожными коронарными вмешательствами (ЧКВ), показали полную сопоставимость методов по такому одному из наиболее значимых критериев, как отдаленная выживаемость. Единственным недостатком ЧКВ в этих исследованиях признавалась частота повторных вмешательств, которая наблюдалась достоверно чаще при стентировании [1—11].
Появление стентов с лекарственным покрытием в настоящее время позволило существенно снизить вероятность рестеноза в ранее стентированном сегменте и, как следствие, количество повторных вмешательств в отдаленном периоде [2, 3, 5, 6, 8, 11]. Однако доказательная база большинства этих исследований получена на группах больных с однососудистым поражением коронарного русла. На современном этапе развития сердечно-сосудистой хирургии по-прежнему остается актуальным сравнение двух методов реваскуляризации в группе пациентов с многососудистым поражением коронарного русла ввиду постоянного развития и распространения эндоваскулярной хирургии.
Целью настоящего исследования являлось сравнение результатов КШ и коронарной ангиопластики с использованием стентов с лекарственным покрытием у больных со стабильной формой ишемической болезни сердца (ИБС) и многососудистым поражением коронарного русла.
Материал и методы
 В исследование включены 619 пациентов с многососудистым поражением коронарного русла. В зависимости от использованного метода реваскуляризации пациенты были распределены на 2 группы. В 1-ю группу были включены 317 пациентов, которым выполнено КШ. Во 2-ю группу включены 302 пациента, которым выполнено ЧКВ — многососудистая коронарная ангиопластика с использованием различных стен-тов с лекарственным покрытием (Cypher, Endeavor, Taxus, Promus) разных производителей. Обе группы были сопоставимы по основным клиническим и ангиографическим характеристикам (табл. 1). Критериями включения в исследование являлись стенокардия напряжения III—IV функционального класса (ФК) по Канадской классификации, многососудистое поражение коронарного русла (наличие стенозов >50% как минимум в 2 крупных эпикардиальных артериях в 2 различных коронарных бассейнах передней межжелудочковой артерии, огибающей артерии или правой коронарной артерии), распространенность поражения и техническая сложность выполнения стентирования по балльной системе Syntax менее 20, техническая возможность выполнения обоих методов реваскуляризации миокарда у пациентов с достижением полной анатомической реваскуляризации миокарда. Из исследования были исключены пациенты с гемодинамически значимым поражением ствола левой коронарной артерии (ЛКА) >50% и фракцией выброса (ФВ) левого желудочка (ЛЖ) < 50%.
В исследование включены 619 пациентов с многососудистым поражением коронарного русла. В зависимости от использованного метода реваскуляризации пациенты были распределены на 2 группы. В 1-ю группу были включены 317 пациентов, которым выполнено КШ. Во 2-ю группу включены 302 пациента, которым выполнено ЧКВ — многососудистая коронарная ангиопластика с использованием различных стен-тов с лекарственным покрытием (Cypher, Endeavor, Taxus, Promus) разных производителей. Обе группы были сопоставимы по основным клиническим и ангиографическим характеристикам (табл. 1). Критериями включения в исследование являлись стенокардия напряжения III—IV функционального класса (ФК) по Канадской классификации, многососудистое поражение коронарного русла (наличие стенозов >50% как минимум в 2 крупных эпикардиальных артериях в 2 различных коронарных бассейнах передней межжелудочковой артерии, огибающей артерии или правой коронарной артерии), распространенность поражения и техническая сложность выполнения стентирования по балльной системе Syntax менее 20, техническая возможность выполнения обоих методов реваскуляризации миокарда у пациентов с достижением полной анатомической реваскуляризации миокарда. Из исследования были исключены пациенты с гемодинамически значимым поражением ствола левой коронарной артерии (ЛКА) >50% и фракцией выброса (ФВ) левого желудочка (ЛЖ) < 50%.
В периоде пребывания больных в стационаре оценены летальность, неблагоприятные кардиологические и цереброваскулярные исходы.
В отдаленном периоде наблюдения отслеживали выживаемость пациентов после реваскуляризации, рецидивы стенокардии и связанные с ними повторные реваскуляризации, а также комбинированный показатель тяжелых сердечно-сосудистых осложнений (смерть, острый инфаркт миокарда — ОИМ, нарушение мозгового кровообращения — ОНМК или повторная реваскуляризация миокарда).
Статистическая обработка полученных данных производилась при помощи программного пакета Microsoft Office Excel 2007 и MedCalc. Для оценки достоверности различий использовались парный коэфициент Студьюдента и тест Фишера для малых выборок. Анализ выживаемости проводили с помощью метода Каплана— Мейера. Различия считали статистически значимыми при p<0,05.
Данные представлены в виде графиков и таблиц.
Результаты
В госпитальном периоде достоверных различий по основным критериям сравнения между группами получено не было (табл. 2). Смертность в группе КШ составила 1,7% против 0,9% в группе ЧКВ, ОИМ отмечался в 2,6 и 1,9% случаев соответственно, ОНМК — в 0,9% и 0 случаев соответственно. Комбинированный показатель тяжелых осложнений (смерть, ОИМ, ОНМК) в сравниваемых группах составил 5,1 и 1,9% соответственно (р=0,37).
В отдаленном периоде общая выживаемость в группе КШ составила 90,2%, в группе ЧКВ — 92,7%. При сравнении кривых выживаемости по методу Каплана— Мейера достоверных различий между группами не получено (рис. 1).
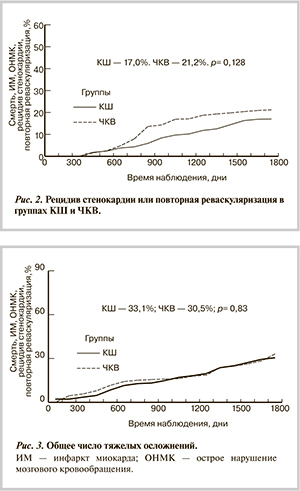
Рецидив стенокардии/повторная реваскуляризация наблюдались у 54 (17,0%) пациентов в группе КШ и у 64 (21,2%) в группе ЧКВ. Несмотря на общую тенденцию к большему количеству осложнений в группе ЧКВ, статистической значимости различий между группами не получено (р=0,128) (рис. 2). Повторная реваскуляризация на фоне рецидива стенокардии выполнена у 32 (59,3%) из 54 пациентов в группе КШ и 58 (90,6%) из 64 пациентов в группе ЧКВ.
Общее число тяжелых осложнений (смерть, ОИМ, ОНМК, рецидив стенокардии, повторная реваскуляризация) в группах за весь период наблюдения составило 33,1% в группе КШ и 30,5% в группе ЧКВ (рис. 3). Полученные результаты также не имели статистически значимых различий.
Обсуждение
В настоящее время для улучшения качества жизни больных ИБС с многососудистым поражением коронарного русла наибольшее распространение получили два метода реваскуляризации миокарда — КШ и коронарное стентирование. В достаточно большом количестве рандомизированных исследований сравнивались обе методики (CASS, BARI, CABRI, ARTS-I) [7, 10—15], однако большинство этих сравнений выполнено со стентами без лекарственного покрытия. Таким образом, большинство этих сравнений в настоящее время утратили свою значимость и не могут отражать современную реальность.
В то же время общие закономерности, найденные в предыдущих исследованиях, актуальны и в настоящее время. Наиболее значимым из них является то, что реваскуляризация миокарда у пациентов со стабильной стенокардией (за исключением поражения ствола ЛКА >50%, трехсосудистого поражения и/или сниженной ФВ ЛЖ) не увеличивает продолжительность жизни больных. Чаще оба метода реваскуляризации миокарда в настоящее время применяются для улучшения качества жизни пациентов, т. е. для увеличения толерантности к физической нагрузке, и абсолютно не заменяют оптимальную медикаментозную терапию [6, 8, 9, 14, 16—19].
Результаты, полученные в нашем исследовании, свидетельствуют о высокой клинической эффективности обоих методов реваскуляризации миокарда. У всех пациентов обеих групп, перенесших реваскуляризацию миокарда без клинических осложнений, отмечено полное нивелирование симптомов стенокардии или увеличение толерантности к физической нагрузке минимум на 2 ФК.
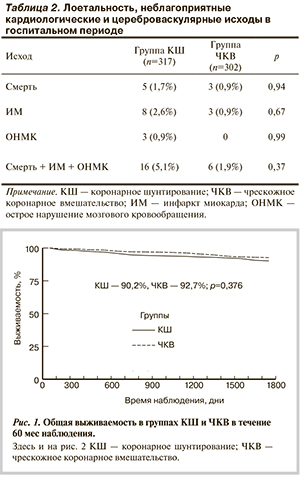 В госпитальном периоде в изучаемых группах отмечалось малое число осложнений. При этом достоверных различий по числу летальных исходов, интраоперационных ОИМ и ОНМК в сравниваемых группах не получено. Комбинированный показатель из перечисленных выше осложнений также статистически значимо не различался и составил 5,1% в группе КШ и 1,9% в группе ЧКВ (p>0,05). Специфические осложнения, связанные с методом реваскуляризации, такие как рестернотомия, развитие мерцательной аритмии и другие, свойственные для КШ, или гематомы, ложные аневризмы в месте пункции, свойственные для ЧКВ, не являлись предметом анализа в данном исследовании.
В госпитальном периоде в изучаемых группах отмечалось малое число осложнений. При этом достоверных различий по числу летальных исходов, интраоперационных ОИМ и ОНМК в сравниваемых группах не получено. Комбинированный показатель из перечисленных выше осложнений также статистически значимо не различался и составил 5,1% в группе КШ и 1,9% в группе ЧКВ (p>0,05). Специфические осложнения, связанные с методом реваскуляризации, такие как рестернотомия, развитие мерцательной аритмии и другие, свойственные для КШ, или гематомы, ложные аневризмы в месте пункции, свойственные для ЧКВ, не являлись предметом анализа в данном исследовании.
В отдаленном периоде общая выживаемость в группах осталась высокой и составила в группах КШ и ЧКВ 90,2 и 92,7% соответственно (р>0,05). Отмечалась некоторая тенденция к большему количеству рецидивов стенокардии в группе ЧКВ — 21,2% против 17% в группе КШ. Выполнить повторную реваскуляризацию миокарда у пациентов с рецидивом стенокардии после первичной реваскуляризации удавалось чаще в группе ЧКВ — 90,6%, и лишь в 59,3% случаев в группе КШ. Основной причиной редицива стенокардии в группе ЧКВ в 8,4% случаев являлся рестеноз в ранее стентированных сегментах артерий и остальных 12,8% случаев — прогрессирование атеросклероза за пределами стентированного сегмента или в других коронарных бассейнах. В то же время общее количество тяжелых неблагоприятных исходов в группах к 60-му месяцу наблюдения было практически одинаковым и не имело статистических различий.
В настоящее время КШ остается методом выбора для реваскуляризации миокарда у пациентов с многососудистым поражением коронарного русла. Однако стремительный прогресс, непрерывно продолжающийся в эндоваскулярной хирургии в течение последних 20 лет, позволил коронарному стентированию максимально приблизиться к современным результатам КШ при многососудистом поражении коронарного русла [4, 5, 10, 11, 15, 19—22].
При анализе ранее проведенных исследований прослеживается четкая тенденция к нивелированию разницы по отдаленным результатам между данными методами реваскуляризации. Если в исследованиях BARI и CABRI преимущество КШ над КА по повторным реваскуляризациям составляло 34%, то в исследовании ARTS I эта разница уменьшилась до 14%, а по данным исследования SYNTAX, разница по повторным реваскуляризациям в течение первого года наблюдения составила лишь 5,5% с последующим плавным ростом до 12,2% в течение последующих 4 лет [10, 13, 16, 19, 23, 24].
Меньшие инвазивность и финансовая нагрузка, быстрая реабилитация после вмешательства и сопоставимая с КШ непосредственная клиническая эффективность исходно определяют ЧКВ как более привлекательную методику реваскуляризации миокарда. Однако долгосрочность сохранения полученного клинического эффекта от ЧКВ остается одним из недостатков данного метода. Преимущество КШ по последнему параметру заставляет клиницистов отдавать предпочтение данному методу реваскуляризации в отдельных анатомических и клинических ситуациях. Теоретическим объяснением данного преимущества КШ является то, что адекватно работающий шунт продолжает «защищать» миокард в бассейне шунтированной артерии, несмотря на прогрессирование атеросклероза в нативном русле проксимальнее места анастомоза [7, 25]. Относительно медленный процесс дегенерации шунтов, длящийся обычно 5—10 лет, приводит к более длительному сохранению клинического эффекта от реваскуляризации, несмотря на то что ряд исследований указывают на ускорение прогрессирования атеросклероза в нативном русле после КШ. В то же время данная особенность реакции нативного русла в сочетании с постепенно развивающейся дегенерацией шунтов к 5—10-му году может стать серьезной клинической проблемой, когда пациенту ни одним из методов невозможно выполнить повторную реваскуляризацию миокарда. Вероятно, этим фактом можно объяснить отсутствие преимущества КШ перед ЧКВ и медикаментозной терапией по такой конечной точке, как смерть от сердечнососудистых событий у пациентов с нераспространенным поражением коронарного русла. Тем не менее оправданность применения КШ при диффузном поражении проксимальных и средних отделов коронарного русла в настоящее время не вызывает сомнения, так как отдаленные результаты коронарного стентирования сопряжены с более высоким риском рестеноза. Кроме того, долгосрочная экономическая составляющая при нынешней стоимости стентов с лекарственным покрытием в случае диффузного поражения коронарного русла предполагает бо'льшую выгоду от использования КШ [2, 7, 17].
 Дополнительным преимуществом КШ может также являться возможность шунтирования артерий малого диаметра менее 1,5 мм, что может оказаться весьма важным у пациентов со сниженной насосной функцией ЛЖ. Максимально полная анатомическая реваскуляризация у данных больных теоретически может приводить к более значимому приросту ФВ ЛЖ и, как следствие, лучшим отдаленным результатам. Единственным недостатком в подобных клинических ситуациях остается проблема прогнозирования возможности установки шунтов в сосудах малого диаметра. Стремление выполнить максимально полную реваскуляризацию может нести дополнительный интраоперационный риск для пациента из-за увеличения времени операции и риска тромбоза шунтов и шунтированных ветвей, что в конечном итоге может привести к неблагоприятным операционным исходам [7, 23].
Дополнительным преимуществом КШ может также являться возможность шунтирования артерий малого диаметра менее 1,5 мм, что может оказаться весьма важным у пациентов со сниженной насосной функцией ЛЖ. Максимально полная анатомическая реваскуляризация у данных больных теоретически может приводить к более значимому приросту ФВ ЛЖ и, как следствие, лучшим отдаленным результатам. Единственным недостатком в подобных клинических ситуациях остается проблема прогнозирования возможности установки шунтов в сосудах малого диаметра. Стремление выполнить максимально полную реваскуляризацию может нести дополнительный интраоперационный риск для пациента из-за увеличения времени операции и риска тромбоза шунтов и шунтированных ветвей, что в конечном итоге может привести к неблагоприятным операционным исходам [7, 23].
Доступные в настоящее время данные долгосрочных исследований, таких как SYNTAX, FREEDOM и ASCERT в целом свидетельствуют о преимуществе КШ над ЧКВ при многососудистом поражении [8, 17, 21]. Чаще всего это трансформируется в меньшее количество повторных реваскуляризаций, ОИМ и, в ряде случаев, меньшую отдаленную летальность. Однако согласно исследованию SYNTAX, нельзя исключить, что исходная распространенность атеросклероза и сопутствующие заболевания, такие как сахарный диабет, играют ключевую роль в появлении данных преимуществ. В подгруппах больных с низкой оценкой по шкале Syntax Score отмечаются абсолютно сопоставимые результаты в течение первых 4—5 лет. Если учесть, что ОНМК достоверно чаще происходит при КШ независимо от распространенности коронарного атеросклероза, то данное обстоятельство может служить одним из доводов в пользу выбора ЧКВ в качестве метода реваскуляризации миокарда у больных с многососудистым поражением. Согласно мнению ряда специалистов, ОНМК могут существенно превосходить по своей клинической и социальной значимости такие неблагоприятные исходы, как рецидив стенокардии и неосложненный ОИМ [22—25].
Исходя из этих теоретических и практических предпосылок, несмотря на достаточно обнадеживающие данные ЧКВ при многососудистом поражении, КШ, по нашему мнению, остается методом выбора у пациентов с диффузным поражением коронарного русла, поражением ствола ЛКА, а также у пациентов c сопутствующим сахарным диабетом и сниженной ФВ ЛЖ. Прямые сравнения КШ и КА с использованием стентов с лекарственным покрытием дают обнадеживающие результаты (ARTS II, SYNTAX, CARDia, FREEDOM), однако требуется более длительное наблюдение (более 5—7 лет) для оценки клинической и экономической выгоды обоих методов у больных ИБС с многососудистым поражением коронарного русла [1, 8, 11, 17—22].
Заключение
У больных ишемической болезнью сердца с многососудистым поражением коронарного русла, низкими оценками по шкале Syntax Score непосредственные и отдаленные результаты коронарного стентирования при использовании стентов с лекарственным покрытием не уступают результатам коронарного шунтирования.



