Одним из основных направлений в лечении больных с различными формами ишемической болезни сердца (ИБС) являются эндоваскулярные процедуры, в частности стентирование коронарных артерий (КА). Появление стентов с лекарственным покрытием (СЛП) привело к значительному снижению частоты развития рестеноза в них в первый год наблюдения [1]. Несмотря на обнадеживающие результаты, полученные в ходе начальных исследований по оценке безопасности и эффективности СЛП первого поколения (покрытие сиролимусом и паклитакселем), в дальнейшем было отмечено, что в них тоже развивается рестеноз, но в более поздние сроки. Некоторые исследователи полагают, что антипролиферативные вещества, покрывающие стент, снижают риск развития рестеноза, но не предотвращают его, что и послужило причиной дальнейших исследований в этом направлении [2].
В ряде работ было показано, что концентрация маркеров воспаления до стентирования, а также в различные сроки после него может иметь связь с развитием рестеноза [3, 4]. Так, повышенный уровень С-реактивного белка (СРБ) и скорость оседания эритроцитов (СОЭ) являются неблагоприятными прогностическими факторами в отношении развития рестеноза после имплантации СЛП [5].
S. Yoneda и соавт. [6] было показано, что состав неоинтимы, сформированной после имплантации СЛП, отличается от такового после имплантации металлических стентов без лекарственного покрытия (МС). Количество гладких мышечных клеток в первом случае существенно меньше, при этом отмечается повышенная инфильтрация эозинофилами, макрофагами и Т-лимфоцитами. Возможно, это вызвано наличием полимера — базисного слоя, служащего резервуаром для постепенно высвобождающегося лекарственного препарата и равномерного распределения концентрации вещества в окружающих тканях в течение длительного времени.
 Развитие рестеноза — многофакторный процесс со сложными механизмами, в которые могут быть вовлечены разные типы клеток иммунной системы. Предполагают, что одним из возможных компонентов в патогенезе развития атеросклероза КА и рестеноза является эозинофильное воспаление. Так, в работе N. Giampaolo и соавт. [7] сделано предположение, что исходно повышенный уровень эозинофильного катионного белка (ЭКБ) — маркера активности эозинофилов – может быть прогностическим фактором сердечно-сосудистых осложнений после имплантации СЛП.
Развитие рестеноза — многофакторный процесс со сложными механизмами, в которые могут быть вовлечены разные типы клеток иммунной системы. Предполагают, что одним из возможных компонентов в патогенезе развития атеросклероза КА и рестеноза является эозинофильное воспаление. Так, в работе N. Giampaolo и соавт. [7] сделано предположение, что исходно повышенный уровень эозинофильного катионного белка (ЭКБ) — маркера активности эозинофилов – может быть прогностическим фактором сердечно-сосудистых осложнений после имплантации СЛП.
Цель данной работы — определить уровни ЭКБ и высокочувствительного С-реактивного белка (вч-СРБ) в сыворотке крови у пациентов с ИБС и сопоставить с тяжестью атеросклеротического поражения КА, а также оценить динамику уровня этих показателей после чрескожного коронарного вмешательства (ЧКВ).
Материал и методы
Критерием включения в исследование было наличие показаний к проведению коронарографии (КГ). В исследование не были включены пациенты с аллергическими реакциями или хроническими заболеваниями аллергической природы, а также с тяжелыми сопутствующими патологиями.
Всем включенным в исследование больным помимо стандартного лабораторного и инструментального обследования проводилось определение уровня вч-СРБ и ЭКБ в сыворотке крови. Все показатели были определены исходно (за 24 ч до КГ) и на 3-и сутки после процедуры.
Кровь для исследования брали из локтевой вены пациентов утром натощак в пробирки с активатором свертывания (каолин). Образцы крови для определения уровня ЭКБ подвергали инкубации (2 ч при температуре 25 оС), затем их центрифугировали в течение 10 мин при 1500 об/мин. После этого образцы сыворотки крови замораживали и хранили при температуре –70 оС. Уровень ЭКБ определяли иммуноферментным методом на автоматическом хемилюминесцентном анализаторе Immulite-1000. Уровень вч-СРБ определяли высокочувствительным нефелометрическим методом на автоматическом лазерном нефелометре BN-proSpec.
Гемодинамически значимым считали атеросклеротическое поражение коронарного русла, сужающего просвет артерии на 70% и более. В случаях стенозирования ствола левой КА гемодинамически значимым считали сужение просвета более 50%. Тяжесть атеросклеротического поражения определяли по шкале SYNTAX, которая используется для определения оптимальной стратегии хирургического лечения. К категории низкого риска относятся пациенты с суммой баллов от 0 до 22; среднего риска — от 23 до 32 баллов; высокого риска — ≥33 баллов.
Рестенозом считали атеросклеротическое поражение ранее стентированного участка (внутри стента и на 5 мм проксимальнее или дистальнее стента), суживающего просвет стента на 50% и более.
Статистическую обработку данных проводили с использованием программы Statistica (StatSoft 5). Оценку достоверности межгрупповых различий выполняли с помощью критерия U Манна—Уитни, а оценку достоверности изменений динамики показателя — с помощью парного критерия Вилкоксона. При сравнении качественных признаков использовали точный двусторонний критерий F Фишера. Результаты приведены в виде медианы, верхнего и нижнего квартилей.
Результаты
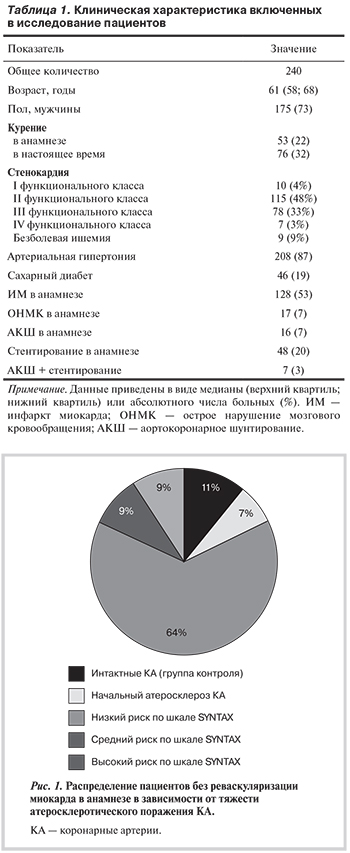
В исследование включено 240 пациентов, соответствующих критериям включения и исключения, находившихся на обследовании и лечении в ФГБУ РКНПК МЗ РФ в период с сентября 2012 г. по декабрь 2014 г. Клиническая характеристика пациентов представлена в табл. 1. Из всех больных, включенных в исследование, были выделены 169 пациентов, ранее не подвергавшихся реваскуляризации миокарда. По результатам КГ у 28 пациентов диагноз ИБС не был подтвержден. Это пациенты с интактными КА (n=17), которые составили группу контроля, и пациенты с начальным атеросклерозом КА (n=11). Остальные пациенты в зависимости от тяжести атеросклеротического поражения КА были разделены на группы риска по шкале SYNTAX: низкого (n=109), среднего (n=16) и высокого (n=16; рис. 1).
 Были также выделены 71 больной, которые до включения в исследование подвергались реваскуляризации миокарда: 48 пациентов со стентированием в анамнезе, 16 — после аортокоронарного шунтирования (АКШ) и 7 пациентов, которым были проведены стентирование и АКШ (рис. 2).
Были также выделены 71 больной, которые до включения в исследование подвергались реваскуляризации миокарда: 48 пациентов со стентированием в анамнезе, 16 — после аортокоронарного шунтирования (АКШ) и 7 пациентов, которым были проведены стентирование и АКШ (рис. 2).
Имплантация СЛП была выполнена у 184 пациентов (всего 281 стент, в среднем 1,5 стента у одного больного).
Тяжесть атеросклеротического поражения КА и уровень ЭКБ и вч-СРБ. Мы провели сравнение уровня ЭКБ в зависимости от тяжести атеросклеротического поражения КА (проанализированы группы пациентов, ранее не подвергавшихся реваскуляризации миокарда) и выявили, что у пациентов с интактными КА уровень ЭКБ достоверно ниже, чем у пациентов из групп среднего и высокого риска по шкале SYNTAX, и составил соответственно 8,7 [6,5;11,5] нг/мл, 13,3 [11,3;16,9] нг/мл и 15,6 [10,6;18,8] нг/мл, р<0,05. Уровень ЭКБ в группе пациентов с начальным атеросклерозом и в группе низкого риска по шкале SYNTAX достоверно не отличался и составил соответственно 10,5 [7,2;14,4] нг/мл и 10,7 [7,9;14,4] нг/мл, р=0,4 (рис. 3).
Уровень вч-СРБ в группах достоверно не отличался и составил: у лиц с интактными КА – 0,24 [0,07;0,35] мг/л, в группе с начальным атеросклерозом КА – 0,34 [0,2;0,4] мг/л, у пациентов низкого риска по шкале SYNTAX – 0,19 [0,1;0,36] мг/л, у пациентов среднего риска по шкале SYNTAX – 0,25 [0,17;0,39] мг/л, у пациентов высокого риска по шкале SYNTAX – 0,19 [0,09;0,32] мг/л, (р=0,54).
Анализ уровней ЭКБ и вч-СРБ в группе пациентов с реваскуляризацией миокарда в анамнезе. Уровень ЭКБ у пациентов со стентированием в анамнезе, пациентов после АКШ и в группе АКШ+стентирование достоверно не отличался. При сравнении с группой контроля (лица с интактными КА) выявлена тенденция к достоверности отличий в группах с АКШ в анамнезе (табл. 2).
Уровень вч-СРБ в группах достоверно не отличался и составил: у пациентов со стентированием в анамнезе 0,2 [0,09;0,3] мг/л, у пациентов после АКШ – 0,07 [0,05;0,2] мг/л, в группе АКШ+стентирование – 0,1 [0,07;0,2] мг/дл, р=0,2.
Уровень ЭКБ и вч-СРБ у пациентов с рестенозом стента и без рестеноза. Из всех вошедших в исследование пациентов были выделены 55 человек, которым ранее было проведено стентирование (давность стентирования составила 6—60 мес, в среднем 29 мес). По результатам повторной ангиографии у 13 был выявлен рестеноз в месте установки стента. Уровень ЭКБ у пациентов без рестеноза составил 10,8 [8,7;15,7] нг/мл, у пациентов с рестенозом —10,3 [7,4; 16,5] нг/мл (р=0,7). Уровень вч-СРБ у пациентов без рестеноза составил 0,145 [0,08;0,31] мг/л, с рестенозом — 0,24 [0,08;0,445] мг/л (р=0,8).
Динамика уровня ЭКБ после ЧКВ. У пациентов, подвергшихся имплантации стентов, на 3-и сутки после процедуры отмечено достоверное повышение уровня ЭКБ в сыворотке крови с 11,6 [8,7;17,4] нг/мл до 14,7 [10,1;20,7] нг/мл (р<0,001). Уровень ЭКБ достоверно повышался после имплантации стентов, покрытых как эверолимусом, так и зотаролимусом. При этом у больных, которым ангиопластика и стентирование не проводились, уровень ЭКБ исходный и на 3-и сутки после КГ достоверно не отличался и составил соответственно 11,2 [8,7; 12,6] нг/мл и 12,8 [9,0;15,3] нг/мл (р=0,2) (рис. 4).
Динамика уровня вч-СРБ после ЧКВ. Уровень вч-СРБ достоверно повышался как на 3-и сутки после КГ (исходный уровень вч-СРБ 0,19 – [0,08;0,34]мг/л, на 3-и сутки – 0,4 [0,2;0,6] мг/л, р<0,001), так и после имплантации стентов (исходный уровень вч-СРБ – 0,2 [0,1;0,4] мг/л, на 3-и сутки – 0,5 [0,3;1,0] мг/л, р<0,001). Уровень вч-СРБ повышался независимо от покрытия стента (эверолимус или зотаролимус).

Обсуждение
По данным нашего исследования, уровень СРБ у пациентов с тяжелым многососудистым поражением КА и лиц с интактными КА достоверно не различался. Нами установлено, что уровень ЭКБ у пациентов со средним и высоким риском по шкале SYNTAX был достоверно выше, чем лиц с интактными КА. Эти результаты согласуются с опубликованными ранее данными [8]. В это исследование были включены 198 пациентов с болевым синдромом в грудной клетке, которым проводилась КГ. У 148 из них был выявлен атеросклероз КА: у 90 человек со стабильной стенокардией и у 58 с острым коронарным синдромом без подъема сегмента ST (ОКСбпST). У 50 человек выявлены интактные КА. Было показано, что у пациентов с атеросклерозом КА уровень ЭКБ достоверно выше: у пациентов со стабильной стенокардией — 30 [13,8; 46,9] нг/мл, у пациентов с ОКСбпST — 21 [5,5; 46,3] нг/мл (р=0,45), чем у пациентов с интактными КА, — 9,7 [6,1; 13,6] нг/мл (р<0,001). Уровень СРБ у пациентов с ОКСбпST составил 2,38 [1,11;11,94] мг/л и был достоверно выше, чем у пациентов со стабильной стенокардией — 1,48 [0,82;2,83] мг/л (р=0,03) и с интактными КА — 1,09 [0,8;2,1] мг/л (р<0,001). Таким образом, авторы данной работы предполагают, что эти два маркера воспаления отражают различные варианты течения ИБС: повышение уровня ЭКБ ассоциировано с тяжестью атеросклеротического поражения, а уровень СРБ отражает нестабильность атеросклеротической бляшки. И, возможно, если у больных с болевым синдромом в грудной клетке помимо основных факторов риска определяется повышенный уровень ЭКБ, это позволяет с большей долей вероятности обнаружить у них коронарный атеросклероз. При дальнейших исследованиях эти предположения подтвердились. В исследование G. Nicola и соавт. (2014) были включены 40 больных с ИБС (23 пациента со стабильной стенокардией и 17 с ОКСбпST) с процедурами ЧКВ в анамнезе, у которых по данным КГ был выявлен рестеноз (период наблюдения составил в среднем 13 мес.). Оценка рестеноза в стенте проводилась методом оптической когерентной томографии. Оказалось, что у пациентов с уровнем ЭКБ >4,5 нг/мл была более выраженная гиперплазия неоинтимы (70±14%), которая определялась как площадь неоинтимы/площадь стента ×100%, по сравнению с таковой у пациентов с уровнем ЭКБ <4,5 нг/мл (64±11%; р=0,05) [9]. Кроме того, есть данные, на основании которых можно предположить, что более высокий уровень ЭКБ может свидетельствовать о повышенном риске развития рестеноза [10, 11]. В работах З.А. Габбасова и соавт. [10, 11] показано, что рестеноз чаще выявляется у пациентов с более высоким уровнем ЭКБ в плазме крови. Однако, по нашим данным, у 13 пациентов с рестенозом уровень ЭКБ, определяемый до повторной КГ, достоверно не отличался от уровня ЭКБ у пациентов без рестеноза. Возможно, такие результаты получены вследствие того, что давность проведения процедуры ангиопластики со стентированием у пациентов составила в среднем 29 мес (6—60 мес), тогда как в опубликованных ранее работах сроки наблюдения не превышали 12 мес.
 В ходе работы мы попытались оценить динамику уровней ЭКБ и вч-СРБ до и после ЧКВ. Уровень вч-СРБ достоверно повышался как после КГ, так и после имплантации стентов. Сходные данные были получены в исследовании G. Alexander и соавт. (2003) [12], в которое были включены 26 пациентов со стабильной ИБС. У 13 из них было выполнено стентирование КА, а остальным проведена диагностическая КГ. Показано, что уровень СРБ повышался через 24 и 48 ч после процедуры в обеих группах. Можно предположить, что КГ также вызывает системный воспалительный ответ организма, как и ангиопластика со стентированием КА, но во втором случае выраженность воспалительного ответа выше.
В ходе работы мы попытались оценить динамику уровней ЭКБ и вч-СРБ до и после ЧКВ. Уровень вч-СРБ достоверно повышался как после КГ, так и после имплантации стентов. Сходные данные были получены в исследовании G. Alexander и соавт. (2003) [12], в которое были включены 26 пациентов со стабильной ИБС. У 13 из них было выполнено стентирование КА, а остальным проведена диагностическая КГ. Показано, что уровень СРБ повышался через 24 и 48 ч после процедуры в обеих группах. Можно предположить, что КГ также вызывает системный воспалительный ответ организма, как и ангиопластика со стентированием КА, но во втором случае выраженность воспалительного ответа выше.
В нашем исследовании имплантация стентов, в отличие от КГ, ведет к повышению активности эозинофилов, определяемой по уровню ЭКБ в сыворотке крови. Возможно, что повышение уровня ЭКБ вызвано наличием полимера. В исследование G. Nicola и соавт. (2015) были включены 54 пациента, которым были имплантированы разные стенты: МС — 11 пациентам, стенты, покрытые рапамицином, — 27, стенты, покрытые рапамицином с биорастворимым полимером, — 16 пациентам. Уровень ЭКБ определяли исходно, через 6 и 12 мес после процедуры. Оказалось, что через год уровень ЭКБ был выше у пациентов, подвергшихся имплантации стентов, покрытых рапамицином, — 8,61 [6,55;19,77] нг/мл, по сравнению с пациентами, которым были имплантированы стенты с биорастворимым полимером, — 2,03 [1,78;8,95] нг/мл, и МС — 2,23 [1,45;8,95] нг/мл (р=0,02) [13].
В настоящее время неясно, оказывает ли динамика уровня ЭКБ после стентирования влияние на развитие рестеноза в дальнейшем. Возможно, активация эозинофилов, их дегрануляция и последующее высвобождение ЭКБ сопровождаются усилением фиброза тканей, стимуляцией трансформирующего фактора β-роста (TGF-β), интерлейкина-1β, которые участвуют в процессе ремоделирования тканей [14]. Согласно этим данным, процесс гиперплазии неоинтимы в ответ на повреждение стенки сосуда каркасом стента может стимулироваться повышенной активностью эозинофилов и секретируемых ими белков, в частности ЭКБ. Однако вопросы о том, является ли данное предположение верным, имеет ли уровень ЭКБ прогностическое значение и есть ли взаимосвязь между динамикой уровня ЭКБ и развитием сердечно-сосудистых осложнений, остаются открытыми.
Уже в течение нескольких лет сформировано представление об атеросклерозе как о вялотекущем хроническом воспалительном процессе [15], в который вовлечены различные типы клеток иммунной системы и гуморальные реакции. Изучаются различные маркеры воспаления как возможные предикторы неблагоприятных исходов у пациентов с ИБС. Однако мы понимаем, что изучение отдельно взятых маркеров системного воспаления не может дать полного представления о всех аспектах воспалительного процесса как при прогрессировании атеросклероза, так и при развитии рестеноза, так как изолированное изменение какого-либо компонента иммунной системы не является высокоспецифичным и может отражать любой локальный воспалительный процесс в организме. Поэтому для более полного понимания патогенетических звеньев развития атеросклероза и его осложнений необходимы не только дальнейшее изучение различных маркеров воспаления, но и комплексная оценка их внутренней взаимосвязи.
Заключение
У пациентов с более тяжелым поражением коронарного русла уровень активности эозинофилов (определенной по уровню эозинофильного катионного белка) выше, чем у лиц с интактными коронарными артериями, что может свидетельствовать об участии этих клеток в прогрессировании атеросклероза коронарных артерий. Имплантация стентов с лекарственным покрытием, в отличие от коронарографии, ведет к повышению активности эозинофилов, независимо от типа покрытия стента (эверолимусом или зотаролимусом). Имплантация стентов с лекарственным покрытием ведет к более выраженному воспалительному ответу, определяемому по уровню высокочувствительного С-реактивного белка, чем коронарография.



