В связи с широкой распространенностью заболеваний сердца, приводящих к хронической сердечной недостаточности (ХСН), проблема развития и внедрения трансплантации сердца (ТС) становится все более актуальной. Ежегодно в мире проводится более 2,5 тыс. операций по пересадке сердца. Более 30 лет мировой практики в области трансплантологии сердца позволили добиться уровня выживания пациентов после операций, превышающего 70% [1, 2].
Основным показанием к ТС служит терминальная стадия ХСН, когда существует прямая угроза жизни больному и нет перспективы выжить без ТС [3]. Причинами развития терминальной стадии ХСН являются различные заболевания, которые можно объединить в следующие группы: 1) идиопатическая кардиомиопатия (КМП); 2) ишемическая КМП; 3) врожденные пороки и прочие болезни сердца. Первая категория занимает 54% от общего количества патологий, вызывающих необходимость пересадки сердца, вторая — 45%, третья — 1% [4].
В настоящее время в Белорусском Республиканском научно-практическом центре (РНПЦ) «Кардиология» успешно выполняются операции по ТС и активно формируется «Лист ожидания на ТС». Первая в республике ортотопическая трансплантация сердца (ОТС) состоялась 12 февраля 2009 г. За период с 2009 г. по август 2013 г. в Центре проведено 100 ТС.
 В «Лист ожидания на ТС» c 2008 по 2012 г. были включены 324 пациента в возрасте моложе 65 лет с ХСН III—IV функционального класса по классификации Нью-Йоркской ассоциации сердца (NYHA) с фракцией выброса левого желудочка (ФВ ЛЖ) ≤25%, резистентных к медикаментозной терапии. Отбор пациентов осуществлялся по результатам обследования в 2 этапа: I этап (скрининг) — консультативно-поликлиническое отделение РНПЦ «Кардиология», II этап — 3 кардиологическое отделение РНПЦ «Кардиология». При наличии эффекта фармакотерапии пациенты оставались под амбулаторным наблюдением с последующей повторной консультацией через 3 и 6 мес для оценки статуса.
В «Лист ожидания на ТС» c 2008 по 2012 г. были включены 324 пациента в возрасте моложе 65 лет с ХСН III—IV функционального класса по классификации Нью-Йоркской ассоциации сердца (NYHA) с фракцией выброса левого желудочка (ФВ ЛЖ) ≤25%, резистентных к медикаментозной терапии. Отбор пациентов осуществлялся по результатам обследования в 2 этапа: I этап (скрининг) — консультативно-поликлиническое отделение РНПЦ «Кардиология», II этап — 3 кардиологическое отделение РНПЦ «Кардиология». При наличии эффекта фармакотерапии пациенты оставались под амбулаторным наблюдением с последующей повторной консультацией через 3 и 6 мес для оценки статуса.
Целью настоящего исследования являлось изучение влияния пред- и посттрансплантационных факторов на годичную выживаемость после ОТС.
Материал и методы
В исследование были включены 72 пациента, которым была выполнена ОТС. Возраст пациентов на момент операции составлял от 18 до 64 лет (средний возраст 45,3±11,9 года).
В работе анализировались следующие предтрансплантационные факторы: гистосовместимость по HLA A-B-DR, возраст реципиента, предтрансплантационная патология реципиента, статус реципиента по шкале UNOS, предшествующие хирургические вмешательства, состояние внутрисердечной гемодинамики, выраженность легочной гипертензии у реципиента, концентрация С-реактивного белка (СРБ), мозгового натрийуретического пептида (BNP), тропонина I и прокальцитонина в сыворотке крови. Интра- и посттрансплантационные факторы включали возраст донора, длительность ишемии трансплантата, развитие реакции острого отторжения трансплантата (РООТ), необходимость в постоянной электрокардиостимуляции, развитие сахарного диабета (СД), артериальной гипертензии (АГ), состояние внутрисердечной гемодинамики, инфекционные факторы [5—8].
По результатам биопсии сердца реципиента выделены следующие варианты патологии: ишемическая КМП — 13 пациентов, дилатационная КМП — 37, постмиокардитическая КМП — 10, хроническая ревматическая болезнь сердца — 7, другая патология — 5.
 В качестве средств, позволяющих продлить жизнь пациентов в ожидании донорского органа и улучшить их качество жизни, использованы так называемые мосты к ТС. Как фармакологический «мост» применены базисная фармакотерапия ХСН, а также инфузионные инотропные средства (милринон, добутамин, допамин, левосимендан) по показаниям [9, 10]. Хирургический «мост» включал манипуляции на клапанах сердца и коронарных сосудах в 7 комбинациях: 1) пластика митрального и трикуспидального клапанов (МК, ТК); 2) пластика МК и ТК, установка ПУЖС; 3) протезирование МК и аортального клапана (АК), пластика ТК; 4) протезирование МК и пластика ТК; 5) протезирование АК и протезирование аорты; 6) протезирование АК и аорты, пластика МК и ТК; 7) протезирование МК, пластика ТК, маммарокоронарное шунтирование. Пациентам с длительным легочным застоем или глобальной гипоперфузией тканей, несмотря на максимальную фармакологическую поддержку, имплантированы устройства механической поддержки кровообращения (МПК) — механический «мост» к ОТС: системы LVAD «Thoratec» (n=1), LVAD «Heart Mate» (n=2) и BiVAD «Thoratec» (n=2) [11].
В качестве средств, позволяющих продлить жизнь пациентов в ожидании донорского органа и улучшить их качество жизни, использованы так называемые мосты к ТС. Как фармакологический «мост» применены базисная фармакотерапия ХСН, а также инфузионные инотропные средства (милринон, добутамин, допамин, левосимендан) по показаниям [9, 10]. Хирургический «мост» включал манипуляции на клапанах сердца и коронарных сосудах в 7 комбинациях: 1) пластика митрального и трикуспидального клапанов (МК, ТК); 2) пластика МК и ТК, установка ПУЖС; 3) протезирование МК и аортального клапана (АК), пластика ТК; 4) протезирование МК и пластика ТК; 5) протезирование АК и протезирование аорты; 6) протезирование АК и аорты, пластика МК и ТК; 7) протезирование МК, пластика ТК, маммарокоронарное шунтирование. Пациентам с длительным легочным застоем или глобальной гипоперфузией тканей, несмотря на максимальную фармакологическую поддержку, имплантированы устройства механической поддержки кровообращения (МПК) — механический «мост» к ОТС: системы LVAD «Thoratec» (n=1), LVAD «Heart Mate» (n=2) и BiVAD «Thoratec» (n=2) [11].
Обследовано 135 донорских в реанимационных отделениях больниц Республики Беларусь. Средний возраст доноров и длительность ишемии донорского сердца представлены в табл. 1.
Все пациенты после ОТС на амбулаторном этапе получали трехкомпонентную иммуносупрессивную терапию — такролимус (програф или адваграф), микофенолата мофетил, преднизолон. Дозу иммуносупрессивных препаратов подбирали индивидуально на основании целевых уровней концентрации препарата в крови и подсчете количества лейкоцитов и тромбоцитов в общем анализе крови [12—16]. Микофенолата мофетил [17] назначали в дозе 1,5—2 г/сут, преднизолон — в дозе 1 мг/кг/сут с постепенным снижением дозы до полной отмены в срок от 3 до 6 мес индивидуально. Средняя доза такролимуса составила 4,3 мг/сут, микофенолата мофетила — 750 мг/сут. Средние дозы препаратов в нашем исследовании оказались меньше рекомендуемых протоколом ведения пациентов после трансплантации, что связано с более частыми побочными эффектами препаратов (тромбоцитопения, лейкопения, выраженный тремор рук).
Анализ полученных данных проводили с использованием пакетов программ Statistica 7.0 и SPSS. Данные представлены в виде медианы (Me) и квартильного размаха (LQ — нижний квартиль, UQ — верхний квартиль). Независимые выборки сравнивали с использованием критерия Манна—Уитни. Для исследования связи количественных признаков вычисляли парный коэффициент корреляции Спирмена (rs), количественных показателей с клиническим исходом заболевания — точечно-бисериальный коэффициент корреляции (rpb) (группы пациентов представлены как бинарный признак: 0 — благоприятный исход, 1 — неблагоприятный исход). Пороговые значения влияющих на клинический исход факторов рассчитывали с помощью ROC-анализа. Для анализа выживаемости использован метод Каплана—Мейера. Степень влияния факторов на выживаемость оценивали путем проверки гипотезы однородности выделенных по клиническим исходам групп с применением формулы накопленной вероятности выживания Каплана—Мейера. Для сравнения кривых дожития в двух группах использовали критерий Кокса—Мантеля. Вычисляли отношение шансов (ОШ) и 95% доверительный интервал (ДИ). Различия признавались статистически значимыми при p<0,05.
Результаты
Среди причин внепланового обращения после ОТС были нарушения проводимости, послужившие причиной установки электрокардиостимулятора, токсическая нефропатия с прогрессированием хронической почечной недостаточности как следствие воздействия иммуносупрессивных препаратов, реакция отторжения трансплантата — в 2 (28,57%). Лидирующие позиции занимали инфекционные осложнения (71,43% случаев) [18—21].

У большинства больных первичным очагом инфекции была респираторная система — 52,63%. Второе место по частоте развития заняли инфекции мочевыделительной системы — 34,21%. Фактором риска в данном случае являлось нахождение катетера в мочевом пузыре более 7 дней с развитием посткатетерных уретритов и распространением инфекции по восходящему пути. Раневая инфекция имелась у 3 пациентов, у которых на дотрансплантационном этапе были применены устройства МПК. Причем у пациентов, находившихся на «бивентрикулярных обходах», отмечены более тяжелые инфекционные раневые осложнения (1 пациент умер в период до 3 мес после ОТС от инвазивного аспергиллеза, у 1 пациентки длительный послеоперационный период характеризовался тяжелым медиастинитом и инфекцией мочевыделительной системы).
Случаи развития РООТ выявлены у 29 пациентов. При изучении связи между частотой развития и степенью РООТ с пред- и посттрансплантационными факторами [22] выявлено, что частота случаев РООТ коррелировала с возрастом реципиента (rpb=–0,48; р=0,031), степень РООТ — с показателем совпадения донора и реципиента по HLА-DR (rs= –0,42; р=0,048). РООТ чаще диагностировалась у пациентов моложе 30 лет — в 71,4% случаев (ОШ 3,25 при 95% ДИ от 2,05 до 10,8). В возрастной группе 30 лет и старше доля пациентов с ОРО составила 44,6%. Вследствие развившейся РООТ умерли 2 пациента.
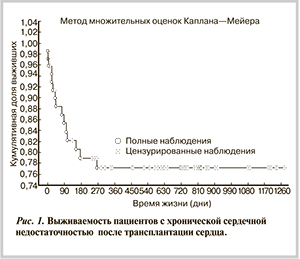
В целом по выборке годичная выживаемость после ТС составила 79,2%. На рис. 1 представлено графическое изображение выживаемости пациентов с ХСН после ОТС.
Из графика видно, что кривая выживаемости убывала в течение 270 дней после ОТС. Наиболее резкое снижение показателя отмечено в течение первых 45 дней после ОТС. На этот период приходится 53,3% от всего числа летальных исходов, на промежуток от 2 до 9 мес после ОТС — 46,7%.
Более частой причиной смерти были бактериальные инфекции (66,7% случаев всех летальных исходов).

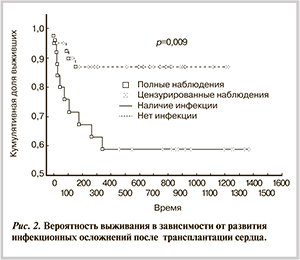
В течение первых 45 сут после ОТС смертность от инфекционных осложнений составила 71,4% от всего числа летальных исходов за этот период. На рис. 2 отражена зависимость вероятности выживания от наличия в ближайшем и отдаленном послеоперационных периодах инфекционных осложнений.
На этапе наблюдения от 150 до 270 сут выживаемость снижается исключительно из-за развития инфекционных осложнений. При оценке степени влияния инфекционных осложнений на выживаемость путем проверки гипотезы однородности выделенных по клиническим исходам групп ОШ для фактора «развитие инфекционных осложнений после ОТС» составило 4,80 (р=0,009).
Для сравнительного анализа клинико-функциональных и лабораторных показателей были сформированы группы по клиническим исходам в течение 12 мес после ОТС: 1-я группа — благоприятный исход; 2-я — летальный исход, где 2а — смерть от инфекционных осложнений, 2б — иная причина смерти. Выявлено, что в группе умерших от инфекционных осложнений в крови реципиентов сердца был значительно повышен уровень СРБ (табл. 2).
 Полученные результаты подтверждаются также достоверными коэффициентами корреляции показателя СРБ с частотой летальности от инфекционных осложнений (rpb=0,47; р=0,006) и с числом дней дожития (rs=–0,38; р<0,001).
Полученные результаты подтверждаются также достоверными коэффициентами корреляции показателя СРБ с частотой летальности от инфекционных осложнений (rpb=0,47; р=0,006) и с числом дней дожития (rs=–0,38; р<0,001).
Для расчета оптимального порогового значения (точка отсечения, cut-off) СРБ, позволяющего разделить группы пациентов по клиническим исходам после ОТС, применяли ROC-анализ. Критерием определения точки отсечения был принят оптимальный баланс между чувствительностью и специфичностью в данной точке разделения. Пороговым для СРБ явилось значение концентрации 11,5 мг/мл (чувствительность 81%, специфичность 77,2%, площадь под ROC-кривой 0,86). ОШ для бинарного показателя концентрации СРБ в сыворотке крови реципиента до пересадки донорского сердца (точка отсечения 11,5 мг/мл) составило 5,74 (р=0,011).
Уровень СРБ в сыворотке крови продемонстрировал связь средней силы с концентрацией тропонина I (rs=0,44; р=0,012) и конечной диастолической площадью правого желудочка — КДП ПЖ (rs=0,41; р=0,015) до операции. В группе реципиентов, умерших в течение 12 мес после ОТС, отмечено статистически значимое увеличение медианы КДП ПЖ (на 59,1% по сравнению с группой благоприятного исхода; р<0,05) (табл. 3). При этом не выявлено межгрупповых различий по уровню ДЛА и ФВ ЛЖ. Однако при обследовании после трансплантации донорского сердца в группе летальных исходов ДЛА были выше, а ФВ ЛЖ ниже, чем в группе сравнения — на 53,3% (р=0,002) и на 10,7% (р=0,01) соответственно. При неблагоприятном исходе после ОТС высокой оставалась и КДП ПЖ (на 40,4% больше, чем в группе сравнения; р=0,020). С ДЛА и ФВ ЛЖ трансплантированного сердца коррелировал уровень СРБ в крови реципиента до ОТС (rs=0,36 и rs= –0,45 соответственно; р<0,001).
В данном исследовании возраст донора и реципиента, предтрансплантационная патология, статус пациента по шкале UNOS, длительность ишемии трансплантата, наличие механической поддержки кровообращения и предшествующих хирургических вмешательств не являлись факторами, снижающими выживаемость в течение 12 мес после ОТС. Развитие в посттрансплантационном периоде СД, АГ и дисфункции синусного узла, требующей постоянной электрокардиостимуляции, также не идентифицированы как факторы риска снижения выживаемости в течение 1 года после пересадки сердца.
Заключение
По результатам проведенного исследования годичная выживаемость пациентов после ортотопической трансплантации сердца составила 79,2%. Наиболее низкая вероятность выживания была в течение первых 45 сут после пересадки сердца. Из проанализированных нами пред- и посттрансплантационных показателей значимое негативное влияние на годичную выживаемость после ортотопической трансплантации сердца оказывают концентрация С-реактивного белка в сыворотке крови реципиента ≥11,5 мг/мл до пересадки донорского сердца (отношение шансов 5,74; р=0,011) и развитие инфекционных осложнений после ортотопической трансплантации сердца (отношение шансов 4,80; р=0,009).
Выявлена взаимосвязь содержания С-реактивного белка в крови пациентов до операции и гемодинамических показателей сердца реципиента и трансплантированного сердца. Сердца реципиентов, умерших после ортотопической трансплантации сердца, характеризовались более выраженной дилатацией правых отделов. После трансплантации донорского сердца у умерших пациентов, независимо от причины смерти, наблюдалось увеличение значений давления в легочной артерии и снижение фракции выброса левого желудочка. Для подтверждения и уточнения роли показателей гемодинамики миокарда реципиента и пересаженного донорского сердца в прогнозе выживаемости после ортотопической трансплантации сердца требуется проведение дополнительных исследований в более отдаленные сроки после операции.
Эпизоды острого отторжения трансплантата, чаще диагностированные у пациентов моложе 30 лет, не ухудшали выживаемость в течение 12 мес после трансплантации сердца.



