В настоящей статье представлен случай артериита Такаясу (АТ) не только с типичным поражением подключичной и сонной артерий, но и со значимым вовлечением легочной артерии (ЛА), развитием легочной гипертензии (ЛГ).
Женщина, 38 лет, европеоид, была госпитализирована для уточнения генеза ЛГ и определения тактики лечения. При госпитализации пациентка предъявляла жалобы на одышку при физической нагрузке, боли ангинозного характера в грудной клетке и в левой руке, купирующиеся в покое. Пациентка принимала преднизолон 10 мг, гидроксихлорохин 200 мг, ивабрадин 5 мг, периндоприл 1,25 мг, варфарин 2,5 мг, спиронолактон 75 мг, силденафил 120 мг/сут. В течение 2 лет (2003—2005 гг.) больная получала преднизолон в сочетании с метотрексатом 5 мг в неделю, который был отменен в связи с развитием инфекционных осложнений. С 2006 г. к терапии глюкокортикостероидами был добавлен гидроксихлорохин 200 мг/сут.
Впервые одышка при интенсивной физической нагрузке появилась в возрасте 18 лет после правосторонней пневмонии с экссудативным плевритом. Несмотря на терапию антибактериальными препаратами и положительную рент-генологическую динамику, у пациентки сохранялась субфебрильная температура, появились нормохромная анемия, снижение массы тела на 7 кг за 2 мес, шумы в левой половине грудной клетки. В 1995 и 1998 гг. были рецидивы двусторонней полисегментарной пневмонии. В 1995 г. пациентка впервые отметила необычную слабость левой руки при физической нагрузке, а в 2000 г. появились боли и отсутствие пульса на левой руке, выраженные головные боли, головокружения. В анализах крови отмечался лейкоцитоз до 13×109/л, увеличение скорости оседания эритроцитов (СОЭ) до 31 мм/ч, нормохромная анемия. При ультразвуковом допплерографическом исследовании отмечались признаки стенозирующего поражения устьев сонных артерий слева, левой подключичной артерии слева. Был поставлен диагноз неспецифического аортоартериита, пациентке назначены преднизолон 40 мг/сут, ацетилсалициловая кислота 100 мг/сут и метотрексат (2003—2005 гг.). В дальнейшем в качестве дезагрегантной терапии был рекомендован пентоксифиллин. В этот период по данным эхокардиографии (ЭхоКГ) была выявлена умеренная ЛГ без указания давления в ЛА.
В апреле 2005 г. при ангиографическом исследовании была обнаружена окклюзия общей сонной, внутренней и наружной сонных артерий слева, подключичной артерии в 1-м сегменте слева, синдром подключично-позвоночного обкрадывания слева. На момент проведения хирургического вмешательства регистрировались лейкоцитоз 13,2×109/л, повышение уровня фибриногена до 4,4 г/л и нормальная СОЭ. Выполнена операция каротидно-подключичного протезирования слева с использованием дакронового сосудистого протеза, осложнившаяся на 3-и сутки тромбозом бранши протеза к наружной сонной артерии и внутренней сонной артерии слева без грубого неврологического дефицита (рис. 1, см. цв. вклейку). С этого момента пациентка получала ацетилсалициловую кислоту и пентоксифиллин, а в последующем варфарин. При гистологическом исследовании аорты подтвержден диагноз хронического неспецифического аортоартериита со склеротическим замещением мышечно-эластической пластинки. Пациентка отмечала положительную динамику после хирургического лечения в виде отсутствия головных болей, головокружений и болей в левой руке, получала поддерживающую терапию преднизолоном в дозе 10 мг/сут.
 С 2005 г. постепенно нарастала одышка, появились ангинозные боли в грудной клетке при физической нагрузке. По данным ЭхоКГ в 2011 г. было впервые зафиксировано расширение ствола ЛА (35 мм) и главных ветвей, расчетное систолическое давление в ЛА составляло 35 мм рт.ст. С августа 2012 г. у пациентки появились пароксизмы суправентрикулярной тахикардии, одышка стала беспокоить при небольшой физической нагрузке, появились головокружения, пресинкопальные состояния, отеки нижних конечностей и асцит, участились боли ангинозного характера. При мультиспиральной компьютерной томографии (МСКТ) легких отмечалась мозаичность легочного рисунка с участками гипо- и гиперперфузии.
С 2005 г. постепенно нарастала одышка, появились ангинозные боли в грудной клетке при физической нагрузке. По данным ЭхоКГ в 2011 г. было впервые зафиксировано расширение ствола ЛА (35 мм) и главных ветвей, расчетное систолическое давление в ЛА составляло 35 мм рт.ст. С августа 2012 г. у пациентки появились пароксизмы суправентрикулярной тахикардии, одышка стала беспокоить при небольшой физической нагрузке, появились головокружения, пресинкопальные состояния, отеки нижних конечностей и асцит, участились боли ангинозного характера. При мультиспиральной компьютерной томографии (МСКТ) легких отмечалась мозаичность легочного рисунка с участками гипо- и гиперперфузии.
По данным ЭхоКГ регистрировались высокие уровни давления в ЛА — 110 мм рт.ст. С декабря 2012 г. было начато лечение силденафилом в начальной дозе 25 мг 3 раза в день с последующим увеличением дозы до 150 мг/сут, терапия непрямыми пероральными антикоагулянтами (варфарин), петлевыми и калийсберегающими диуретиками. Пациентка отмечала значимое клиническое улучшение на фоне терапии силденафилом в виде уменьшения одышки при физической нагрузке и отеков. В феврале 2013 г. на фоне терапии расстояние, пройденное в тесте с 6-минутной ходьбой, составляло 402 м. На момент госпитализации в ФМИЦ им. В.А. Алмазова обращало внимание наличие легкого акроцианоза, снижение насыщения крови кислородом до 93%, отсутствие пульса на левой лучевой артерии, разность артериального давления на руках: 90/70 мм рт.ст. справа и 80/60 мм рт.ст. слева. При аускультации сердца выслушивались акцент и расщепление II тона над ЛА, III тон и систолический шум трикуспидальной регургитации.
Пациентка была обследована согласно международным рекомендациям по ведению пациентов с ЛГ от 2009 г. [1], которые включали ЭхоКГ, МСКТ легких с контрастированием ЛА, катетеризацию правых камер сердца с мано- и оксиметрией, магнитно-резонансную томографию (МРТ) сердца с контрастированием для оценки функции правого желудочка (ПЖ). В анализе крови было значительное повышение уровня натрийуретического мозгового пропептида (BNP) и его N-концевого предшественника (NT-proBNP) — 5121 пг/мл (норма 150—350 пг/мл).
По данным ЭхоКГ, расчетное систолическое давление в ЛА составляло 95 мм рт.ст., выявлены дилатация правых камер сердца, парадоксальное движение межжелудочковой перегородки как проявление перегрузки объемом ПЖ. Наличие высокой легочной артериальной гипертензии (ЛАГ) было подтверждено результатами манометрии правых камер сердца (см. таблицу).
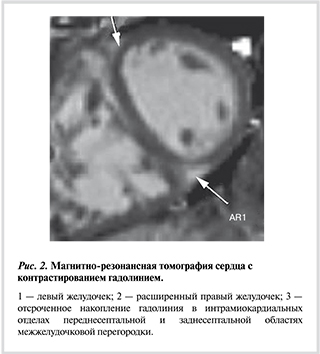
О нарушении систолической функции ПЖ свидетельствовало снижение его фракции выброса (16%) по данным МРТ и скорости движения кольца трикуспидального клапана (13 мм) по данным ЭхоКГ. Кроме того, было отмечено отсроченное накопление гадолиния в передне- и заднесептальных отделах межжелудочковой перегородки (рис. 2), что свидетельствует о развитии фиброза миокарда и является прогностически неблагоприятным фактором у пациентов с ЛАГ.
С помощью МСКТ-ангиографии ЛА были визуализированы полисегментарные стенозы ЛА, а также дилатация ствола и основных ветвей до уровня стенозов (рис. 3, см. цв. вклейку). При МСКТ-ангиографии аорты обнаружены расширенные бронхиальные артерии, которые, образуя коллатеральное кровообращение, кровоснабжали ишемизированные участки легких (см. рис. 3, а, см. на цв. вклейке).
Иммунологические показатели (ревматоидный фактор, антитела к кардиолипину, антиядерные антитела ANA detect, антитела к двуспиральной ДНК) были в пределах нормы, волчаночный антикоагулянт не обнаружен, данных, подтверждающих антифосфолипидный синдром, не получено.
Не выявлено лабораторных признаков активности АТ и симптомов системного воспаления. Однако, учитывая большую распространенность поражения, достоверно исключить активность АТ не представлялось возможным. Поэтому пациентке было рекомендовано проведение позитронно-эмиссионной томо-графии (ПЭТ-сканирование) ветвей аорты и ЛА для уточнения активности АТ, решения вопроса о комбинированной иммуносупрессивной терапии и последующей катетерной баллонной ангиопластики ЛА.
На основании результатов обследования был сформулирован диагноз: ЛАГ II функционального класса — ФК (ВОЗ), ассоциированная с хроническим неспецифическим аортоартериитом (болезнь Такаясу) с поражением сонных, подключичных артерий, ЛА. Каротидно-подключичное протезирование слева в 2005 г., тромбоз протеза левой сонной артерии, стеноз протеза левой подключичной артерии, ишемия левой руки. Симптоматическая стенокардия напряжения II ФК. Пароксизмальная суправентрикулярная тахикардия. Хроническая сердечная недостаточность 2а степени.
Пациентка в удовлетворительном состоянии выписана на амбулаторное наблюдение с рекомендациями приема преднизолона 10 мг/сут, ацетилсалициловой кислоты 100 мг/сут, аторвастатина 10 мг/сут, силденафила 120 мг 3 раза в день, варфарина с поддерживанием международного нормализованного отношения в пределах 2,0—3,0.
Ингибитор ангиотензинпревращающего фермента (АПФ) был отменен ввиду отсутствия артериальной гипертензии, а также тенденции к гипотонии у больной с высокой ЛГ. Более того, эффективность ингибиторов АПФ при ЛАГ в настоящее время не доказана. На фоне терапии клинических признаков правожелудочковой сердечной недостаточности не отмечалось. С учетом увеличения толерантности к физической нагрузке и уменьшения проявлений правожелудочковой недостаточности (отеки) пациентке была продолжена терапия силденафилом. Кроме того, была продолжена терапия варфарином, поскольку наличие стенозов ЛА, высокой ЛГ и дисфункции ПЖ, подтвержденной при МРТ сердца, может существенно увеличить риск тромбозов.

Стенозы и окклюзии ЛА являются типичным поражением при АТ [2—4]. Наиболее часто поражается правая верхнедолевая артерия на уровне сегментарного деления, артерии субсегментарного уровня вовлекаются в процесс реже. Изолированное поражение ЛА при АТ встречается редко и часто окончательный диагноз ставится при аутопсии или хирургическом вмешательстве [5, 6]. Прижизненно диагноз может трактоваться как тромбоэмболия ЛА (ТЭЛА) или идиопатическая ЛАГ, и даже саркоидоз легких [7—9]. В большинстве случаев вовлечение ЛА сочетается с АТ аорты и ее ветвей, что согласно ангиографической классификации относится к IV типу поражения при АТ. Так, по данным S. Sharma и соавт., среди 210 пациентов с АТ у 56,1% было также обнаружено поражение ЛА [10]. J.T. Lie (1996) полагал, что АТ ЛА имеет свои особые гистологические характеристики, отличающие его как от классического поражения аорты и ее ветвей при АТ, так и от изменений при идиопатической ЛГ. Автор описал результаты гистологического исследования ЛА у 5 пациентов с изолированным АТ ЛА, выделив 3 типа изменений: классический гранулематозный гигантоклеточный АТ, организованные тромбы с реканализацией и зонами неоангиогенеза, и плексогенную артериопатию [11]. У некоторых пациентов манифестация АТ с поражением ЛА протекает по типу инфаркта легкого и ТЭЛА [12, 13]. В подобных случаях своевременно поставить диагноз АТ особенно сложно, так как, с одной стороны, отсутствуют специфические лабораторные маркеры АТ, а с другой, АТ может сопровождаться тромбозом. Описан случай изолированного поражения ЛА при АТ с манифестацией в виде тромбоэмболии; диагноз АТ был поставлен только после лизиса тромба и выявления характерных стенотических изменений ЛА [6].
Израильские авторы представили 2 случая АТ ЛА и анализ публикаций за период с 1975 по 2009 г. [14]. Всего за этот период было описано 46 случаев АТ с поражением ЛА (89,1% женщины, средний возраст 34,6 года), из которых у 42,2% развилась ЛГ. Изолированное поражение ЛА наблюдалось только у 31,8% пациентов. Симптоматика поражения ЛА была представлена в 75,5% случаев одышкой, в 48,9% — болями в грудной клетке, в 42,2% — кровохарканьем и в 17,7% — кашлем. Поражение ЛА в большинстве случаев было первоначально документировано данными перфузионной сцинтиграфии легких, а в дальнейшем подтверждено данными МСКТ, МРТ или рентгеноконтрастной ангиографии. Следует отметить, что 20% пациентов был рекомендован прием варфарина. Хирургическая коррекция стенозов ЛА была выполнена в 52,5% случаев с хорошими результатами у 37,5% пациентов. Наиболее высокая летальность (33,3%) наблюдалась у пациентов с ЛГ [14]. По данным иранских авторов, при ангиографическом исследовании, выполненном у 15 пациентов, наряду с типичным поражением ветвей аорты в 20% случаев была документирована вовлеченность коронарных артерий и в 13,3% — ЛА [15]. Однако согласно более ранним публикациям вовлеченность ЛА при АТ может достигать 50% [16]. Описан случай окклюзии правой ЛА, который сопровождался гипоперфузией правого легкого, образованием полостей распада, инфицированных аспергиллезом, что потребовало удаления правого легкого [17].
Поражение ЛА при АТ зачастую может протекать бессимптомно. В исследовании A. Mekinian и соавт. у 12 (57%) пациентов из 21 были отмечены дефекты перфузии при нормальной вентиляции легких [18]. Причем только у 4 из 12 пациентов имелась легочная симптоматика, тогда как у 64% больных с дефектами перфузии легких клинические симптомы поражения ЛА отсутствовали. В данном исследовании чувствительность вентиляционно-перфузионной сцинтиграфии легких в диагностике поражения ЛА при АТ составила 100%, специфичность 53% [18]. Данное исследование, как и более ранние наблюдения, показывает, что не всегда документированное поражение ЛА сопровождается жалобами больного [16].
Наиболее информативными методами ранней диагностики АТ ЛА служат МСКТ- и МРТ-ангиопульмонография, способные визуализировать стенозы, дилатации, аневризмы и пристеночные тромбы. Метод МРТ позволяет с большей точностью оценить толщину стенки ЛА и наличие отека [19, 20], инфаркта легкого и геморрагий [19]. Информативность ПЭТ-КТ в оценке тяжести поражения сегментарных и субсегментарных ветвей ЛА более низкая из-за слабой разрешающей способности метода [21].
Поскольку стеноз ЛА развивается медленно, то у большинства пациентов регистрируется легкое или умеренное повышение давления в ЛА. Кроме того, достаточно часто у пациентов с АТ при медленном течении заболевания формируется системно-легочное коллатеральное кровообращение [3]. H.-M. Choi и соавт. описали случай полной окклюзии правой ЛА с ЛГ и кровоснабжением правого легкого из коллатералей, отходящих от огибающей коронарной артерии [8]. Описано несколько случаев геморрагических инфарктов легких вследствие разрыва коллатеральных сосудов между пульмональными и бронхиальными артериями [7].
Для восстановления кровотока в легких выполняются разнообразные операции, включая катетерную баллонную ангио-пластику (КБА) со стентированием, реконструкцию ЛА с использованием заплат и сосудистых протезов. Наибольшее число пациентов с изолированным стенозирующим поражением периферических ЛА, которым выполнялась КБА и которые длительно наблюдались после данного вмешательства, описано J. Kreutzer и соавт. [22]. Авторы провели анализ данных 12 пациентов, у 50% которых первоначально была диагностирована хроническая тромбоэмболическая ЛГ. В большинстве случаев основными жалобами были слабость и одышка при физических нагрузках. У 10 из 12 пациентов с множественными стенозами сегментарных и субсегментарных ЛА заболевание осложнилось развитием ЛГ. Авторы использовали следующие критерии для отбора на КБА ЛА: 1) систолическое давление в ПЖ >50% от системного или <50%, но с признаками дисфункции ПЖ или значительной гипоперфузией легких; 2) низкое давление в ЛА дистальнее зоны поражения; 3) значительно измененная картина по данным перфузионной сцинтиграфии в пораженных зонах. КБА была выполнена у 11 пациентов. У одного пациента с системным уровнем систолического давления в ПЖ после КБА нескольких артерий развился отек легких, легочное кровотечение из дистального отдела ЛА, в результате чего пациент умер. У 6 пациентов после КБА развился отек легких в зонах дилатации артерий, который был купирован. У 7 пациентов через 52 мес наблюдения после КБА состояние оставалось стабильным (I—II ФК сердечной недостаточности по классификации NYHA). У 2 пациентов, несмотря на КБА, сохранялся высокий ФК хронической сердечной недостаточности и ЛГ, один из пациентов умер внезапно через 18 мес после КБА. Одна пациентка была отобрана для трансплантации легких, так как давление в ЛА значительно превышало системное, имелись множественные сегментарные стенозы, субсегментарные окклюзии, и давление в сосудах легких дистальнее стенозов было значительно повышено [22].
L. Qin и соавт. выполнили КБА ЛА у 4 пациентов с изолированным поражением ЛА вследствие АТ [23]. Показанием к интервенционному лечению явилась хроническая сердечная недостаточность IΙΙ—ΙV ФК на фоне ЛГ, значимая гипоперфузия в зонах множественных билатеральных стенозов ветвей ЛА. У 3 пациентов в дополнение к КБА были установлены стенты. После вмешательства пациенты наблюдались в течение 4 лет, и только у пациента с изолированной КБА через 18 мес развился рестеноз; у остальных состояние оставалось клинически стабильным, без признаков рестеноза и прогрессирования поражения ЛА [23]. В одном исследовании упоминалось об угрожающем жизни отеке легких, развившемся после выполнения КБА со стентированием ЛА [8].
Опыт хирургического лечения стенозов ЛА при АТ невелик и не превышает 10 случаев, описанных в англоязычной литературе. Это связано с окклюзией сосудистых протезов, развитием аневризмы в месте анастомоза и высокой периоперационной летальностью, что препятствует широкому распространению реконструктивных операций на ЛА [24, 25]. Тем не менее описаны случаи успешного выполнения сложных реконструктивных операций на ЛА у пациентов с АТ [5]. В качестве сосудистых протезов при реконструктивных операциях на ЛА преимущественно использовали аутоперикард из-за его низкой тромбогенности, в 2 случаях – сосудистый протез из дакрона и в одном — бычий перикард [9, 24, 25].
Известно, что дисфункция ПЖ на фоне высокой ЛАГ может быть значимым фактором неблагоприятного прогноза. Силденафил способен не только снижать легочное сосудистое сопротивление, но и улучшать функцию ПЖ, непосредственно влияя на кардиомиоциты [26, 27]. Однако назначение специфических препаратов для лечения ЛАГ на фоне стенотического поражения ЛА не изучено и не может рассматриваться в качестве первоочередного метода лечения.



