Интерес к количественной оценке функции правого желудочка (ПЖ), особенно у пациентов с кардиальной патологией, при которой в патологический процесс вовлекаются правые камеры сердца, неуклонно растет. Особое место среди заболеваний, при которых детерминантой прогноза служит функция ПЖ, занимает легочная гипертензия (ЛГ) [1].
 Эхокардиография (ЭхоКГ) — наиболее доступный и безопасный метод визуализации, который получил широкое распространение в клинической практике. Помимо расчета давления в легочной артерии (ДЛА) ЭхоКГ позволяет выявить увеличение размеров правых камер сердца, нарушение формы и функции межжелудочковой перегородки, оценить толщину стенки ПЖ и расширение ствола легочной артерии (ЛА). В отличие от симметричного по форме левого желудочка (ЛЖ) ПЖ характеризуется сложной геометрической формой, загрудинным расположением, что создает ограничения для оценки его с помощью двухмерной ЭхоКГ (2D-ЭхоКГ) [2]. Поэтому в качестве основного метода, позволяющего точно оценить размер, морфологию и функцию ПЖ, в последние годы активно применяется магнитно-резонансная томография (МРТ) сердца, для которой характерна высокая степень воспроизводимости [3]. Главными преимуществами МРТ являются трехмерный (объемный) способ получения изображений без артефактов от костей и легочных полей, высокое пространственное разрешение, а также отсутствие лучевой нагрузки, неинвазивность метода и естественное контрастирование за счет движущейся крови. Наиболее точное измерение конечного диастолического и конечного систолического объемов ПЖ при выполнении МРТ позволяет рассчитать фракцию выброса (ФВ) ПЖ, которая имеет прогностическое значение для больных ЛГ [3—6]. Поэтому МРТ сердца признана «золотым стандартом» в диагностике и оценке степени тяжести дисфункции ПЖ у больных ЛГ. Вместе с тем метод имеет высокую стоимость, требует задержки дыхания, занимает большой временной интервал и невозможен у пациентов, страдающих клаустрофобией. В качестве альтернативы в последние годы предлагают использовать трехмерную ЭхоКГ (3D-ЭхоКГ) ПЖ, данные которой сопоставимы с результатами МРТ [7]. Однако использование этого метода в достаточной степени не распространено, так как также сопряжено с определенными трудностями. Поэтому в качестве альтернативы МРТ сердца и 3D-ЭхоКГ для оценки систолической функции ПЖ в настоящее время рекомендовано измерение таких показателей, как фракционное изменение его площади (ФИП), систолическая экскурсия плоскости трикуспидального кольца (TAPSE), систолическая скорость кольца трикуспидального клапана (TASV), продольная деформация (strain), скорость деформации (strain rate) и индекс производительности ПЖ (MPI, или Tei index) [8]. Результаты ранее проведенных исследований показали, что ФИП ПЖ хорошо коррелирует с показателями функции ПЖ, определяемыми с помощью радионуклидной вентрикулографии и МРТ [9, 10]. Кроме того, оценивают прогностическое значение TAPSE в отношении индекса ударного объема ПЖ и смертности больных ЛГ. Наряду с перечисленными показателями в последнее время растет интерес к оценке соотношения конечных диастолических размеров ПЖ и ЛЖ (ПЖ:ЛЖ) у больных ЛГ как легко воспроизводимого и простого параметра, имеющего прогностическую ценность [11].
Эхокардиография (ЭхоКГ) — наиболее доступный и безопасный метод визуализации, который получил широкое распространение в клинической практике. Помимо расчета давления в легочной артерии (ДЛА) ЭхоКГ позволяет выявить увеличение размеров правых камер сердца, нарушение формы и функции межжелудочковой перегородки, оценить толщину стенки ПЖ и расширение ствола легочной артерии (ЛА). В отличие от симметричного по форме левого желудочка (ЛЖ) ПЖ характеризуется сложной геометрической формой, загрудинным расположением, что создает ограничения для оценки его с помощью двухмерной ЭхоКГ (2D-ЭхоКГ) [2]. Поэтому в качестве основного метода, позволяющего точно оценить размер, морфологию и функцию ПЖ, в последние годы активно применяется магнитно-резонансная томография (МРТ) сердца, для которой характерна высокая степень воспроизводимости [3]. Главными преимуществами МРТ являются трехмерный (объемный) способ получения изображений без артефактов от костей и легочных полей, высокое пространственное разрешение, а также отсутствие лучевой нагрузки, неинвазивность метода и естественное контрастирование за счет движущейся крови. Наиболее точное измерение конечного диастолического и конечного систолического объемов ПЖ при выполнении МРТ позволяет рассчитать фракцию выброса (ФВ) ПЖ, которая имеет прогностическое значение для больных ЛГ [3—6]. Поэтому МРТ сердца признана «золотым стандартом» в диагностике и оценке степени тяжести дисфункции ПЖ у больных ЛГ. Вместе с тем метод имеет высокую стоимость, требует задержки дыхания, занимает большой временной интервал и невозможен у пациентов, страдающих клаустрофобией. В качестве альтернативы в последние годы предлагают использовать трехмерную ЭхоКГ (3D-ЭхоКГ) ПЖ, данные которой сопоставимы с результатами МРТ [7]. Однако использование этого метода в достаточной степени не распространено, так как также сопряжено с определенными трудностями. Поэтому в качестве альтернативы МРТ сердца и 3D-ЭхоКГ для оценки систолической функции ПЖ в настоящее время рекомендовано измерение таких показателей, как фракционное изменение его площади (ФИП), систолическая экскурсия плоскости трикуспидального кольца (TAPSE), систолическая скорость кольца трикуспидального клапана (TASV), продольная деформация (strain), скорость деформации (strain rate) и индекс производительности ПЖ (MPI, или Tei index) [8]. Результаты ранее проведенных исследований показали, что ФИП ПЖ хорошо коррелирует с показателями функции ПЖ, определяемыми с помощью радионуклидной вентрикулографии и МРТ [9, 10]. Кроме того, оценивают прогностическое значение TAPSE в отношении индекса ударного объема ПЖ и смертности больных ЛГ. Наряду с перечисленными показателями в последнее время растет интерес к оценке соотношения конечных диастолических размеров ПЖ и ЛЖ (ПЖ:ЛЖ) у больных ЛГ как легко воспроизводимого и простого параметра, имеющего прогностическую ценность [11].
Провести комплексную оценку функции ПЖ с помощью 2D-ЭхоКГ для выявления наиболее информативных показателей, отражающих как структурно-функциональные изменения ПЖ, так и гемодинамику малого круга кровообращения для характеристики степени тяжести и мониторинга больных ЛГ и послужило целью настоящего исследования.
Материал и методы
За период наблюдения с сентября 2010 по июль 2014 г. на базе ФГБУ «Северо-западный федеральный медицинский исследовательский центр» были обследованы 63 пациента с ЛГ. Перед включением в исследование все пациенты подписывали информированное согласие, одобренное локальным этическим комитетом. В проспективное исследование включали пациентов с прекапиллярной ЛГ без клинически значимой сопутствующей патологии со средним ДЛА>25 мм рт.ст., давлением заклинивания легочных капилляров (ДЗЛК)<15 мм рт.ст. и легочно-сосудистым сопротивлением (ЛСС)>240 дин×с×см-5, имеющих I—IV функциональный класс (ФК) ЛГ (ВОЗ). Установлены следующие критерии исключения: наличие ЛГ на фоне патологии левых камер сердца и патологии легких, операбельной хронической тромбоэмболической легочной гипертензии (ХТЭЛГ), а также ЛГ с многофакторной природой развития. В исследуемую группу вошли 38 больных идиопатической легочной артериальной гипертензией (ЛАГ), 7 больных ЛАГ на фоне корригированных врожденных пороков сердца, 6 больных ЛАГ на фоне системной склеродермии и 12 пациентов неоперабельной ХТЭЛГ. Пациенты были обследованы согласно рекомендациям Европейского общества кардиологов по диагностике и лечению ЛГ [12].

Для верификации диагноза всем пациентам выполняли катетеризацию правых камер сердца термодилюционным баллонным катетером. Исследование проводили в положении больного лежа на спине, без поддержки кислородом. Сердечный выброс определяли методом термодилюции. Расчет ЛСС выполняли по формуле:
ЛСС=[80×(среднее ДЛА-ДЗЛК)/СВ],
где ДЗЛК — давление заклинивания легочных капилляров, СВ — сердечный выброс.
 Физическую работоспособность оценивали с помощью теста с 6-минутной ходьбой (ТШХ), который выполнялся согласно рекомендациям Американского торакального общества [13].
Физическую работоспособность оценивали с помощью теста с 6-минутной ходьбой (ТШХ), который выполнялся согласно рекомендациям Американского торакального общества [13].
ЭхоКГ выполняли на аппарате Vivid 7D по стандартному протоколу. Правые камеры сердца оценивали согласно рекомендациям Американского общества по ЭхоКГ [8].
Для оценки систолической функции ПЖ проводили измерение TAPSE в М-режиме из апикальной четырехкамерной позиции, TASV c использованием тканевой импульсной допплерографии из апикальной четырехкамерной позиции, ФИП ПЖ в четырехкамерной апикальной позиции, которое рассчитывали по формуле:
(КДП ПЖ-КСП ПЖ)/КДП×100%,
где КДП — конечная диастолическая площадь ПЖ и КСП — конечная систолическая площадь ПЖ. Продольную деформацию свободной стенки миокарда ПЖ оценивали с помощью анализа двухмерного серошкального изображения. Помимо этого дополнительно производили измерение соотношения ПЖ:ЛЖ на уровне базальных отделов из апикальной четырехкамерной позиции.
MPI оценивали с помощью тканевой импульсной допплерографии как частного от деления суммы времени изоволюметрического сокращения (IVCT) и времени изоволюметрического расслабления ПЖ (IVRT) на время выброса (ET):MPI=(IVCT+IVRT)/ET.
Статистический анализ данных, полученных в ходе исследования, проведен с использованием прикладных статистических программ Statistica for Windows v. 10.0. Показатели, имеющие нормальное или близкое к нормальному распределение, представлены в виде среднего арифметического значения (М), среднеквадратичного отклонения (σ) и числа признаков в группе (n) при отличии выборочного распределения от нормального в виде медианы и интерквартильного (процентильного) интервала (Ме [25;75]). Критерий значимости устанавливали на уровне р<0,05. Корреляции между парами количественных переменных оценивали, используя непараметрический критерий Спирмена. Для выявления независимого влияния на количественные показатели качественных факторов была использована процедура однофакторного дисперсионного анализа (ANOVA), для показателей с распределением, отличным от нормального — непараметрические критерии: медианный и Крускала—Уоллиса. Канонический анализ использовали для выявления значимых корреляций между двумя наборами признаков.
Результаты
В настоящей работе обследован 51 пациент с ЛАГ и 12 пациентов с ХТЭЛГ в возрасте от 18 до 73 лет. За время наблюдения умерли 12 (16%) пациентов. Среди обследованных пациентов 68% составили женщины. У 71% больных был III и IV ФК. Клинико-демографическая и гемодинамическая характеристики пациентов представлена в табл. 1.
По данным ТШХ было выявлено снижение физической работоспособности у больных ЛГ (362±97 м). Все пациенты соответствовали критериям включения в исследование по данным катетеризации правых камер сердца и характеризовались высоким ЛСС, повышенным давлением в правом предсердии (ДПП), сниженным сердечным индексом (СИ).
При ЭхоКГ выявлены следующие структурно-функциональные изменения сердца: дилатация правых камер сердца, гипертрофия передней стенки ПЖ, увеличение соотношения ПЖ:ЛЖ, снижение ударного объема ЛЖ, уменьшение амплитуды и скорости экскурсии плоскости кольца трикуспидального клапана, а также значительное увеличение MPI (табл. 2).
По данным МРТ сердца отмечено снижение ФВ ПЖ.
По мере нарастания ФК ЛГ наблюдалось увеличение соотношения ПЖ:ЛЖ и TASV (рис. 1). Достоверные отличия по соотношению ПЖ:ЛЖ получены между пациентами с ЛГ I и IV ФК (p=0,05), II ФК и III ФК (р=0,01), II ФК и IV ФК (р=0,03). Аналогичная динамика прослежена и для такого показателя ЭхоКГ, как скорость пика S’ кольца трикуспидального клапана, измеренной при тканевой допплерографии (TASV): между пациентами с ЛГ I и IV ФК (p=0,04), II ФК и III ФК (р=0,01), II ФК и IV ФК (р=0,02).

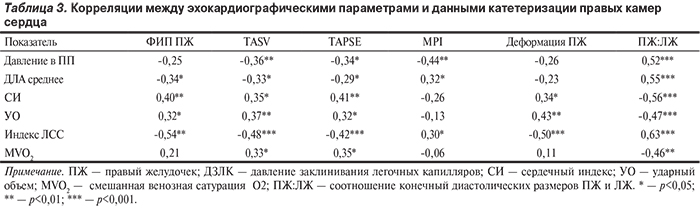
Выявлена отрицательная корреляция между основными гемодинамическими параметрами: ЛСС, СИ, средним ДЛА, ДПП, а также между эхокардиографическими параметрами, отражающими структурно-функциональные изменения ПЖ: TAPSE, TASV, глобальной деформацией ПЖ, ФИП, MPI, соотношением ПЖ:ЛЖ (табл. 3).
Для определения комбинации эхокардиографических параметров, которые наилучшим образом могли бы характеризовать гемодинамику малого круга кровообращения, был проведен канонический анализ. Была получена статистически значимая каноническая корреляция (r=0,77; p=0,007) между интегральной эхокардиографической характеристикой, с одной стороны, и интегральной гемодинамической характеристикой, с другой. Вклад соотношения ПЖ:ЛЖ в эхокардиографическую характеристику составил r=0,97, а TASV — r=-0,71. Наибольший вклад в каноническую величину, определяющую гемодинамику малого круга, внесли такие показатели, как среднее ДЛА (r=0,87), ДПП (r=0,76), индекс ЛСС (r=0,86) и СИ (r=-0,64).
При помощи ROC-анализа выявлено пороговое значение соотношения конечных диастолических размеров ПЖ:ЛЖ, разделяющее пациентов с СИ больше и меньше 2,0 л/мин/м2.
Таким значением оказалась величина 1,21 с чувствительностью 95% и специфичностью 43% (рис. 2, а). Площадь под кривой составила 0,802. ROC-анализ позволил также выявить пороговое значение соотношения конечных диастолических размеров ПЖ:ЛЖ (1,24), разделяющее пациентов с ДПП больше и меньше 10 мм рт.ст., с чувствительностью 84% и специфичностью 56% (рис. 2, б). Площадь под кривой составила 0,764.
Выявлены статистически значимые корреляции между ФВ ПЖ и ФИП ПЖ (r=0,66; p<0,0001), наличие которых отражает формула пересчета фракционного изменения площади ПЖ, измеренного с помощью ЭхоКГ, в величину фракции выброса ПЖ, оцененную с помощью МРТ сердца: ФВ ПЖ=2,68±0,99·ФИП ПЖ. Помимо этого выявлены корреляции между ФВ и другими параметрами, отражающими структурно-функциональное состояние ПЖ: TAPSE (r=0,44; p=0,003), TASV (r=0,32; p=0,04), глобальной продольной деформацией (r=0,38; p=0,02) и соотношением ПЖ:ЛЖ (r=-0,47; p=0,003), что подчеркивает перспективы использования 2D-ЭхоКГ в качестве более доступного и экономичного метода для оценки сократительной способности ПЖ.
Обсуждение
В настоящее время ЭхоКГ признана основным скрининговым методом диагностики ЛГ, так как помимо расчета ДЛА позволяет оценить структурно-функциональные изменения ПЖ и ЛЖ. В норме ПЖ имеет тонкие стенки и форму полумесяца, что обеспечивает его бóльшую податливость по сравнению с ЛЖ и лучшую адаптацию при увеличении венозного возврата за счет увеличения сократимости [14]. Концентрическое ремоделирование и увеличение сократительной способности с уменьшением его податливости на начальных этапах позволяет справиться ПЖ с повышением ЛСС у пациентов с ЛГ [15]. Дальнейшее повышение ДЛА приводит к гипертрофии ПЖ с последующей его дилатацией [16, 17]. Адаптация и ремоделирование ПЖ зависят не только от тяжести изменений в сосудах малого круга кровообращения, но и от целого ряда факторов: нейрогормональной активности, перфузии и метаболизма миокарда [18]. В настоящем исследовании с помощью ЭхоКГ и МРТ сердца было подтверждено наличие закономерных изменений структуры и функции ПЖ у больных ЛГ. Особенно наглядно была продемонстрирована связь между ФК ЛГ и изменением соотношения ПЖ:ЛЖ. Значение определения соотношения ПЖ:ЛЖ как показателя ремоделирования желудочков для оценки прогноза больных ЛГ ранее было изучено на примере больных идиопатической ЛАГ, острой тромбоэмболией ЛА и легочной гипертензией у детей, а также показана связь данного показателя с основными гемодинамическими параметрами малого круга кровообращения [11, 19, 20].
Позднее с использованием метода МРТ подтверждено значение данного показателя как независимого предиктора снижения ФВ ПЖ и увеличения ЛСС у пациентов с ЛГ [21]. В настоящем исследовании соотношение диаметров ПЖ и ЛЖ оказалось наиболее значимым показателем для характеристики таких факторов неблагоприятного прогноза, как СИ<2 мл/мин/м2 и ДПП>10 мм рт.ст. Связь данного показателя с основными гемодинамическими параметрами и фракцией ПЖ, по данным МРТ сердца, свидетельствует о его информативности в качестве потенциального маркера тяжести состояния больных ЛГ.
Считается, что TAPSE, TASV и глобальная продольная деформация ПЖ, характеризующие продольное сокращение ПЖ, а также ФИП ПЖ, измеренная с помощью 2D-ЭхоКГ, не могут в достаточной степени отражать глобальную сократительную способность ПЖ. Несмотря на это мы получили тесные корреляции между показателями 2D-ЭхоКГ и ФВ ПЖ, измеренной с помощью МРТ сердца, а также гемодинамическими параметрами.
По данным канонического анализа, наиболее информативными параметрами в интегральной эхокардиографической характеристике оказались соотношение ПЖ: ЛЖ и TASV. Наибольший вклад в каноническую величину, определяющую гемодинамику малого круга, вносили такие показатели, как среднее ДЛА, ДПП, индекс ЛСС и СИ.
В отличие от ранее опубликованных исследований в нашей работе ФВ ПЖ была наиболее тесно связана с ФИП ПЖ. Кроме того, мы не выявили связи между ФВ ПЖ и MPI. Аналогичный результат получен и в исследовании T. Yang, который подтверждает представление о том, что параметры 2D-ЭхоКГ не могут в полной мере отражать сократимость ПЖ [21].
Заключение
Несмотря на то что двухмерная эхокардиография не полностью соответствует критериям идеального исследования для оценки структуры и функции правого желудочка, требующей мультимодального подхода и глубокого понимания патофизиологических механизмов легочной гипертензии, проведенная работа доказала, что расчет простых параметров при двухмерном исследовании позволяет получить клиническую и прогностическую информацию, имеющую большое значение для определения степени тяжести больных легочной гипертензией.



