ВВЕДЕНИЕ
Нарастание уровня мочевой кислоты (МК) в сыворотке крови выше 6 мг/дл (360 мкмоль/л) в большинстве регионов мира определяется как гиперурикемия (ГУ) [1, 2]. В отсутствие у пациента с ГУ клинических признаков подагры она считается бессимптомной (БГУ) [3]. Известно, что стойкое повышение уровня МК в сыворотке крови выступает основным этиологическим фактором развития подагры [4]. В последние десятилетия регистрируется тенденция к увеличению распространенности ГУ [5, 6]. Так, в России она составляет 16,8% среди взрослого населения [6].
Основной локализацией экскреции и реабсорбции МК в организме человека является нефрон, при этом в физиологических условиях ее производство и выведение находятся в состоянии баланса [4, 7, 8]. Гипоэкскреторный механизм вследствие снижения фильтрационной функции почек и/или нарушения функциональной активности анионных транспортных систем (SLC22A12/URAT1, SLC2A9/GLUT9, BCRP/AВСG2 и др.) служит наиболее значимой причиной ГУ [8, 9]. С другой стороны, согласно опубликованным результатам экспериментальных и крупных клинических исследований (КИ), неконтролируемое повышение концентрации МК в сыворотке крови представляет из себя независимый фактор риска формирования и прогрессирования целого ряда заболеваний внутренних органов [10–24], в том числе хронической болезни почек (ХБП) [18–24]. Вместе с тем, несмотря на достаточно обширную доказательную базу, представленную в литературе, продолжалась дискуссия о целесообразности проведения медикаментозной уратснижающей терапии (УСТ) у пациентов, имеющих стойкую БГУ, для профилактики развития и прогрессирования заболеваний сердечно-сосудистой системы, почек, а также нарушений углеводного и липидного обменов [25, 26].
Таким образом, изучение влияния уровня МК в сыворотке крови на скорость клубочковой фильтрации (СКФ) – актуальная междисциплинарная проблема в клинике внутренних болезней, решение которой способно предоставить дополнительные возможности для нефропротекции у пациентов у пациентов, имеющих высокие риски формирования и прогрессирования ХБП.
Цель исследования – оценить влияние уровня МК в сыворотке крови на СКФ у пациентов с исходно нормальной и сниженной функцией почек при помощи выполнения систематического обзора когортных наблюдательных (обсервационных) исследований и оценки его результатов на основе метаанализа.
МАТЕРИАЛ И МЕТОДЫ
Источники данных и стратегия поиска
Работа над настоящим метаанализом проводилась в 2022–2023 гг. Систематический поиск выполнялся 14.10.2022 г. на основе стратегии поиска (приложение 1) в следующих базах данных: Embase, PubMed, Cochrane Library, E-library. Дополнительные материалы отбирались из источников в исследованиях, прошедших первичный отбор, а также в списках литературы оригинальных обзоров и статей. Наряду с этим анализировались реферативные данные. Исследования отбирали два независимых эксперта.
Результаты поиска обрабатывались в программе EndNote X9.2. В дальнейшем два эксперта осуществляли оцифровку данных о характеристиках популяции, результатах КИ и методологической гетерогенности в специально разработанные формы. Третий независимый исследователь валидировал заполненные данные.
В метаанализ включались проспективные и ретроспективные когортные наблюдательные (обсервационные) исследования, субъектами изучения которых были пациенты, страдающие БГУ. Фармакоэкономические и рандомизированные клинические исследования для итогового анализа не отбирались.
Критерии включения публикаций в обзор:
- изучаемая популяция – взрослые пациенты в возрасте старше 18 лет вне зависимости от распределения по полу;
- у пациентов, включенных в исследование, была верифицирована ГУ – уровень МК в сыворотке крови выше 6 мг/дл (360 мкмоль/л);
- ГУ у наблюдаемых лиц носила бессимптомный характер, т.е. отсутствовали признаки подагры в соответствии с диагностическими критериями Американской коллегии ревматологов/ Европейской противоревматической лиги (ACR/EULAR) 2015 г. и/или S. Wallace 1977 г.).
Критерии невключения исследований в обзор:
- наличие пациентов с подагрой, диагностированной согласно критериям ACR/EULAR 2015 г. и/или S. Wallace 1977 г.;
- наличие пациентов с острым повреждением почек или в терминальной стадии хронической почечной недостаточности с проведением заместительной почечной терапии;
- лечение пациентов препаратами с цитостатическим эффектом, противотуберкулезными средствами, а также подозрение или наличие лекарственно-индуцированной ГУ (длительный бесконтрольный прием диуретиков и т.п.);
- наличие пациентов с активным туберкулезом любой локализации, саркоидозом, кожным псориазом, псориатическим артритом/спондилитом, активными лимфо-/миелопролиферативными заболеваниями, солидными опухолями или врожденными ферментопатиями (дефект активности фосфорибозилпирофосфат синтетазы, дефицит гипоксантин-гуанинфосфорибозилтрансферазы);
- исследования, связанные с трансплантаций органов или тканей;
- наличие сведений об отравлении тяжелыми металлами среди участников исследования;
- наличие у пациентов хронического гемолиза, гемоглобинопатий, истинной полицитемии, болезней накопления, лучевой болезни, цирроза печени, а также хронических вирусных инфекций в фазе репликации (гепатитов, ВИЧ).
В ходе первого этапа исследования определялись взаимосвязи между уровнем МК в сыворотке крови и СКФ на основании исходных данных пациентов при включении в наблюдение. На втором этапе анализировалась средняя дельта СКФ в смешанной по наличию ХБП популяции больных, страдающих БГУ, за периоды наблюдения до 6 лет (72 мес) и от 6 до 10 лет (72–120 мес). При оценке СКФ учитывались расчетные показатели (рСКФ) по формулам CKD-EPI, MDRD, Кокрофта-Голта и др. Поскольку в отобранных КИ применялись различные методы расчета СКФ, в ходе сопоставления их результатов проводился дополнительный анализ полученных данных.
Конфаундеры
К таковым относились формула расчета СКФ и факт наличия в популяции пациентов с ХБП. Наряду с этим оценивалось влияние наличия трансформации данных (получение средних и стандартного квадратического отклонения (СКО) из других статистик, моделирование и т.д.) на результаты синтеза.
Оценка риска систематической ошибки КИ выполнялась двумя независимыми исследователями при помощи специализированного инструмента, разработанного Кокрейновским сообществом (risk of bias, RoB2 v.9, risk of bias in non-randomized studies of interventions, ROBINS-I excel tool). Третий независимый эксперт привлекался для разрешения возникающих разногласий.
Методологическая и клиническая гетерогенность оценивалась совместно с профильными специалистами путем сопоставления дизайна, организации КИ, а также характеристик включенных пациентов. В дальнейшем делался вывод либо об отсутствии значимых различий, либо о степени их влияния на распределение обобщаемых исследований [27]. После включения в модель синтеза доступных ковариат оценивалась остаточная статистическая гетерогенность (Q-статистика).
Для оценки систематической ошибки сообщения информации использовался воронкообразный график (funnel plot). Для всех пар компараторов из каждого включенного исследования рассчитывались разность эффектов и ее стандартная ошибка, которые отображались по осям абсцисс и ординат соответственно. При помощи данного способа представления результатов оценивалась сбалансированность величины эффекта и его стандартной ошибки по всем включенным КИ, как визуально, так и статистически, с применением теста Эггера.
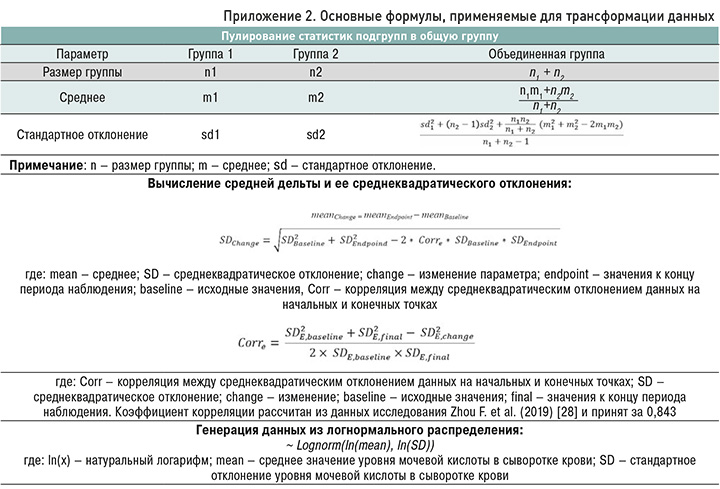
С целью статистической оценки эффекта для всех исследуемых точек применялись такие показатели, как разность средних (mean difference), средняя дельта (mean delta), средние в группах (mean), 95% доверительный интервал (ДИ). При представлении в публикации медианы и квартилей проводилась аппроксимация среднего значения и СКО, исходя из предположения о нормальном распределении: Mean ≈ Median; SD ≈ IQR/1,35, где Mean – среднее, Median – медиана, SD – стандартное отклонение; IQR – межквартильный размах (разница между 75% и 25% квартилями).
С учетом различного числа и неоднородности границ квартилей МК в отобранных исследованиях было принято решение синтезировать доказательства методом трехуровневого метаанализа. В качестве фиксированных эффектов рассматривались средний уровень МК в сыворотке крови в каждом квартиле, формула для расчета СКФ, факт трансформации данных. После разработки модели проводилась аппроксимация СКФ по квартилям МК, представленным в таблице 1.

С учетом высокой статистической гетерогенности и использования данных менее 10 исследований для проведения метаанализа применялась модель случайных эффектов «эстиматор Хантер–Шмидта с коррекцией на малый размер выборок».
В ходе подготовки данных к синтезу выполнялась их трансформация. Для аппроксимации центральной тенденции, средней дельты и пулирования статистик из подгрупп применялись подходы, представленные в методическом руководстве Кокрейновского сообщества [27], при необходимости использовались опубликованные данные других исследований [28]. Для суммирования статистик подгрупп в общую когорту применялся последовательный подход, в рамках которого к первой подгруппе пулировали вторую, к полученному результату – третью и т.д. В тех случаях, когда в исследование были включены среднее и СКО по всей выборке, но отсутствовали данные по квартилям МК, по выборочным данным моделировалось логнормальное распределение. Размер генерации равнялся общему размеру группы. В дальнейшем выборка делилась на квартили согласно границам, указанным в публикации, в каждом из которых рассчитывалось среднее. После 1000 повторений фиксировались усредненные результаты по каждому квартилю. Если уровень МК в общей группе был представлен в виде медианы и квартилей, из них аппроксимировались среднее арифметическое и СКО, а затем проводилось моделирование. Основные формулы, используемые для трансформации данных, представлены в приложении 2.
РЕЗУЛЬТАТЫ
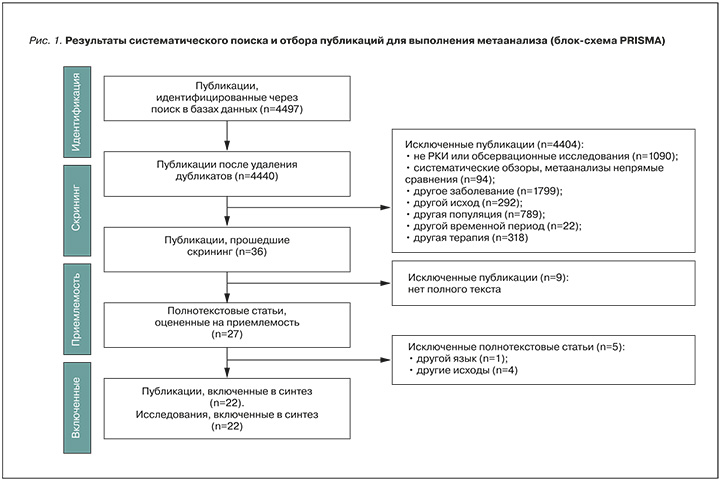
Результаты систематического поиска и отбора публикаций представлены на рисунке 1. Изначально были идентифицированы 4497 исследований, соответствующих требованиям, заданным для настоящего метаанализа. После процедуры отбора в анализ были включены 22 публикации, описывающие результаты наблюдательных (обсервационных) когортных исследований [28–49] на английском языке. В дальнейшем для выполнения метаанализа были включены результаты работ Мазурова В.И. с соавт. [50], опубликованных на русском языке в 2023 г. Длительность исследований варьировалась от 2 [29] до 10 лет [30].
Взаимосвязи между и уровнем МК в сыворотке крови и СКФ оценивались на основании исходных данных пациентов при включении в наблюдение (10 исследований – популяция с исходно нормальной функцией почек [28, 30–38]; 13 исследований – смешанная по наличию ХБП когорта [29, 39–50]). Анализ средней дельты СКФ проводился на различных временных интервалах: до 6 лет (3 исследования [33, 38, 50]) и от 6 до 10 лет (4 исследования [34, 39, 48, 50]).
Характеристики пациентов
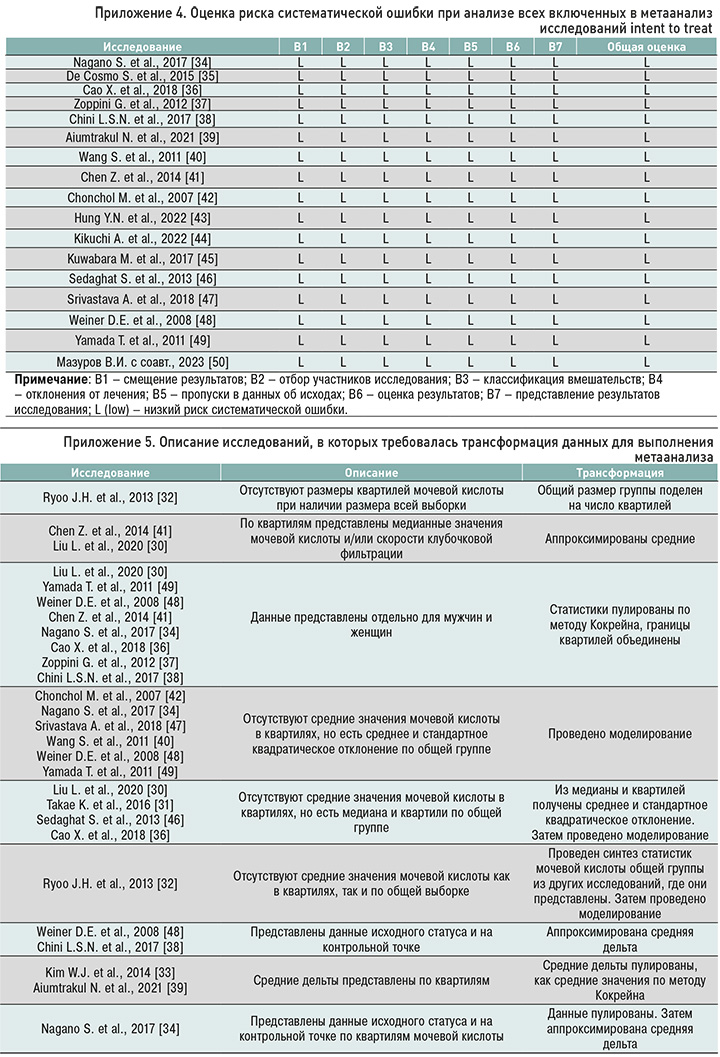
Суммарное количество участников в отобранных исследованиях составило 216 479 при среднем количестве 9 412. Минимальная выборка включала 407 пациентов [34], в то время как максимальная – 94 372 пациента [40]. Количество женщин суммарно составило 95 049 (43,9%), в отдельных группах – от 6 [34] до 15 808 [40] человек. Средний возраст пациентов варьировался от 39,4 до 74,0 лет (со средневзвешенным возрастом в 56,9 лет). Характеристики изучаемой популяции пациентов представлены в приложении 3. В ходе анализа включенных исследований была установлена незначительная методологическая и клиническая гетерогенность. По результатам оценки риска систематической ошибки методом intent-to-treat, все КИ соответствовали низкому риску (приложение 4).
Оценка связи уровня МК в сыворотке крови и СКФ
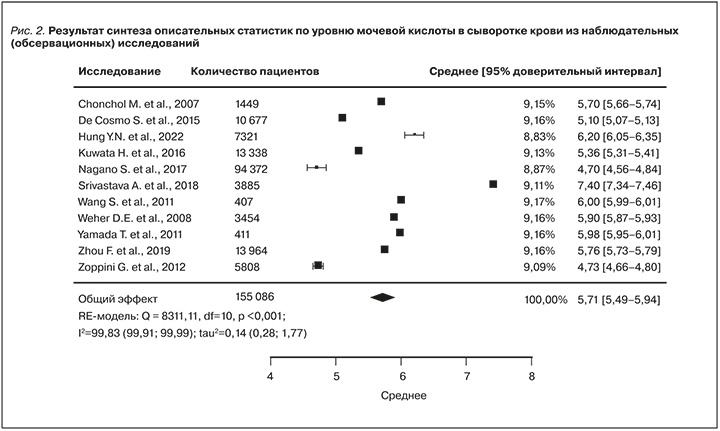
В процессе извлечения данных был выявлен ряд аспектов, требующих их трансформации (приложение 5). В публикации Ryoo J.H. et al. (2013) [32] отсутствовали данные о центральной тенденции уровня МК в сыворотке крови. Для их получения был проведен синтез по исследованиям с представленными данными (рис. 2). Обобщенные статистики использовались в моделировании.
В ходе анализа когорты пациентов с исходно нормальной функцией почек был выявлен значимый скорректированный эффект исходного уровня МК в сыворотке крови на СКФ (табл. 2).
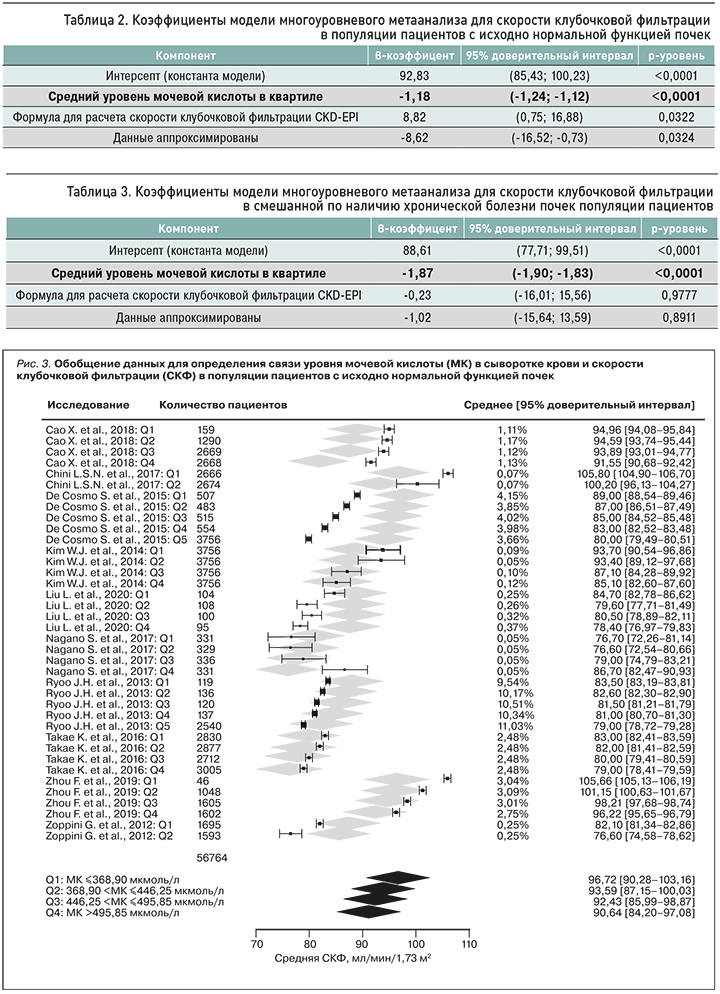
В результате проведенного метаанализа было установлено, что нарастание уровня МК в сыворотке крови на 1 мг/дл (60 мкмоль/л) приводит к снижению СКФ на 1,18 (95% ДИ: от -1,24 до -1,12) мл/мин/1,73м2 (рис. 3).
По данным омнибусного теста, модель была признана статистически значимой: QM (df=3) = 1582,5586; p <0,0001. Вместе с тем остаточная гетерогенность оставалась высокой: QE (df=34) = 12930,9534; p <0,0001.
В ходе анализа смешанной по наличию ХБП когорты пациентов был выявлен значимый скорректированный эффект исходного уровня МК в сыворотке крови на СКФ (табл. 3).
В результате проведенного метаанализа было установлено, что нарастание уровня МК в сыворотке крови на 1 мг/дл (60 мкмоль/л) вызывает снижение СКФ на 1,87 (95% ДИ от -1,90 до -1,83) мл/мин/1,73м2 (рис. 4).
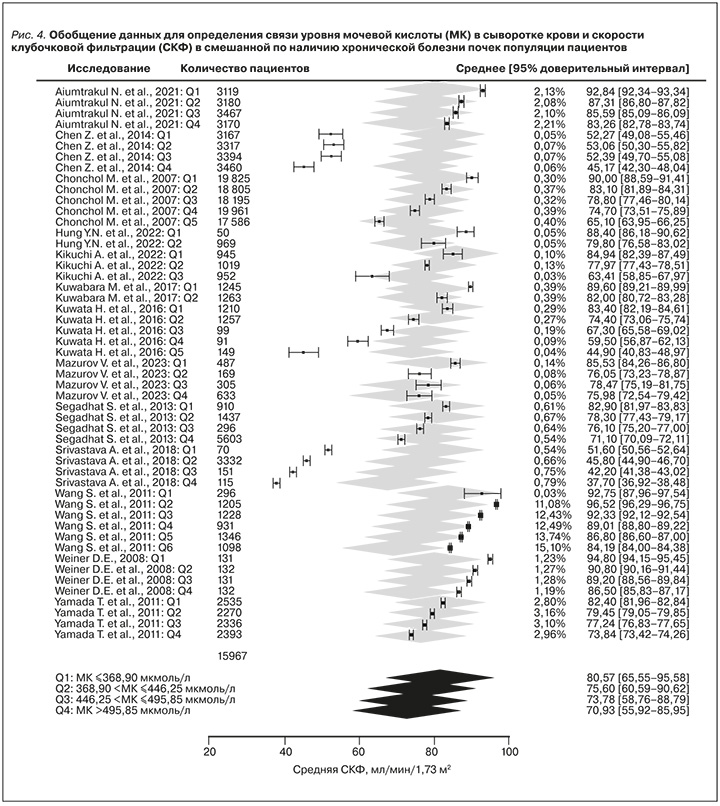
По данным омнибусного теста, модель признана статистически значимой: QM (df=3) = 10213,3564; p <0,0001. Вместе с тем остаточная гетерогенность оставалась высокой: QE (df=47) = 47516,2228; p <0,0001.
Оценка динамики СКФ у пациентов с БГУ при длительном наблюдении
В ходе анализа средней дельты СКФ в периоде наблюдения до 6 лет обращала на себя внимание высокая гетерогенность результатов исследований (рис. 5). Независимо от результатов проведенных анализов чувствительности средняя дельта СКФ в периоде наблюдения до 6 лет значимо отличалась от нуля. Вместе с тем гетерогенность снижалась до умеренной при исключении исследования Chini L.S.N. et al. (2017) [38]. В ходе анализа двух КИ [33,50] были получены результаты, которые продемонстрировали статистически значимое снижение СКФ на 4,44 (от -7,65 до -1,23) мл/мин/1,73м2 в смешанной по наличию ХБП когорте пациентов, страдающих БГУ (умеренная гетерогенность, I2=30,97).
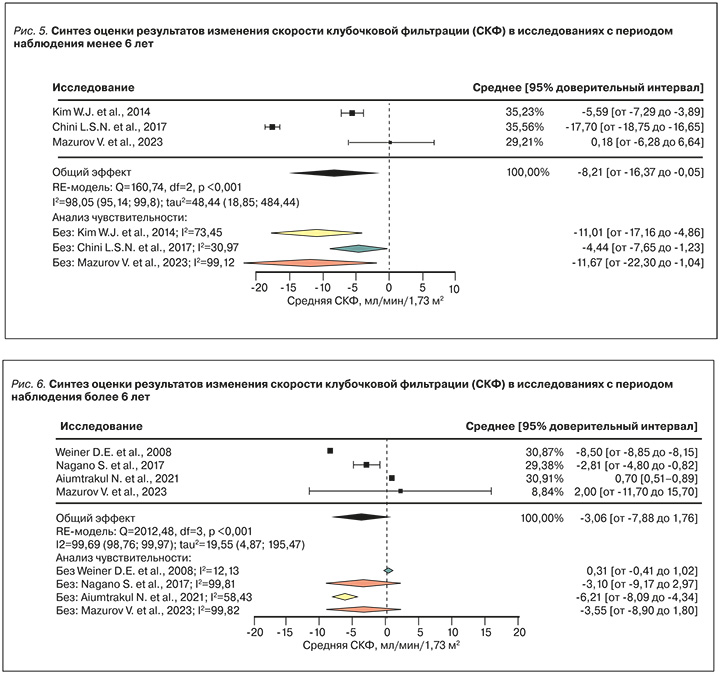
В ходе анализа средней дельты СКФ в периоде наблюдения более 6 лет также наблюдалась высокая гетерогенность результатов исследований (рис. 6). В двух КИ [39, 48] были получены противоположные результаты, что оказывало значимое влияние на гетерогенность. При этом работу Aiumtrakul N. et al. (2021) [39] выделяла особенность изучаемой когорты пациентов (контингент лиц – военнослужащие), что является менее репрезентативным для общей популяции, чем более крупная выборка пациентов в исследовании Weiner D.E. et al. (2008) [48]. В ходе анализа 3 исследований [34, 48, 50] были получены результаты, которые продемонстрировали статистически значимое снижение СКФ на 6,21 (от -8,09 до -4,34) мл/мин/1,73м2 в смешанной по наличию ХБП когорте пациентов, страдающих БГУ (умеренная гетерогенность, I2=58,43).
ОБСУЖДЕНИЕ
Согласно современным представлениям, ГУ способна оказывать негативное влияние на состояние почек как за счет кристаллозависимых, так и кристаллонезависимых механизмов [18, 51–53]. Основой первого является депонирование кристаллов моноурата натрия в интерстиции и/или канальцах почек, что создает предпосылки для хронического воспалительного процесса и повреждения ткани органа. Кристаллонезависимое поражение сопровождается активацией ренин-ангиотензин-альдостероновой системы, снижением биодоступности эндотелиального оксида азота и индукцией окислительного стресса, что приводит к повышению системного и внутриклубочкового давления в сочетании с афферентной артериолярной вазоконстрикцией и нарушением почечного кровотока. Наряду с этим, на фоне БГУ зарегистрированы такие патологические процессы, как пролиферация гладкомышечных клеток сосудов, гломерулярная гипертрофия, афферентный артериолярный склероз, артериолопатия, нарушения ауторегуляции и макрофагальная инфильтрация [13, 14, 18, 51, 53–57].
Целью нашего исследования была оценка влияния уровня МК в сыворотке крови на СКФ у пациентов с наличием ХБП и группы лиц с исходно нормальной функцией почек. В результате проведенного отбора в окончательный анализ вошли 23 наблюдательных (обсервационных) когортных исследования [28–50], в которых участвовали 216 479 пациентов. Следует отметить, что в отличие от зарубежных публикаций в представленный метаанализ были включены данные пациентов, страдающих БГУ, из популяции России («Санкт-Петербургский городской регистр пациентов с подагрой и БГУ» [50]).
В результате выполненного метаанализа были получены данные, демонстрирующие негативное воздействие ГУ на СКФ у пациентов с исходно нормальной функцией почек. Так, нарастание уровня МК в сыворотке крови на 1 мг/дл вызывает снижение СКФ на 1,2 мл/мин/1,73м2. Схожие результаты были представлены в ранее опубликованных исследованиях [21, 22, 24, 58,59]. Метаанализ 13 КИ (n=190 718) выявил значимую связь между повышенной концентрацией МК в сыворотке крови и дебютом ХБП (отношение шансов (ОШ) 2,35; 95% ДИ: 1,59–3,46) [21]. В метаанализе 30 КИ (n=577 334) отношение рисков (ОР) для возникновения ХБП у пациентов с самым высоким уровнем МК составило 1,22 (95% ДИ: 1,14–1,30) [58]. В недавно проведенном масштабном метаанализе, включавшем более 3 млн пациентов, ГУ также была ассоциирована с новыми случаями ХБП (ОШ/ОР 2,13; 95% ДИ: 1,74–2,61) [24]. С другой стороны, в результате метаанализа 24 КИ (n=412 238) было установлено, что при более низких уровнях урикемии отмечается уменьшение вероятности возникновения ХБП (ОР 0,65; 95% ДИ: 0,56–0,75) [59]. Более того, при нарастании уровня МК в сыворотке крови на 1 мг/ дл регистрировалось увеличение риска возникновения ХБП на 15% (95% ДИ: 1,10–1,21) по данным метаанализа 30 КИ (n=577 334) [58] и на 22% (95% ДИ: 1,16–1,28) по данным метаанализа 15 КИ (n=99 205) [22].
Наряду с этим, в ходе выполнения нашего метаанализа были получены результаты, в соответствии с которыми в смешанной по наличию ХБП когорте пациентов при нарастании концентрации МК в сыворотке крови на 1 мг/дл регистрируется снижение СКФ на 1,9 мл/мин/1,73м2. Стойкая ГУ, согласно результатам проведенных ранее крупных исследований, была ассоциирована с ухудшением течения ХБП и частотой неблагоприятных исходов [23, 59–62]. Так, по данным метаанализа 21 КИ (n=279 805), повышенный уровень МК в сыворотке крови у пациентов с нефропатиями приводил к снижению функции почек (ОР 1,35; 95% ДИ: 1,12–1,63) и увеличению смертности (ОР 1,67; 95% ДИ: 1,29–2,16) [23]. Опубликованные данные метаанализа 24 КИ (n=412 238) указывают на то, что при уменьшении выраженности ГУ наблюдается снижение риска прогрессирования ХБП (ОР 0,55; 95% ДИ: 0,44–0,68) [59]. В результате метаанализа 24 КИ (n=25 453) было установлено, что у пациентов с ХБП самый высокий уровень МК в сыворотке крови оказывает значимое негативное влияние на частоту неблагоприятных исходов (ОР 1,52; 95% ДИ: 1,33–1,73) [60]. В то же время у лиц с наличием патологии почек возрастание значений урикемии сопровождалось повышенным риском смертности от всех причин (ОР 1,30; 95% ДИ: 1,06–1,59 по данным метаанализа 29 КИ [61]) и от и сердечно-сосудистых заболеваний (ОР 1,47; 95% ДИ: 1,11–1,96 по данным метаанализа 11 КИ [62]). Более того, в результате проведения метаанализов 24 КИ (n=25 453) [60] и 11 КИ (n=27 081) [62], было обнаружено, что у пациентов с ХБП нарастание концентрации МК в сыворотке крови на 1 мг/дл влечет за собой повышение вероятности общей смертности на 8% (95% ДИ: 1,04–1,11) и сердечно-сосудистой смертности на 12% (95% ДИ: 1,02–1,24) соответственно.
Следует отметить, что дизайном большинства опубликованных ранее работ не предусматривалось строгое исключение из анализа пациентов с ГУ, страдающих подагрой, что может оказывать значимое влияние на результаты исследования. В нашем метаанализе был сделан акцент на изучение популяции лиц с БГУ, не имевших клинических и анамнестических данных о наличии подагры. Можно полагать, что данная группа пациентов нуждается в углубленном обследовании для ранней диагностики поражений почек и своевременной профилактики развития и прогрессирования ХБП. Важным является тот факт, что более интенсивное снижение СКФ регистрируется в смешанной группе пациентов по наличию ХБП, что может указывать на нарастание негативного потенциала ГУ при исходно сниженной функции почек.
Приведенные результаты большого количества КИ дают основания полагать, что нормализация уровня МК в сыворотке крови у лиц с БГУ, в том числе с помощью медикаментозной УСТ, может выступать важным фактором нефропротекции у пациентов, страдающих ХБП. Данное положение подтверждается тем фактом, что в результате проведенного нами метаанализа более значимое снижение СКФ отмечалось в смешанной по наличию ХБП группе пациентов, страдающих БГУ и не получавших медикаментозную УСТ, как в течение 6 лет (-4,44 мл/мин/1,73м2), так и на протяжении более длительного периода наблюдения (-6,21 мл/мин/1,73м2).
Таким образом, исходя из представленных данных, можно сделать вывод о негативном влиянии повышенного уровня МК в сыворотке крови на СКФ вне зависимости от исходной функции почек. Результаты, полученные в ходе проведенного метаанализа, дают основания для проведения УСТ у пациентов с БГУ, имеющих высокие риски формирования и прогрессирования ХБП.
Ограничения исследования
При обобщении большого количества обсервационных исследований по квартилям МК выполнение классического «pairwise-метаанализа» было невозможно ввиду большой вариабельности как числа, так и границ уровней МК в сыворотке крови. Применением сложных методов (трехуровневого метаанализа) не удалось снизить гетерогенность до умеренных значений. Вместе с тем объяснимость результатов с патофизиологической точки зрения может служить дополнительным маркером адекватности полученных данных. Остаточная гетерогенность вызвана, главным образом, особенностями наблюдательных исследований, в которых не всегда контролируется влияние всего комплекса вмешивающихся факторов.
ЗАКЛЮЧЕНИЕ
Результаты представленного метаанализа продемонстрировали статистически значимое отрицательное влияние повышения уровня МК в сыворотке крови на СКФ как у лиц с исходно нормальной функцией почек, так и в смешанной по наличию ХБП когорте пациентов. Кроме этого, установлено, что снижение фильтрационной функции почек на фоне ГУ в смешанной по наличию ХБП популяции больных имеет тенденцию к прогрессированию при более длительном периоде наблюдения. Таким образом, терапевтические меры, направленные на снижение уровня МК в сыворотке крови у лиц с БГУ, могут служить дополнительным фактором нефропротекции для профилактики развития и прогрессирования патологии почек. В то же время требуется дальнейшее проведение КИ, посвященных разработке алгоритмов применения УСТ у пациентов с начальными стадиями ХБП и БГУ.
Приложения
Приложение 1. Стратегии систематического поиска для выполнения метаанализа
EMBASE:
‘hyperuricemia’/exp OR hyperuric*:ab,ti OR hyper NEXT/1 uric* OR ‘uric acid’/exp OR ‘uric acid’:ab,ti OR uric NEXT/1 acid* OR ‘uric acid blood level’/exp OR ‘uric acid blood level’ OR ‘uric acid urine level’/exp OR ‘uric acid urine level’ OR ‘urate’/exp OR ‘urate’:ab,ti OR urate*:ab,ti OR ‘gout’/exp OR gout:ab,ti OR gouty:ab,ti OR ‘kidney function’/exp OR kidney NEXT/1 function* OR renal NEXT/1 function* OR glomerular NEXT/1 function* OR ‘dose kidney function relation’/exp OR ‘kidney function test’/exp OR ‘urea nitrogen blood level’/exp OR ‘blood urea nitrogen’ OR ‘bun’ OR ‘glomerulus filtration rate’/exp OR ‘glomerulus filtration rate’ OR ‘glomerular filtration’ OR ‘grf’ OR ‘egfr’ OR ‘kidney examination’/exp OR renograph* OR ‘urinalysis’/exp OR ‘kidney circulation’/exp OR ‘kidney circulation’ OR ‘renal circulation’ OR ‘creatinine clearance’/exp OR ‘creatinine’/exp OR ‘cystatin c’/exp OR ‘cystatin c’ OR ‘kidney’/exp OR ‘kidney’ AND (‘drug effect’/exp OR ‘drug effect’) OR ‘kidney disease’/exp OR ‘kidney disease’ OR ‘kidney diseases’ OR ‘renal disease’ OR ‘renal diseases’ OR nephropath* OR anuria* OR cystinuria OR gitelman* OR glomerulopath* OR glomerulosclero* OR ‘gordon syndrome’ OR hepatorenal OR ‘kidney amloidosis’ OR ‘kidney amyloid’ OR ‘renal amyloidosis’ OR ‘renal amyloid’ OR nephrocalcino* OR nephrolith* OR urolithiasis OR kidney NEXT/1 calcul* OR renal NEXT/1 calcul* OR ‘kidney calcification’ OR ‘kidney calcinosis’ OR ‘renal calcification’ OR ‘renal calcinosis’ OR ‘nephric calcinosis’ OR ‘kidney colic’ OR ‘renal colic’ OR ‘cystic kidney’ OR ‘cystic renal’ OR ‘kidney dysfunction’/exp OR ‘kidney dysfunction’ OR ‘renal dysfunction’ OR ‘glomerular dysfunction’ OR ‘kidney impairment’ OR ‘renal impairment’ OR ‘tubular dysfunction’ OR ‘polycystic kidney’ OR ‘kidney failure’ OR ‘renal failure’ OR ‘kidney fibrosis’ OR ‘renal fibrosis’ OR renal NEXT/1 insufficienc* OR kidney NEXT/1 insufficienc* OR ‘renal failure’ OR ‘kidney failure’ OR oliguria OR ‘frasier syndrome’ OR esrd OR ‘end stage kidney’ OR ‘end stage renal’ OR ‘acute kidney’ OR ‘acute renal’ OR hydronephro* OR pyonephro* OR hyperoxal* AND ‘observational study’/de OR ‘observational study’/exp OR ‘observational’:ab,ti OR ‘case control study’/de OR ‘case control’:ab,ti OR ‘case comparison’:ab,ti OR ‘retrospective’:ab,ti OR ‘cohort analysis’/de OR ‘cohort’:ab,ti OR ‘cohorts’:ab,ti OR ‘follow up’:ab,ti OR ‘longitudinal’:ab,ti OR ‘prospective’:ab,ti NOT (‘animal’/exp NOT ‘human’/de)
PUBMED:
Kidney/pathology OR Kidney/physiopathology OR Kidney/drug effects OR Kidney Diseases/blood OR Kidney Diseases/urine OR Kidney Function Tests[mh:noexp] OR Blood Urea Nitrogen[mh] OR blood-urea-nitrogen[tiab] OR BUN[tiab] OR Glomerular Filtration Rate[mh] OR glomerular-filtration[tiab] OR GFR[tiab] OR eGFR[tiab] OR Radioisotope Renography[mh] OR renograph*[tiab] OR kidney-function*[tiab] OR renal-function*[tiab] OR glomerular-function*[tiab] OR Urinalysis[mh] OR urinalysis[tiab] OR Urine/analysis OR Renal Circulation[mh] OR renal-circulation[tiab] OR kidney-circulation[tiab] OR Creatinine/blood OR creatinine-clearance[tiab] OR Creatinine/urine OR Cystatin C [mh] OR cystatin-c [tiab] OR Kidney Diseases [mh:noexp] OR kidney-disease* [tiab] OR Cystic Kidney Diseases [mh] OR cystic-kidney-disease* [tiab] OR cystic-renal-disease* [tiab] OR Cystic Kidney [mh] OR Polycystic Kidney Diseases [mh] OR Renal Insufficiency [mh] OR renal-insufficienc* [tiab] OR kidney-insufficienc* [tiab] OR renal-failure [tiab] OR kidney-failure [tiab] ABD Hyperuricemia[mh] OR hyperuric*[tiab] OR hyper-uric*[tiab] OR uric acid/blood[mh] OR uricacidem*[tiab] OR uricem*[tiab] OR ((elevate[tiab] OR elevated[tiab] OR elevates[tiab] OR elevating[tiab] OR elevation*[tiab] OR increase[tiab] OR increased[tiab] OR increases[tiab] OR increasing[tiab] OR high[tiab] OR higher[tiab]) AND (urate[tiab] OR urates[tiab] OR uric acid[mh] OR uric-acid*[tiab])) AND (observational study[pt] OR «observational studies as topic»[MeSH Terms] OR observational[tiab] OR «case-control studies»[MeSH Terms] OR «case control»[tiab] OR «case comparison»[tiab] OR retrospective[tiab] OR «cohort studies»[MeSH Terms] OR cohort[tiab] OR cohorts[All Fields] OR follow-up[tiab] OR longitudinal[tiab] OR prospective[tiab]) NOT («animals»[MeSH Terms] NOT «humans»[MeSH Terms])