ВВЕДЕНИЕ
В настоящее время приводятся данные о том, что к гиперурикемии (ГУ) могут быть отнесены уровни мочевой кислоты (МК) в сыворотке крови более 360 мкмоль/л у женщин и выше 420 мкмоль/л у мужчин. При этом ГУ считается бессимптомной (БГУ), если у пациента в анамнезе отсутствуют клинические признаки подагрического артрита.
По данным крупных эпидемиологических исследований, за последние десятилетия отмечается увеличение распространенности БГУ в большинстве стран мира [1–2]. Так, в России она составляет 16,8% (25,3% среди мужчин и 11,3% среди женщин) и, следовательно, выявляется примерно у 14,9 млн представителей взрослого населения страны [1].
Повышенный уровень сывороточной МК не только служит главной причиной развития подагры, но и представляет собой независимый фактор риска (ФР) широкого спектра заболеваний внутренних органов [3–10]. Одним из таких примеров может быть сочетание остеоартрита (ОА) с БГУ, которое нередко встречается в реальной клинической практике. Это имеет особое значение, поскольку ОА является наиболее распространенным хроническим заболеванием опорно-двигательного аппарата и одной из ведущих причин инвалидизации данной группы пациентов [11, 12]. Наряду с этим в литературе приводятся сведения о негативном влиянии ГУ на течение ОА [13–18].
В настоящее время считается доказанной определяющая роль МК в развитии «гиперурикемической нефропатии» [19, 20]. Согласно клиническим рекомендациям Ассоциации нефрологов России 2021 г. [21], всем пациентам с хронической болезнью почек (ХБП) предлагается определять содержание МК в сыворотке крови. В случае, когда уровень этого показателя превышает нормальные значения, следует проводить исследование экскреции МК с мочой для дифференциальной диагностики возможных причин ГУ и выбора методов адекватной терапии [21]. Вместе с тем до конца не решен следующий вопрос: является ли БГУ полноценным предиктором или только следствием патологии почек [22].
Продолжается дискуссия о целесообразности применения уратснижающей терапии (УСТ) у пациентов с БГУ. Проведен целый ряд исследований, демонстрирующих положительное влияние уратснижающих препаратов на основные показатели функции почек у пациентов с ХБП и неконтролируемой ГУ [23–26]. Однако в литературе имеются и противоположные данные, свидетельствующие о том, что БГУ не является показанием к проведению УСТ, несмотря на наличие у пациента ХБП, уролитиаза, артериальной гипертензии (АГ) или сахарного диабета 2-го типа (СД 2).
Целью настоящей работы являлось изучение взаимосвязей БГУ с ХБП, а также влияния медикаментозной УСТ на скорость клубочковой фильтрации (СКФ) у пациентов с ОА.
МАТЕРИАЛ И МЕТОДЫ
Сотрудниками ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России и СПб ГБУЗ «Клинической ревматологической больницы № 25» в 2020 г. был создан «Санкт-Петербургский городской регистр пациентов с подагрой и БГУ», включающий данные медицинских карт более 1000 пациентов с подагрой и 1000 больных другими ревматическими заболеваниями с БГУ, проходивших обследование и лечение на базе указанного ЛПУ в период с 2000 по 2023 г. В регистре содержатся сведения о половой принадлежности, возрасте, рабочей специальности, повседневной деятельности пациентов, а также подробная информация об основном заболевании и коморбидной патологии (включая данные анамнеза, клинические стадии и степени активности, лабораторные показатели и этапы лечения с применением перечня лекарственных средств). Внесение информации в регистр проводится в обезличенном виде, не позволяющем идентифицировать отдельного пациента как личность. Каждому из субъектов присваивается индивидуальный номер.
Для решения поставленной цели было проведено ретроспективное когортное одноцентровое исследование с включением данных 1026 больных ОА, разделенных на две сопоставимые по количеству субъектов группы: 530 пациентов с БГУ (зарегистрированный уровень МК в сыворотке крови выше 360 мкмоль/л для женщин и выше 420 мкмоль/л для мужчин без признаков подагры) и 496 пациентов с нормальными значениями МК в сыворотке крови. Исследование проводилось с одобрения локального комитета по этике ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России.
Критериями включения в исследование служили возраст от 18 до 70 лет, диагноз ОА, верифицированный в соответствии с критериями Американской коллегии ревматологов (ACR) вне зависимости от локализации и стадии патологического процесса, наличие данных об уровне МК и креатинина в сыворотке крови.
Критерии невключения: возраст менее 18 и более 70 лет, наличие признаков подагры (согласно критериям ACR/Европейской противоревматической лиги (EULAR) 2015 г. [27] и/или S. Wallace 1977 г. [28]) на момент осмотра или по данным анамнеза, ХБП в стадии терминальной почечной недостаточности, беременность и период лактации, наличие потенциальных причин вторичной ГУ (кожный псориаз, активный онкологический процесс, миело-/лимфопролиферативные заболевания, программная химиотерапия) и иммуновопалительных заболеваний, активный туберкулез, хронические вирусные инфекции (вирусные гепатиты, ВИЧ). Данные каждого включенного пациента проходили детальную обработку с регистрацией сопутствующих состояний. ХБП верифицировалась в тех случаях, когда в карте пациента имелась соответствующая запись и/или имелись данные о наличии хронического пиелонефрита, хронического гломерулонефрита, мочекаменной болезни (МКБ), и/или регистрировалось снижение расчетной СКФ (рСКФ) менее 60 мл/мин/1,73 м2, и/или выявлялась протеинурия более 0,5 г/сут, и/или определялся патологический мочевой осадок не менее чем в двух анализах мочи, и/или выявлялись патологические изменения почек при инструментальном обследовании. Диагноз СД 2-го типа верифицировался при наличии в карте пациента соответствующей записи и/или регистрации уровня глюкозы в сыворотке крови натощак более 7 ммоль/л и/или наличия данных о приеме сахароснижающих препаратов. Диагноз ожирение регистрировался при наличии соответствующей записи в карте пациента или значении индекса массы тела более 30 кг/м2. Диагноз АГ устанавливался при наличии соответствующей записи в карте пациента.
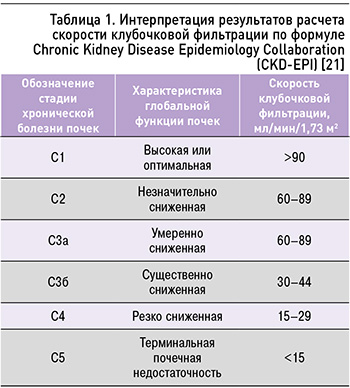
Обязательной процедурой для всех субъектов, включенных в исследование, был расчет СКФ по формуле Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) 2009 г. [21, 29, 30]:
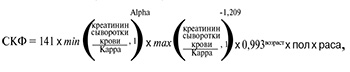
где Kappa – индекс, равный 0,7 для женщин и 0,9 для мужчин; Alpha – индекс, равный -0,329 у женщин и -0,411 у мужчин; пол – индекс, равный 1,018 у женщин и 1 у мужчин; раса – индекс, равный 1,159 у негроидной расы и 1 у остальных; возраст – возраст пациента в полных годах.
Интерпретация результатов, получаемых по этой формуле, представлена в таблице 1.
Для определения динамики показателей рСКФ, ее взаимосвязей с уровнями МК в сыворотке крови и проведением медикаментозной УСТ была отобрана когорта пациентов на повторном визите в исследовательский центр. У каждого из обследованных субъектов выполнялась оценка проводимой терапии (доза уратснижающего препарата, уровни МК и креатинина в сыворотке крови, факт достижения/недостижения целевых значений МК в сыворотке крови, повторный расчет СКФ по формуле CKD-EPI). В качестве целевых уровней МК в сыворотке крови был установлен порог менее 360 мкмоль/л в соответствии с ранее опубликованными результатами исследований и рекомендательными консенсусами, подтверждающими снижение риска развития и прогрессирования патологии внутренних органов при поддержании этих значений [8–10, 31].
Всем пациентам с ГУ проводилась немедикаментозная терапия: лечащим врачом давались рекомендации по коррекции образа жизни (ОЖ), борьбе с гиподинамией и избыточной массой тела, соблюдению диеты с ограничением продуктов, богатых пуринами (мясо и морепродукты), алкоголя и сладких безалкогольных напитков, содержащих фруктозу. Более того, осуществлялась коррекция антигипертензивной терапии с учетом влияния получаемых пациентом лекарственных средств на метаболизм уратов. Рекомендуемые лечебные мероприятия приводили к достижению целевых уровней МК (менее 360 мкмоль/л) в сыворотке крови в 19,1% (n=63) случаев при повторном визите в исследовательский центр. Лекарственная УСТ назначалась при стойко повышенном уровне МК в сыворотке крови у обследованных пациентов, несмотря на проводимую немедикаментозную терапию, а также при наличии факторов сердечно-сосудистого риска согласно опубликованным ранее рекомендациям [31]. Препаратами, применяемыми для коррекции БГУ, являлись ингибиторы ксантиноксидазы: аллопуринол (от 50 до 400 мг/сут) или фебуксостат (от 40 до 80 мг/сут).
Статистический анализ полученных данных выполнялся в среде R-Studio 2022.07.2 (R 4.2.1, Python 3.9). Количественные данные приведены в виде среднего и стандартного квадратического отклонения или медианы с указанием интерквартильного размаха (25-й и 75-й процентили). Частоты представлены как процент случаев с наличием признака. Наряду с этим указан 95% доверительный интервал (95ДИ-, 95ДИ+), границы которого рассчитывались с коррекцией по Агрести–Коулу. Сравнение динамики количественных показателей в группах проводилось при помощи дисперсионного анализа повторных измерений. В случае несоблюдения условия сферичности по критерию Моучли применялась поправка Гринхауз–Гайссера. Парные сравнения выполнялись при помощи t-критерия Стьюдента в модификации Уэлча. При распределении данных, отличных от нормального, использовались критерии Манна–Уитни и Уилкоксона. Сравнение частот в группах осуществлялось с помощью точного критерия Фишера. Если таблица сопряженности была размером более 2×2 ячейки, применялось моделирование по Монте-Карло. При множественных сравнениях р-уровни корректировались с применением поправки Беньямини–Йекутели. Различия и взаимосвязи между полученными данными считались статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ
Группу обследованных пациентов составляли 1026 человек с верифицированным диагнозом ОА, соответствовавших критериям включения и невключения. Все субъекты были распределены на две группы в зависимости от уровня МК в сыворотке крови (табл. 2).

Из данных, представленных в таблице 2, следует, что в группе пациентов с ОА, имевших повышенный уровень МК в сыворотке крови, превалировали субъекты более старшего возраста, мужского пола; кроме того, у них значительно чаще (р <0,001) выявлялись АГ, СД 2 и ожирение по сравнению с больными ОА без гиперурикемии. При этом наличие БГУ ассоциировалось с более высокими уровнями глюкозы, общего холестерина и креатинина в сыворотке крови (р <0,001).
Медикаментозную УСТ получали 37,7% (n=200) пациентов: из них 98% (n=196) принимали аллопуринол, доза которого в среднем составляла 117,1±59,3 мг/сут (от 50 до 400 мг) и 2% (n=4) – фебуксостат в средней дозе 60±23,1 мг/сут (от 40 до 80 мг). На фоне проводимого лечения у 31,5% (n=63) обследованных были достигнуты целевые значения МК в сыворотке крови (менее 360 мкмоль/л), у 5,5% (n=11) отмечалась вторичная неэффективность, у 38% (n=76) не удавалось снизить уровень МК в сыворотке крови до необходимого уровня. Основным фактором недостаточной эффективности лекарственной терапии БГУ выступала низкая комплаентность пациентов – нерегулярный прием препаратов, склонность к самостоятельному снижению дозы и/или несоблюдение рекомендаций по коррекции ОЖ. Так, 25% (n=50) лиц, включенных в наблюдение, не проходили лабораторный контроль и/или не являлись на повторный осмотр, несмотря врачебные рекомендации. Развитие нежелательных явлений (НЯ) регистрировалось у 6 пациентов, получавших аллопуринол: у 4 – кожная аллергическая сыпь, у 1 – диарея, еще у 1 – головокружение. На фоне применения фебуксостата у 1 пациента определялось нарастание печеночных трансаминаз выше трех нормальных значений лаборатории. Наличие данных реакций в анамнезе служило противопоказанием к назначению ЛС, в то время как их развитие в период наблюдения в исследовательском центре являлось основанием для прекращения терапии. Стоит отметить, что все из перечисленных нежелательных явлений были полностью купированы после отмены препарата.
Согласно результатам проведенного анализа, в группе пациентов с ОА и БГУ признаки ХБП (54%; n=286) встречались достоверно чаще (р <0,001), нежели в группе обследованных с ОА и нормальным уровнем МК в сыворотке крови (25,8%; n=128; рис. 1).

Среди хронических заболеваний почек у больных ОА с БГУ достоверно чаще встречались МКБ (19,6%; n=104; р <0,001; рис. 2) и хронический пиелонефрит (20,2%; n=107; р=0,001) по сравнению с группой больных ОА без БГУ (8,7%; n=43 и 12,5%; n=62 соответственно). При этом частота хронического гломерулонефрита существенно не различалась между сравниваемыми группами обследованных (0,6%; n=3 против 0,2%; n=1; p=0,337).
Наряду с этим в ходе проведенного анализа полученных данных удалось установить, что у больных ОА с повышенным уровнем МК в сыворотке крови имелась достоверно бóльшая распространенность 3а–4 стадий ХБП (табл. 3).

В ходе следующего этапа исследования все включенные пациенты, не получавшие медикаментозную УСТ, были разделены на 6 квартилей в зависимости от уровня МК в сыворотке крови. В результате было установлено, что в группе больных ОА с максимальными значениями МК регистрируются наименьшие показатели рСКФ (табл. 4, рис. 3).

В результате проведения логистической регрессии было установлено, что некорректированное отношение шансов (ОШ) для снижения рСКФ менее 60 мл/мин/1,73 м2 у больных ОА при нарастании уровня МК в сыворотке крови на 1 мг/дл (59 мкмоль/л) составляет 1,4 (59% ДИ: 1,3-1,6). После корректировки на другие факторы риска ХБП, такие как пол, возраст, АГ, СД 2 и ожирение, вероятность снижения рСКФ менее 60 мл/мин/1,73 м2 увеличивалась до 50% (скорректированное ОШ 1,5; 95% ДИ: 1,4-1,7).
На небольшой когорте пациентов удалось определить, что за время длительного (более 3 лет) периода наблюдения снижение уровня МК в сыворотке крови у лиц, не получавших медикаментозную УСТ, сопровождается нарастанием рСКФ (табл. 5).
На втором визите в исследовательский центр все пациенты с ОА и БГУ были разделены на две группы в зависимости от достижения или недостижения целевых уровней МК в сыворотке крови (менее 360 мкмоль/л) на фоне немедикаментозной или медикаментозной УСТ. Динамика сывороточных уровней МК и креатинина, а также рСКФ оценивались во время повторного осмотра лечащим врачом на следующих временны'х интервалах: 3–9 мес (7,01±1,61), 6–12 (10,04±1,94) , 9–15 (11,39±1,43) и 12–24 (13,87±3,35) мес.
У больных ОА в сочетании с БГУ, достигавших целевых уровней МК в сыворотке крови, вне зависимости от метода лечения отмечалось значимое увеличение рСКФ через 3–9 (7,01±1,61), 6–12 (10,04±1,94) и 9–15 (11,39±1,43) мес проводимой терапии, тогда как у обследованных пациентов с ОА и сохраняющейся ГУ в тех же временны'х интервалах наблюдалось снижение рСКФ (табл. 6, рис. 4).


В группе больных ОА с БГУ при достижении целевых уровней МК вероятность прогрессирования стадии ХБП через 6–12 (10,04±1,94) мес проводимой терапии была значимо ниже (ОШ 0,087; 95% ДИ: 0,011–0,701; р=0,006), чем в группе пациентов, у которых сохранялась БГУ (табл. 7). Следует отметить, что проведение как немедикаментозной, так и медикаментозной УСТ приводило к снижению уровня МК в сыворотке крови на всех временны'х интервалах. При этом в группе пациентов, принимавших препараты из группы иКСО, отмечалась достоверно более значимая положительная динамика через 6–12 (10,04±1,94), 9–15 (11,39±1,43) и 12–24 (13,87±3,35) мес. Более того, у обследованных лиц, получавших медикаментозную УСТ в течение 6–12 (10,04±1,94) и 9–15 (11,39±1,43) мес, наблюдалось значимое увеличение рСКФ по сравнению с пациентами, которым проводилось немедикаментозное лечение (табл. 8).

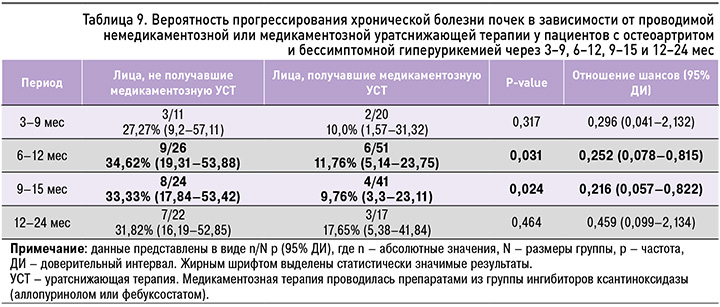
У пациентов с ОА и БГУ, которым проводилась медикаментозная УСТ, в отличие от пациентов, получавших немедикаментозное лечение, вероятность прогрессирования стадии ХБП через 6–12 (10,04±1,94) мес (ОШ 0,252; 95% ДИ: 0,078–0,815; р=0,031) и 9–15 (11,39±1,43) мес (ОШ 0,216; 95% ДИ: 0,057–0,822; р=0,024) была достоверно ниже (табл. 9).
ОБСУЖДЕНИЕ
Согласно результатам проведенного исследования, у больных ОА с БГУ значительно чаще выявляются АГ, СД 2, ожирение и ХБП относительно группы пациентов с ОА и нормоурикемией. Полученные данные позволяют расценивать стойкое повышение МК в сыворотке крови у пациентов с ОА как значимый фактор риска заболеваний сердечно-сосудистой системы, почек, а также СД 2 и ожирения. Подтверждением этому служит целый ряд крупных популяционных исследований. Так, в одном из них было показано, что возрастание уровня МК в сыворотке крови у наблюдаемых 5899 человек без сопутствующих заболеваний в течение 5 лет сопровождалось значимым увеличением заболеваемости АГ (p <0,001), дислипидемии (p <0,001), ХБП (р <0,001), а также нарастанием массы тела (р <0,001), в то время как для СД 2 отмечалась тенденция (р=0,087) [32]. По данным крупных метаанализов, наличие у пациента высоких значений МК в сыворотке крови приводит к увеличению риска развития АГ на 41–48% [33, 34], а СД 2 – на 56–67% [35, 36]. Более того, нарастание уровня МК в сыворотке крови на 1 мг/дл (59 мкмоль/л) повышает вероятность возникновения АГ на 13–15% [33, 34], СД 2 – на 6–11% [36, 37], метаболического синдрома – на 30% [38]. Можно полагать, что ГУ оказывает свое негативное влияние не только посредством прямого патогенного действия МК на целый ряд метаболических процессов в организме человека, но и через ксантиноксидазу, которая обладает способностью к взаимодействию с поверхностью эндотелиальных клеток и использует молекулярный кислород в качестве акцептора; это приводит к увеличению оксидативной активности, образованию супероксид-аниона и активации перекисного окисления липидов [5–8, 39, 40].
В настоящее время в соответствии с рекомендациями Российского кардиологического общества и Европейского общества кардиологов (ESC) определение уровня МК в сыворотке крови рекомендовано всем пациентам с верифицированным диагнозом АГ как часть скрининга на модифицируемые сердечно-сосудистые факторы риска [41, 42]. Кроме того, Borghi C. et al. был принят и опубликован «Экспертный консенсус по диагностике и лечению пациентов с гиперурикемией и высоким сердечно-сосудистым риском» [8, 9]. Инициатива зарубежных коллег была поддержана и модифицирована российскими экспертами в области кардиологии в виде опубликования Консенсуса по ведению пациентов с гиперурикемией и высоким сердечно-сосудистым риском, регламентирующего проведение УСТ у больных сердечно-сосудистыми заболеваниями [10, 43].
Продолжением этой работы стало проведение в конце 2022 г. совета экспертов «В фокусе – гиперурикемия», по результатам которого была принята и опубликована резолюция, содержащая подробный пошаговый алгоритм по выбору лечебной тактики у пациента с повышенным уровнем МК в сыворотке крови [31]. Согласно предлагаемой схеме, медикаментозное лечение должно проводится лицам с БГУ и наличием сердечно-сосудистых рисков, а также больным ХБП с уровнем МК в сыворотке крови более 600 мкмоль/л и ее суточной экскрецией более 1 г. В качестве препарата первой линии УСТ рекомендовано применение аллопуринола [31]. В случае недостижения целевых уровней МК в сыворотке крови при назначении максимально возможных терапевтических доз аллопуринола или при его непереносимости у пациентов с ГУ возможно рассмотрение терапии лекарственными средствами из группы урикозуретиков или фебуксостатом в зависимости от клинической ситуации.
Следует подчеркнуть, что результаты проведенного анализа подтверждают значимую роль БГУ в увеличении частоты ХБП и ее прогрессировании у пациентов с ОА. Так, у лиц с высоким уровнем МК в сыворотке крови наблюдались наименьшие значения рСКФ и чаще регистрировались тяжелые стадии ХБП. Более того, при увеличении уровня МК в сыворотке крови на 1 мг/дл (59 мкмоль/л) у пациентов с ОА вероятность снижения рСКФ менее 60 мл/мин/1,73 м2 возрастала на 50% (скорректированное ОШ 1,5; 95% ДИ: 1,4–1,7). Приведенные нами результаты согласуются с выводами крупных зарубежных исследований, в соответствии с которыми ГУ относится к независимым факторам риска развития и прогрессирования ХБП [6, 7, 19, 20, 23, 32, 44–48]. Так, метаанализ 13 клинических исследований (КИ) выявил значимую положительную связь между повышенным уровнем МК в сыворотке крови и впервые возникшей ХБП (отношение рисков (ОР) 2,35; 95% ДИ: 1,59–3,46) [44]. Согласно метаанализу 15 КИ, при увеличении уровня МК в сыворотке крови на 1 мг/дл (59 мкмоль/л) ОР для формирования ХБП составило 1,22 (95% ДИ: 1,16–1,28) [45], а в метаанализе 21 КИ вероятность неблагоприятного исхода у пациентов с ХБП увеличивалась на 67% (95% ДИ: 1,29–2,16) [46]. В других работах было показано, что уровень смертности у пациентов с хроническими заболеваниями почек коррелирует с концентрацией МК в сыворотке крови [46–48].
В выполненной нами работе было установлено, что у пациентов, получавших медикаментозную УСТ препаратами из группы ингибиторов ксантиноксидазы, отмечался значимый прирост рСКФ и замедление прогрессирования ХБП. Важным является тот факт, что позитивные результаты достигались на фоне применения низких доз аллопуринола (117,1±59,3 мг/сут) или фебуксостата (60±23,1 мг/сут). При этом значимый терапевтический эффект отмечался как через 6–12, так и через 9–15 мес проведения лечения. В литературе широко представлены результаты наблюдательных и клинических исследований, демонстрирующих различные эффекты УСТ у пациентов с ГУ. Однако крупных метаанализов по изучению данной взаимосвязи у пациентов с отсутствием подагры на данный момент недостаточно.
Некоторыми рандомизированными контролируемыми испытаниями (РКИ) продемонстрировано улучшение функции почек у лиц с БГУ на фоне применения ингибиторов ксантиноксидазы [24–26]. Так, в работе Bayram D. et al. [24] в группе пациентов, получавших аллопуринол в течение 104 нед, отмечалось увеличение клиренса креатинина с 43,4±20,1 до 51,4±24,9 мл/мин (p=0,011). В исследовании Goicoechea M. et al. [25] были получены данные, согласно которым через 24 мес терапии в контрольной группе уровень рСКФ снижался на 3,3±1,2 мл/мин/1,73 м2, тогда как в группе аллопуринола этот показатель возрастал на 1,3±1,3 мл/мин/1,73 м2 (р=0,018). В свою очередь, в исследовании Mukri M. et al. [26] было обнаружено, что через 6 мес терапии в группе пациентов, получавших фебуксостат, рСКФ оставалась без существенного изменения (от 26,2 до 26,3 мл/мин/1,73 м2), а вот в контрольной группе наблюдалось значимое снижение этого показателя (с 28,2 до 27,6 мл/мин/1,73 м2). В то же время результаты других РКИ, проведенных Badve S. et al. [49] и Kimura К. et al. [50], не выявили значимого положительного влияния применения ингибиторов ксантиноксидазы на СКФ у пациентов с БГУ.
Стоит отметить следующее: в ходе анализа представленного ретроспективного исследования, в котором авторы непосредственно не принимали участия (согласно дизайну КИ), выяснилось, что у 38% пациентов не удалось достигнуть целевых уровней МК в крови на фоне УСТ, а у 5,5% отмечалось ускользание эффекта в ходе проведения лечения. Прежде всего это было обусловлено недостаточной приверженностью пациентов к рекомендованной терапии (нерегулярный прием препаратов, склонность к самостоятельному снижению дозы и/или несоблюдение рекомендаций по коррекции ОЖ) и/или несвоевременной коррекцией дозы ЛС лечащим врачом. Приведенные данные служат основанием для более эффективного взаимодействия между медицинским персоналом и пациентом, направленного на динамический контроль за выполнением врачебных рекомендаций (низкопуриновая диета, здоровый ОЖ, борьба с избытком массы тела, физическая активность, прием лекарственных препаратов) и выполнение лабораторного исследования уровня МК 1 раз в 3 мес для оценки эффективности назначенной терапии. Важная роль в выполнении врачебных рекомендаций должна ложиться и на родственников пациента. В дальнейших исследованиях планируется более подробный анализ эффективности и безопасности УСТ у пациентов с БГУ.
Немаловажным аспектом является безопасность лекарственной терапии. Так, в группе пациентов с ОА и БГУ, получавших медикаментозную УСТ, нежелательные явления наблюдались у 6 пациентов и включали нетяжелые кожную аллергическую реакцию, диарею и головокружение во время приема аллопуринола, а также нарастание печеночных трансаминаз при терапии фебуксостатом. Эти реакции полностью купировались после отмены препарата.
Ограничения исследования. Представленное исследование является ретроспективным анализом данных, с чем ассоциирован ряд ограничений, в частности отсутствие рандомизации, ослепления и группы плацебо при изучении роли лекарственной терапии. Ограничениями могут выступать также отбор пациентов с наличием основного диагноза, такого как ОА, и изучение населения одного региона (Российская Федерация), что не позволяет считать исследованную выборку репрезентативной для общей популяции и полностью здоровых лиц. В проведенном исследовании не исключалось воздействие всех возможных факторов риска риска ХБП (влияние основного диагноза, лекарственная терапия и т.д.). Все данные оценивались ретроспективно, что не исключает возможных погрешностей в определении распространенности некоторых хронических заболеваний. Оценка функции почек выполнялась в смешанной популяции (лица, имеющие и не имеющие признаков ХБП на момент включения в анализ) и только по показателю рСКФ без данных об альбуминурии. Для более достоверной оценки влияния БГУ и УСТ на формирование и течение патологии почек необходимо проведение крупных проспективных многолетних наблюдений, РКИ и особенно метаанализов.
ЗАКЛЮЧЕНИЕ
Согласно анализу данных «Городского регистра Санкт-Петербурга пациентов с подагрой и бессимптомной гиперурикемией» повышение уровня МК в сыворотке крови у больных ОА, не имеющих признаков подагры, ассоциировано с более широкой распространенностью заболеваний почек и тяжестью их течения. У больных ОА с БГУ достижение целевых уровней МК в сыворотке крови, в том числе при помощи медикаментозной УСТ, способно оказывать позитивное влияние на рСКФ и замедлять прогрессирование стадии ХБП. Разработка междисциплинарных алгоритмов диагностики и ведения пациентов с ГУ на этапе ее бессимптомного течения видится важной стратегической задачей, решение которой может привести к снижению заболеваемости и интенсивности прогрессирования патологии почек.



