Ионы магния и кальция, натрия и калия являются электролитами, посредством которых поддерживается электрический баланс жизненно важных органов. Вторичные эффекты дефицита магния — гипокалиемия, снижение содержания калия в миокарде, скелетных мышцах, почках, костях, сопровождающееся компенсаторным увеличением уровней натрия в этих тканях. И наоборот, пищевой дефицит калия нарушает гомеостаз магния, приводя к усилению стресса и потерям микроэлемента организмом [1].
По синергидным ролям калия и магния в физиологии, терапии и кардиологии имеется более 28 100 научных публикаций. При этом интерес к изучению данного вопроса нисколько не ослабевает: с 70-х годов прошлого столетия ежегодно появляется в среднем по 700 публикаций на данную тему.
В настоящей работе анализ массива из 28 144 публикаций был проведен с использованием современных методов компьютерного обучения, развиваемых в рамках алгебраического подхода к распознаванию образов [2]. Для выделения релевантных публикаций в таком большом массиве данных были использованы математические методы распознавания и машинного обучения, разрабатываемые в научной школе академика Ю.И. Журавлева. В результате был получен список из 168 репрезентативных исследований, описывающих различные аспекты синергизма между магнием и калием, обеспечивающего нормальное функционирование миокарда, которые были впоследствии детально проанализированы группой экспертов.
Далее последовательно рассмотрены содержание калия и магния в различных биосубстратах, ятрогенные причины дефицита калия и магния, калийсберегающие эффекты магния, синергизм калия и магния в поддержании ритма сердца (в профилактике удлиненного интервала QT), антиаритмические и кардиопротекторные эффекты калия и магния. Показана эффективность сочетанного приема органических солей калия и магния как для скоровспомощной терапии, так и для долговременной профилактики препаратом панангин.
Уровни калия и магния в различных биосубстратах. В ответ на адренергическую или холинергическую стимуляцию кардиомиоцитов происходит отток ионов К+ из клеток, что является ключевым фактором патогенеза фибрилляции желудочков, ассоциированной с инфарктом миокарда (ИМ), электрошоком и интоксикацией гликозидами. Магний препятствует оттоку ионов К+, что тормозит развитие желудочковых аритмий (ЖА) [3].
Установлено, что у пациентов с ИМ (45—60 лет, n=232) средние уровни K+ и Mg2+ в плазме крови были значительно снижены на фоне повышения уровня Na+ (р<0,05). Уровни экскреции K+ и Mg2+ с мочой были выше у пациентов с ИМ, чем в контрольной группе без ИМ (n=103) [4]. Вследствие задержки натрия в организме у пациентов, перенесших ИМ и не получивших коррекции калия и магния, отмечается задержка жидкости в тканях. Кроме того, чрезмерное увеличение внутриклеточного Na+ приводит к изменению мембранного потенциала и способствует развитию магнийдефицитных аритмий.
В эксперименте показано, что содержание магния в рационе определяет активность Na/K-насосов желудочков, регулирующих уровни Na+. Экспериментальные диеты, содержащие 80, 200, 350, 500 или 650 мг/кг магния, при приеме в течение 6 нед приводили к дозозависимому увеличению активности Na/K-АТФазы [5].
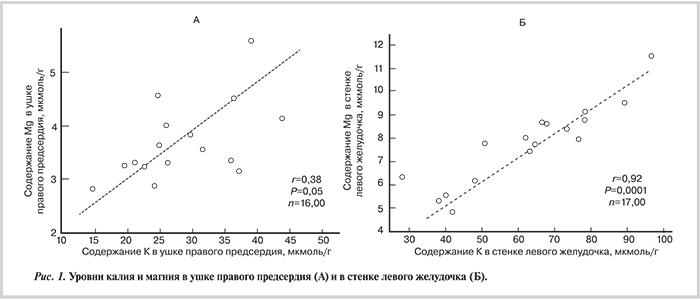
При изучении биопсий тканей сердца 26 пациентов, перенесших операцию на сердце (аортокоронарное шунтирование, операции на клапанах), было установлено, что концентрации Mg2+ и К+ значительно коррелируют между собой. Например, содержание калия в предсердиях составило 46±4 мкмоль/г (на 1 г сырой ткани), магния — 4,4±0,6 мкмоль/г, причем отмечено существование достоверной корреляции между Mg2+ и К+ (R=0,54; P=0,005). В ушке правого предсердия средние уровни калия составили 31±10 мкмоль/г, магния — 3,7±0,7 мкмоль/г (r=0,38); в стенке левого желудочка — 61±18 мкмоль/г калия и 7,7±1,7 мкмоль/г магния (r =0,92; р=0,0001; рис. 1). В скелетных мышцах у этих пациентов уровни калия были значительно выше и составили 93±20 мкмоль/г, магния — 8,6±2,1 мкмоль/г (r=0,91; р=0,0001) [6].
При ИМ уровни магния и калия в кардиомиоцитах снижаются (особенно в зоне инфаркта), а уровни кальция и натрия повышаются [7, 8].
Концентрации магния и калия были значительно увеличены в нормальных образцах сердечной мышцы из регионов с «мягкой» питьевой водой по сравнению с образцами из регионов с «жесткой» водой [9]. Напомним, что «мягкая» вода содержит малое количество ионов кальция.
Концентрации калия и магния в лимфоцитах являются прогностическими факторами у пациентов, перенесших острый ИМ (n=215): когда концентрация калия лимфоцитов повышена (но не более чем в 2 раза от нормы), высокие концентрации магния в лимфоцитах были достоверно ассоциированы с благоприятным прогнозом состояния пациента [10].
Внутривенное введение растворов солей калия и магния позволяет быстро достичь нормальных показателей этих электролитов в крови. Так, аспарагинаты калия и магния используются уже более 30 лет для поддержания электролитного баланса во время кардиохирургических вмешательств в условиях искусственного кровообращения. Раствор аспарагинатов K/Mg (450—1000 мл) позволяет достичь целевых концентраций калия и магния при введении пациентам всего лишь в течение 5—7 ч и полностью избежать формирования гипомагниемии и гипокалиемии. Измерения указали на существенное увеличение потребности пациентов в калии и магнии при проведении искусственного кровообращения — без использования аспартатов К/Mg гипомагниемия развивалась у 50% пациентов [11]. Наличие у пациентов послеоперационной гипомагниемии повышает риск развития желудочковой тахиаритмии и тромбоэмболии.
О ятрогенных дефицитах калия и магния. Диуретики широко используются в стандартной фармакотерапии артериальной гипертонии. Гипокалиемия и гипомагниемия являются типичными последствиями длительного применения терапии диуретиками (в частности, тиазидными) [12].
Низкие уровни калия в сыворотке крови связаны с риском возникновения ЖА. Например, среди пациентов, перенесших острый ИМ (n=590), гипокалиемия (K<4,0 ммоль/л) отмечена у 17%, многие из которых не использовали диуретики. Среди пациентов с гипокалиемией риск развития ЖА был повышен на 45% (P<0,01) [13].
В группе пациентов с умеренной диастолической гипертонией (n=38) начальная суточная доза гидрохлоротиазида составила 50 мг/сут и постепенно увеличивалась 4-недельными интервалами до 100, 150 и 200 мг/сут. При наращивании дозы диуретика уровни калия и магния в сыворотке крови снижались ступенеобразно. Возникновение преждевременных сокращений желудочков достоверно коррелировало с уменьшением наблюдаемых в сыворотке уровней калия (r=0,71; р=0,001) и магния (r=0,68; р=0,001) [14].
Другим нежелательным результатом приема как диуретиков, так и многих других фармацевтических препаратов является удлинение интервала QT на электрокардиограмме (ЭКГ). Удлинение интервала QT и аритмию «пируэт» вызывают антиаритмические препараты IA и III классов, антибиотики (макролиды и хинолоны), антидепрессанты (трициклические и селективные ингибиторы обратного захвата серотонина), нейролептики (галоперидол и фенотиазины), антигистаминные и противорвотные средства (ондансетрон и прохлорперазин) [15—17]. Кроме того, лекарственные взаимодействия через цитохромы Р450 (CYP450) могут приводить к повышению концентрации в плазме крови препаратов, приводящих к пролонгации QT [18]. Удлинение интервала QT также типично в период после операций под общей анестезией [19]. Прием нейролептиков, вызывающих пролонгацию интервала QT, признан фактором риска внезапной сердечно-сосудистой смерти у пациентов с шизо-френией [20].
О калийсберегающих эффектах магния. Концентрация калия и магния в сыворотке — это баланс между поступлением, выделением и распределением ионов между вне- и внутриклеточным пространством. Дефицит магния усугубляет гипокалиемию и делает ее более резистентной к лечению препаратами калия.
Гипокалиемия и гипомагниемия встречаются в клинической практике часто. Клинические проявления низкой обеспеченности калием и магнием включают как сходные симптомы (мышечная слабость, утомляемость, снижение работоспособности; бессонница, судороги, болезненные сокращения и спазмы икроножных мышц, особенно в ночное время или при физической нагрузке, депрессия), так и симптомы, характерные именно для дефицита калия (артериальная гипотония; нарушения ритма сердца; запоры; язвенно-эрозивные поражения слизистых оболочек, угревая сыпь, замедление заживления ран, сухость кожи).

Дефицит магния может не только обострять потери калия, но и усугублять негативное влияние гипокалиемии на уровне тканей и органов. В работе [21] показано, что магний осуществляет комплексную регуляцию уровней калия в плазме крови посредством активности таких белков, как АТФ-чувствительные выпрямительные калиевые каналы, Na/K-АТФазы и регулирующая их протеинкиназа SIK1, транспортер SLC12A3, WNK-киназы. Например, стимуляция ионами K+ активности Ca-АТФазы саркоплазматической сети кардиомиоцитов наблюдается только при внутриклеточных концентрациях Mg-АТФ более 2 ммоль [22].
Было показано, что внутривенное введение препаратов магния уменьшает потерю калия с мочой после проведения искусственного кровообращения при операции коронарного шунтирования [23]. Было показано благоприятное влияние внутривенного введения препаратов магния на уровни калия, кальция и натрия в сыворотке крови и в моче у пациентов с ишемической болезнью сердца (ИБС) [24].
Сочетанное использование калия и магния для коррекции гипокалиемии более эффективно, чем назначение только препаратов калия. В рандомизированном двойном слепом перекрестном исследовании пациентам с умеренной артериальной гипертонией и желудочковой экстрасистолией на фоне диуретической терапии гидрохлоротиазидом был добавлен прием препаратов калия или калия/магния в течение 8 нед. Добавление калия или калия/магния привело к достоверному подавлению эктопической активности в желудочках. Однако только сочетанное применение солей калия и магния приводило к достоверному увеличению содержания калия в сыворотке крови (р<0,01) [25].
Синергизм калия и магния в поддержании ритма сердца. Магний оказывает воздействие на ритм сердца, влияя как на сократимость миокарда, так и на его электрическую активность. Воздействие магния на сократимость миокарда связано с тем, что ион Mg2+ является: 1) неотъемлемым компонентом выпрямительных калиевых каналов, блокирующих выход ионов К+ из клетки; 2) необходимым для поддержания активности Na/K-АТФазы; 3) естественным блокатором кальциевых каналов. Все эти роли Mg2+ поддерживают стабильный мембранный потенциал кардиомиоцита, поэтому на фоне гипомагниемии происходит усиление нервно-мышечной возбудимости миокарда, отмечаются хаотичные скачки потенциала действия, что и стимулирует развитие аритмий [26]. Эти неблагоприятные изменения в активности миокарда происходят за счет нарушения токов ионов через различные калиевые и кальциевые каналы кардиомиоцитов (см. таблицу). Воздействуя на эти токи, ионы магния влияют на форму и на продолжительность потенциала действия и, следовательно, на ритм сердца.
К белкам кардиомиоцитов, активность которых зависит от калия и магния, относятся прежде всего калиевые выпрямительные каналы, характеризующиеся широким спектром воздействия на физиологию человека. Эта группа каналов называется выпрямительными, так как обеспечивают направление тока ионов калия в одном направлении — внутрь клетки. Эти выпрямительные свойства канала осуществляются за счет связывания иона магния [27], который является неотъемлемой частью структуры канала.
Выпрямительный кардиальный калиевый канал 2-го типа (KCNJ2) участвует в создании потенциала действия сигнала и регулирует возбудимость мышечных тканей и нейронов. Дефекты гена KCNJ2 приводят к синдрому удлиненного интервала QT, характеризующемуся полиморфными ЖА. Последние вызывают обмороки и даже внезапную смерть в ответ на физические упражнения или эмоциональный стресс [28, 29].
 Активность АТФ-чувствительного калиевого выпрямительного канала 8-го типа (ген KCNJ8) контролируется магнийзависимыми G-белками. Дефекты гена KCNJ8 связаны с врожденными синдромами, которые характеризуются ранней реполяризацией (на что указывает измененная форма волны J на ЭКГ), — синдром Бругада, идиопатическая фибрилляция желудочков, а также аритмии, связанные с гипотермией [30—32].
Активность АТФ-чувствительного калиевого выпрямительного канала 8-го типа (ген KCNJ8) контролируется магнийзависимыми G-белками. Дефекты гена KCNJ8 связаны с врожденными синдромами, которые характеризуются ранней реполяризацией (на что указывает измененная форма волны J на ЭКГ), — синдром Бругада, идиопатическая фибрилляция желудочков, а также аритмии, связанные с гипотермией [30—32].
Экспериментальные данные показывают, что гипомагниемия особенно аритмогенна в сочетании с гипокалиемией и с брадикардией, которые ведут к удлинению фазы плато потенциала действия и, соответственно, к удлинению интервала QT. Введение магния восстанавливает нормальный ритм работы миокарда [33]. В исследовании 52 пациентов с удлиненным интервалом QT и аритмией «пируэт» структурные пороки сердца обнаружены у 67%, нарушения электролитного баланса (гипомагниемия, гипокалиемия) у 60%, 37% пациентов получали диуретики, 29% — антиаритмические препараты. Прием препаратов калия и магния приводил к укорочению интервала QTc с 571±93 до 456±50 мс [34].
Сочетанный прием органических солей калия и магния (аспартатов, в концентрации 2,42 мг/л, соотношение К:Mg равно 27:10) существенно снижает проявления ЖА в экспериментальной модели ишемии—реперфузии сердца по сравнению с неорганическими солями. В контрольной группе использовался раствор Тироде, включающий неорганические соли (129 ммоль/л NaCl, 4 ммоль/л KCl, 0,9 ммоль/л NaH2PO4, 20 ммоль/л NaHCO3, 1,8 ммоль/л CaCl2, 0,5 ммоль/л MgSO4, 5,5 ммоль/л глюкозы). По сравнению с контролем отмечено достоверное снижение разброса значений трансмуральной реполяризации, частоты развития ЖА (Р<0,05) [35].
Терапия препаратами магния при удлиненном интервале QT. Удлинение интервала QT на ЭКГ является наиболее широко используемым маркером для оценки риска развития аритмии «пируэт». Вызываемое лекарственными препаратами уплощение зубца Т и зависимость от частоты сердечных сокращений (ЧСС) существенно осложняют измерение интервала QT. Для учета ЧСС используется «скорректированный QT» (QTc) с использованием той или иной формулы корректировки. При правильном измерении QTс >500 мс соответствует существенному повышению риска желудочковой тахикардии (ЖТ) типа «пируэт» и указывает на необходимость отмены соответствующего препарата [36].
Аномально пролонгированный интервал QTc (>500 мс), индуцируемый антиаритмическими препаратами и ассоциированный с отрицательными зубцами Т, может быть быстро нормализован посредством внутривенных вливаний сульфата магния даже в отсутствие нарушений электролитного баланса. Одним из механизмов воздействия иона Mg2+ является блокирование саркоплазматической сети, что нормализует интервал QTc [37].
Прием препаратов магния нормализует удлиненный интервал QT [38]. При парентеральном введении магния антиаритмический эффект на ЖТ вследствие пролонгированного QT был очевиден даже у пациентов без гипомагниемии [39].
Даже однократный прием магния в форме органических солей (504 мг элементарного магния) повышает внутри-клеточные концентрации магния и снижает интервал QTc у пациентов (n=63), получающих антиаритмические препараты III класса (соталол, дофелитид). Уменьшение продолжительности удлиненного интервала QTc было более выраженным в группе пациентов, принимавших соли магния, чем в группе плацебо, как через 3 ч (P=0,015), так и через 51 ч (P<0,001) [40].
Антиаритмические эффекты калия и магния. Сниженные уровни Mg2+ и К+ при экспериментальной ишемии миокарда сопровождались возникновением фибрилляции желудочков в 100% случаев [41]. Уровни Mg2+ и К+ в середине диапазона нормы или выше, наоборот, практически полностью предотвращали развитие аритмий в период реперфузии после ишемии.
Внеклеточные уровни К+ и Mg2+ влияют на внутриклеточный гомеостаз ионов Са2+ и силу сокращения миокарда. Mg2+ снижает приток Ca2+ через кальциевые каналы L-типа, облегчает забор Са2+ саркоплазматической сетью кардиомиоцитов. Эффекты внеклеточного K+ осуществляются, в частности, за счет активации Na/K-АТФазы и изменения мембранного потенциала, что воздействует на активность Na/Ca ионообменивающих каналов [42]. Эти и другие молекулярные механизмы действия ионов магния и калия указывают на фундаментальные основы клинической эффективности препаратов магния и калия в антиаритмической терапии.
Действительно, первые клинические опыты терапевтического использования сульфата магния при мерцательной аритмии, ЖТ, пароксизмальной наджелудочковой тахикардии и ЖТ были опубликованы в начале 30-х годов прошлого века [26] и с тех пор были многократно подтверждены на практике. Например, антиаритмическая терапия магнием (MgSO4 внутривенно) была оценена у 20 пациентов без ярко выраженного дефицита магния (магния в плазме более 0,7 ммоль/л), страдающих ишемической дилатационной кардиомиопатией и тяжелыми ЖА, а у 10 установлена аритмия «пируэт» (torsade de pointes). Эффективность инфузий сульфата магния (50 мг/мин, 60 мин, 2 раза в сутки, в течение 1 нед) оценивали с помощью 24-часового холтеровского мониторирования. Среднее по группе суточное число преждевременных сокращений желудочка сократилось с 13 979±8964 до 382±265 (р<0,001), а число «куплетов» — с 516±274 до 9±6 (р<0,001). У пациентов с аритмией «пируэт» введение магния через 20—30 мин после начала приступа тормозило развитие аритмии [43]. По данным рандомизированного исследования ISIS-4 (1995), не наблюдалось положительного эффекта от инфузии сульфата магния при лечении острого коронарного синдрома при ИМ.
Жизненно опасные аритмии типа «пируэт» возникают зачастую как результат применения препаратов из группы антиаритмических средств, экстрактов наперстянки, катехоламинов, препаратов преимущественно психиатрического профиля (фенотиазины, антидепрессанты, галоперидол [44], нейролептики, ингибирующие выпрямительный калиевый канал миокарда), а также макролидов, ингаляционных анестетиков [45] и др. Факторами риска развития ЖТ типа «пируэт» являются пожилой возраст, хроническая сердечная недостаточность, ИБС, дисфункция почек или печени и другие факторы, приводящие к нарушениям электролитного баланса (в частности, гипомагниемии) [46].
Ионы Mg2+ способствуют снижению K-зависимых аритмий, возникающих на стадии реоксигенации предсердий в культуре после гипоксических условий (рО2=1 мм рт.ст., без глюкозы, 10 ммоль/л). Низкие уровни К+ (<4 ммоль/л) приводили к значительному продлению периода аритмии (р=0,05). Увеличение уровней Mg2+ с 0,6 до 4,8 ммоль/л значительно ослабляло проаритмогенное действие низкой концентрации K+ и усиливало антиаритмические эффекты высокой концентрации K+ (>5 ммоль/л) [47].
У пациентов с острым ИМ (n=215) уровни калия, магния и кальция в крови претерпевали существенные изменения в течение 5 дней после ИМ. Уровни калия в сыворотке крови снижались на –0,18±0,06 ммоль/л (р<0,001), магния — на –0,08±0,01 ммоль/л (р<0,001), кальция — на –0,2±0,08 ммоль/л (р<0,001). Уровни калия в лимфоцитах увеличивались с 18±2 до 52±4 пмоль/100 клеток (р<0,001), магния — с 2,0±0,1 до 8,2±0,8 мкмоль/100 клеток (р<0,001), в то время как концентрация кальция в лимфоцитах снижалась с 2,9±0,27 до 1,4±0,25 пмоль/100 клеток (р<0,001) [48]. Таким образом, более высокие концентрации магния в лимфоцитах способствуют профилактике аритмий как при дефиците, так и при избытке калия. При этом профилактика аритмий более эффективна при нормальных уровнях калия в лимфоцитах (35—75 пмоль/100 клеток; рис. 2).
Низкие уровни магния в сыворотке крови ассоциированы с повышенным риском развития фибрилляции предсердий (ФП). В исследовании Фрамингемской когорты (n=3530, средний возраст 44 года, 52% женщин) за 20 лет наблюдений ФП была задокументирована у 228 человек. После поправок на возраст и пол заболеваемость ФП составила 9,4 случая на 1000 человек (при 95% доверительном интервале — ДИ от 6,7 до 11,9) в квартиле с самыми низкими уровнями магния в сыворотке (≤0,74 ммоль/л) и 6,3 случая на 1000 человек в квартиле с самыми высокими уровнями магния (≥0,83 ммоль/л). При этом уровни магния в сыворотке ≤0,74 ммоль/л соответствовали повышению риска развития ФП на 52% (относительный риск — ОР 1,52 при 95% ДИ от 1,00 до 2,31; р=0,05) [49].
По данным другого крупного исследования ARIC (n=14290, средний возраст 54 года, 53% женщин), дефицит магния также был ассоциирован с заболеваемостью ФП. В течение 21 года наблюдений были выявлены 1755 случаев ФП. При этом уровни магния в сыворотке были ассоциированы с более высоким риском развития ФП: по сравнению со средним квинтилем концентраций магния в сыворотке (≥0,80—0,83 ммоль/л), риск ФП у пациентов в самом низком квинтиле (≤0,78 ммоль/л) был повышен на 34% (ОР 1,34 при 95% ДИ от 1,16 до 1,54) [50].
Мета-анализ 17 рандомизированных контролируемых испытаний (n=2069) показал эффективность препаратов магния для перорального приема в профилактике послеоперационных аритмий. Прием препаратов магния достоверно снижал риск развития наджелудочковой аритмии (ОР 0,77 при 95% ДИ от 0,63 до 0,93; р=0,002) и ЖА (ОР 0,52 при 95% ДИ от 0,31 до 0,87; р<0,0001) [51].
Прием препарата органического магния способствовал улучшению состояния в группе пациентов с аритмией (n=1160). Прием пациентами магния (цитрат магния, не менее 300 мг/сут Mg2+, длительность курса не менее 6 нед) приводил к достоверному улучшению состояния у 82% пациентов. При этом более тяжелые формы аритмии проявляли более выраженный отклик на терапию [52].
Важной формой для терапии аритмий является использование сочетанных препаратов аспарагинатов калия и магния. Клиническое исследование показало антиаритмический эффект магния/калия у пациентов с ИБС с выраженной стенокардией и аритмией (n=98). В группе лечения (n=65) пациенты получали K/Mg и стандартную терапию, в контрольной группе только стандартное лечение (n=33). В группе лечения экстрасистолия уменьшилась на 87%, а в контрольной группе — только на 47% (p<0,01) [53].
Антиаритмический эффект инфузий аспарагинатов калия/магния внутривенно был установлен у пациентов с ЖА (n=21). Частота желудочковых эктопических сокращений значительно снизилась уже через 1 ч после начала лечения, максимальный эффект отмечался на 6-м и 7-м часу и продолжался до 10-го часа после начала лечения [54].
Внутривенные капельные инфузии аспарагинатов К-Mg восстанавливали синусовый ритм у 72% пациентов с послеоперационной аритмией, в то время как в контрольной группе (применение раствора Рингера) позитивный эффект отмечен только у 22% пациентов (P<0,01) [55].
Плацебо-контролируемое исследование с участием пациентов старше 50 лет с ИБС и аритмией показало, что применение аспарагинатов K/Mg в течение 3 нед характеризовалось анти-аритмическим эффектом, причем даже когда уровни калия и магния находились в пределах диапазона нормы до начала лечения [56]. Таким образом, результаты многочисленных клинических исследований показали, что сочетанное применение калия и магния в форме аспарагинатов оправдано для поддержания стабильной работы сердца.
Кардиопротекторное действие сочетанных препаратов калия и магния. В клетках гипертрофированного миокарда аспарагинаты калия и магния (препарат панангин) активировали передачу внутриклеточных сигналов через фосфоинозитидные пути, что было связано с улучшением электрической стабильности миокарда [57].
В эксперименте на крысах с гипертрофией сердца установлено положительное влияние панангина на устойчивость сердца к фибрилляции. В частности, введение панангина животным с гипертрофией левого желудочка вызвало увеличение порога фибрилляции желудочков на 17% с 99±4 до 116±6 мА (р<0,05), повысив устойчивость гипертрофированного миокарда к фибрилляции [58].
Молекулярные механизмы кардиопротекторного действия магния и калия связаны, в частности, с воздействиями этих ионов на функцию митохондрий и синтез РНК. Митохондриальные АТФ-регулируемые калиевые каналы (mitoKATP) регулируются Mg2+ и играют важную роль в кардиопротекции. Ионы магния дозозависимо подавляют вероятность открытия канала mitoKATP и, следовательно, проводимость данного канала [59].
В условиях состарившегося миокарда кардиопротекция посредством аспарагинатов K/Mg происходит по РНК-зависимому механизму. Ингибирование именно транскрипции РНК (посредством α-аманитина), а не ингибирование синтеза белка (посредством циклогексемида) значительно снижало кардиопротекторные эффекты аспарагинатов К/Mg, нарушало постишемическое функциональное восстановление (р<0,05), повышало фрагментацию ДНК (р<0,05) [60], снижало отношение общих количеств РНК/ДНК в кардиомиоцитах.
Помимо антиаритмического эффекта сочетанный прием аспарагинатов магния/калия пациентами с ИБС достоверно проявляет антиоксидантный эффект — наблюдаются более высокие уровни восстановленного глутатиона, более низкие уровни окисленного глутатиона, малонового диальдегида, и менее выраженное окисление липопротеинов низкой плотности по сравнению с контролем (р<0,01) [53]. При экспериментальном моделировании ИМ внутривенное введение раствора аспарагинатов калия/магния в период реперфузии сокращает площадь инфаркта (в соответствии с оценками окрашивания миокарда 2,3,5-трифенилтетразолин хлоридом) [61].
При проведении нагрузочных фармакологических проб показана эффективность панангина у пациентов молодого возраста с миокардиодистрофией [62]. Обследовали 43 пациентов, мужчин в возрасте от 18 до 22 лет, средний возраст 19,6±0,3 года. Все пациенты истощены, страдали гипотрофией, связанной с недостатком питания (индекс массы тела не превышал 22 кг/м2). При электрокардиографии у всех пациентов было выявлено нарушение процессов реполяризации миокарда — снижение амплитуды зубца Т в большинстве отведений, синдром Тv6<Tv1, отрицательные зубцы Т в отведениях III и aVF. Пациенты 1-й группы получали в качестве нагрузочной фармакологической пробы однократно 5 г хлорида калия. Пациентам 2-й группы в качестве нагрузочной фармакологической пробы давали панангин в количестве 5 таблеток. Результаты электрокардиографического исследования в обеих группах пациентов после проведения нагрузочных фармакологических проб оказались положительными. В результате приема панангина наблюдался прирост амплитуды зубцов Т в грудных отведениях (p<0,01).
При приеме панангина у пациентов наблюдалось достоверное увеличение средней нагрузки при проведении парной велоэргометрии (165±5 Вт, прирост 139±5%, p<0,05). Таким образом, даже однократный прием панангина достоверно повышает пороговую мощность и увеличивает толерантность к физической нагрузке. Это связано с улучшением процессов реполяризации в миокарде.
Изучение клинической эффективности панангина у детей с синдромом дисплазии соединительной ткани сердца (n=45; 4—17 лет) показало, что после курса лечения отмечалось достоверное снижение частоты клинических проявлений нейровегетативных нарушений (р<0,05) [63].
Влияние органических солей калия и магния на обмен мочевой кислоты. Аспарагинаты калия и магния характеризуются высокой биодоступностью (более 30%) и низкой токсичностью (LD50 более 400 мг/кг). Аспарагинат-анион является компонентом метаболома человека, перерабатывается в известных метаболических путях (метаболизма аминокислот, цикле мочевины, цикле трикарбоновых кислот и др.) и не только не нагружает выводящие системы, но и интенсифицирует процесс обезвреживания продуктов азотистого обмена в почках.
Преимущество использования магния и калия в виде аспарагинатов заключается в том, что эти соли способствуют интенсификации процессов образования мочевины в миокарде из токсичного аммония, что снижает гипераммониемию и, следовательно, степень повреждения миокарда при ишемии. Избыток аммония стимулирует повышение уровней мочевой кислоты и других продуктов азотистого обмена, которые не только поддерживают хроническое воспаление, но и стимулируют развитие аритмий. Обследование пациентов с гипертрофией миокарда (n=588) показало, что повышенные уровни мочевой кислоты в крови были ассоциированы с повышенной сердечно-сосудистой смертностью (ОР 3,10 при 95% ДИ от 1,37 до 7,04; р=0,007), хронической сердечной недостаточностью (ОР 3,46 при 95% ДИ от 1,86 до 6,45; р<0,001) и аритмиями (ОР 9,19 при 95% ДИ от 2,40 до 35,25; р=0,001) [64]. Обследование когорты пациентов (n=1557) показало, что повышенные уровни мочевой кислоты в сыворотке крови были ассоциированы с тахиаритмией и с нарушениями ЭКГ, указывающими на гипертрофию желудочков [65].
Препарат панангин включает аспарагинаты калия и магния. Аспарагинаты калия и магния характеризуются высокой биодоступностью (30—35%) по сравнению с неорганическими формами (2—8%) [66] и, следовательно, быстрее и надежнее обеспечивают развитие соответствующих физиологических эффектов. Совместно с ионами магния и калия аспарагинат-анион способствует кардиопротекции и профилактике аритмий. Препараты панангин и панангин форте могут использоваться не только для поддержания стабильной работы сердца, кардиопротекции и профилактики аритмий, но и в лечении сердечной недостаточности [67], ИМ в острый период [68], при отравлении гликозидами [69].
Препарат панангин выпускается в таблетках и в ампулах (концентрат для приготовления раствора для медленной капельной инфузии, 20 капель/мин). Внутривенное введение панангина осуществляется строго по предписанию врача в условиях стационара. Препарат панангин в таблетках отличается безопасными дозировками калия и магния (панангин — 11,67 мг элементного магния, 22,05 мг элементного калия в 1 таблетке, панангин форте — 26,33 мг элементного магния, 39,07 мг элементного калия в 1 таблетке). Вследствие безопасных дозировок курсы терапии препаратами панангин и панангин форте внутрь должны составлять от 1 до 3 мес и при необходимости могут продлеваться.
Заключение
Синергизм между калием и магнием обусловлен, во-первых, общими причинами дефицита (низкое содержание в рационе, снижение функции почек, ятрогенные причины) и, во-вторых, регуляторными свойствами магния при воздействии на калийсвязывающие белки. Магний и калий проявляют особо выраженный синергизм в поддержании ритма сердца (в частности, в профилактике синдрома удлиненного интервала QT) и в кардиопротекции (в частности, за счет антиоксидантного эффекта). Органические соли магния и калия обладают более высокой биодоступностью. Кроме того, аспарагинаты способствуют кардиопротекции за счет снижения гипераммониемии, что актуально для людей с высоким потреблением белковой пищи, пожилых лиц, пациентов со сниженной детоксикационной функцией печени и почек.



