ВВЕДЕНИЕ
Первичный гиперпаратиреоз (ПГПТ) – одно из наиболее распространенных эндокринных заболеваний наряду с сахарным диабетом (СД), ожирением и патологией щитовидной железы. Оно обусловлено опухолевым поражением околощитовидных желез, характеризуется нарушением минерального обмена вследствие повреждения костей и почек с последующим вовлечением в патологический процесс других органов и систем организма [1]. Результаты зарубежных и отечественных исследований демонстрируют достаточно высокую частоту СД 2-го типа, ожирения, дислипидемии и других факторов сердечно-сосудистого риска у пациентов с ПГПТ [2–4].
Вопрос о том, являются ли метаболические нарушения сопутствующей патологией или осложнениями ПГПТ, остается открытым. С одной стороны, опухоли околощитовидных желез чаще выявляются у постменопаузальных женщин и мужчин старше 50 лет, когда формируются возраст-ассоциированные обменные нарушения. С другой стороны, в экспериментальных работах получены данные о потенциальном влиянии гиперкальциемии и гиперпаратиреоза на развитие инсулинорезистентности и изменение секреции инсулина [5–9]. Изучение особенностей нарушений углеводного обмена при ПГПТ позволит разработать оптимальные подходы к диагностике и комплексному лечению пациентов с данной патологией околощитовидных желез.
Цель исследования – определить частоту и описать клиническое течение нарушений углеводного обмена у пациентов с ПГПТ.
МАТЕРИАЛ И МЕТОДЫ
Проведено одноцентровое ретроспективное исследование пациентов с ПГПТ.
Критерии включения в исследование: возраст старше 18 лет, подтвержденный диагноз ПГПТ.
Критерии исключения: отсутствие ремиссии ПГПТ или рецидив после паратиреоидэктомии в анамнезе, беременность, лактация.
Способ формирования выборки – сплошной.
Диагноз ПГПТ и форма заболевания устанавливались в соответствии с российскими клиническими рекомендациями 2020 г. [10]. Соответствие участников критериям исключения определялось на основании анамнеза и результатов ранее проведенного обследования.
На автоматическом анализаторе ARCHITECH с8000 (Abbott, CША) у исследуемых пациентов определялись следующие биохимические показатели сыворотки крови: кальций общий (референсный интервал (РИ) 2,15–2,55 ммоль/л), альбумин (РИ 34–48 г/л для женщин, 35–50 г/л для мужчин), фосфор (РИ 0,74–1,52 ммоль/л), креатинин (РИ 50–98 мкмоль/л для женщин, 63–110 мкмоль/л для мужчин), глюкоза (РИ натощак 3,1–6,1 ммоль/л). Уровни интактного ПТГ крови (РИ 15–65 пг/ мл), маркеров костного обмена остеокальцина (РИ 15–46 нг/мл) и С-концевого телопептида коллагена 1-го типа (РИ 0,3–1,1 нг/ мл для женщин, 0,1–0,85 нг/мл для мужчин) исследовались на анализаторе Cobas 6000 (Roche, Германия), 25-гидроксивитамин D – на анализаторе Liaison XL (DiaSorin, Италия) методом иммуноферментного анализа. Измерение оптической плотности проводилось на счетчике 1420 Multilabel Counter VICTOR2 (Perkin Elmer). Гликированный гемоглобин (HbA1с, РИ 4−6%) определялся методом высокоэффективной жидкостной хроматографии на анализаторе D10 (BioRad, США).
Альбумин-скорректированный кальций крови (ммоль/л) рассчитывался по формуле: уровень общего кальция сыворотки (ммоль/л) + 0,02 × (40 − уровень альбумина, г/л). Скорость клубочковой фильтрации (СКФ) измерялась по формуле CKD-EPI 2009. Пероральный глюкозотолерантный тест выполнялся согласно клиническим рекомендациям по диагностике СД: определение уровня глюкозы сыворотки натощак и через 120 мин после перорального приема 82,5 г моногидрата глюкозы, растворенного в 250 мл воды [11].
Индекс массы тела (ИМТ, кг/м2) определялся по формуле масса тела натощак (кг)/ рост2 (м2) с дальнейшей стратификацией в соответствии с предложенной Всемирной организации здравоохранения (ВОЗ) классификацией.
Статистический анализ данных выполнялся с помощью пакета прикладных программ STATISTICA v. 13.3 (TIBCO Software Inc., США). Количественные переменные представлены медианами и первым и третьим квартилями в формате Ме [Q1; Q3], отдельные показатели – минимальным и максимальными значениями в виде min; max. Качественные показатели приведены в виде абсолютных (n) и относительных (%) частот. Доверительные интервалы (ДИ) для частот рассчитывались методом Клоппера–Пирсона. Сравнительный анализ показателей двух исследуемых групп проводился с помощью критерия Манна–Уитни (U-тест). Корреляционный анализ параметров осуществлялся с помощью метода Спирмена. Уровень значимости (p) при проверке статистических гипотез принимался равным 0,05. Для коррекции проблемы множественных сравнений применялась поправка Бонферрони.
Исследование было одобрено Локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол от 31.01.2018 №1).
РЕЗУЛЬТАТЫ
Исследование проведено на основании данных историй болезни 367 пациентов с ПГПТ. Медиана возраста в общей группе составила 59 лет [52; 66], гендерное соотношение (мужчины : женщины) – 1:11, медиана продолжительности основного заболевания – 1 год [1; 3]. У 10 пациентов установлен синдром множественной эндокринной неоплазии 1-го типа (МЭН-1) на основании соответствия клиническим и/или генетическим критериям диагноза.
Характеристика параметров минерального и углеводного обмена в исследуемой когорте пациентов представлена в таблице 1.

Большинство пациентов имели симптомную форму заболевания, бессимптомное течение (отсутствие классических осложнений со стороны костной ткани, почек и желудочно-кишечного тракта) наблюдалось у 12% человек. Снижение СКФ менее 60 мл/мин/1,73 м2 отмечалось в 12% случаев.
В исследуемой группе нормальную массу тела, согласно критериям ВОЗ, имели только 27% (95% ДИ: 22,5–32), в то время как суммарно на избыточную массу тела и ожирение пришелся 71% случаев. Распределение исследованной группы пациентов по значениям ИМТ представлено на рисунке 1.
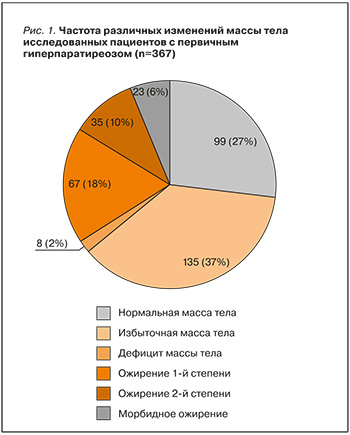
Общая частота предиабетических нарушений углеводного обмена составила 4,9% (95% ДИ: 3–8): на долю нарушенной гликемии натощак (НГН) пришлось 1,9% (95% ДИ: 0,8–4), нарушенной толерантности к глюкозе (НТГ) – 3,0% (95% ДИ: 1,5–5). СД 2-го типа был диагностирован у 45 пациентов (12%; 95% ДИ: 9–16) до выявления ПГПТ. Случаев впервые выявленного СД не было.
Для определения особенностей клинического течения ПГПТ у лиц с нарушениями углеводного обмена мы проанализировали пациентов, которые не получали препараты, оказывающие влияние на минеральный обмен (n=307): гидрохлоротиазид, цинакальцет, деносумаб, бисфосфонаты. На основании наличия различных нарушений углеводного обмена (НГН/ НТГ/ СД 2-го типа) были выделены две подгруппы: подгруппа 1 – пациенты без нарушений углеводного обмена (n=252); подгруппа 2 – пациенты с нарушениями углеводного обмена (n=55). Результаты сравнительного анализа показателей минерального обмена в подгруппах приведены в таблице 2.
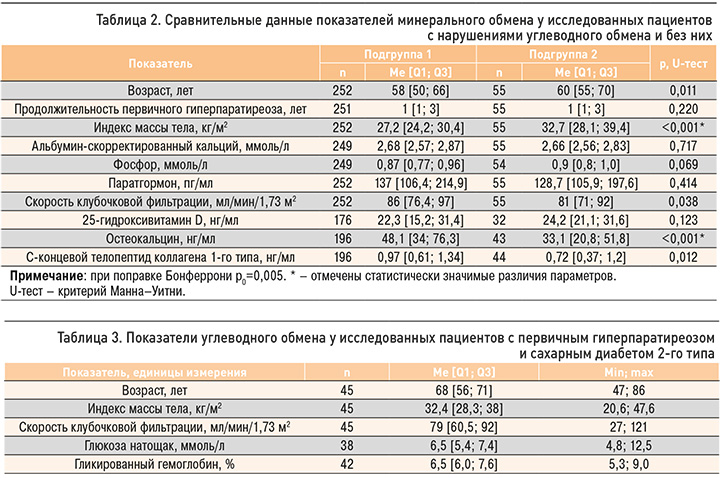
У пациентов с нарушениями углеводного обмена наблюдались статистически значимо больший ИМТ и более низкие значения остеокальцина (для всех параметров р <0,001). Различия между подгруппами по возрасту, СКФ и концентрации С-концевого телопептида коллагена 1-го типа соответствовали статистическим тенденциям.
Среди пациентов с СД 36 человек (80%) получали различную сахароснижающую терапию. Спектр используемых препаратов для контроля гликемии представлен на рисунке 2.
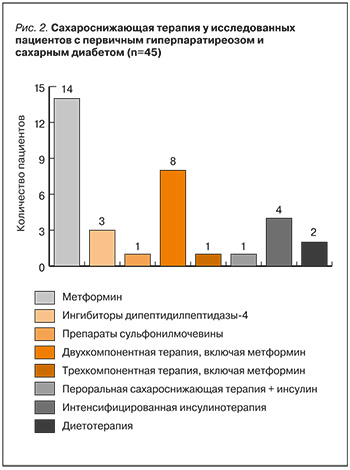
Двухкомпонентная сахароснижающая терапия включала метформин в комбинации с ингибитором дипептидилпептидазы-4 (иДПП-4) у 3 участников исследования, метформин с агонистом рецептора глюкагоноподобного пептида-1 – у 1 человека, метформин с ингибитором натрий-глюкозного котранспортера-2 (иНГЛТ-2) – у 2 пациентов, как и метформин в сочетании с препаратом сульфонилмочевины. Всего один больной ПГПТ и СД принимал трехкомпонентную таблетированную сахаро-снижающую терапию в виде сочетания метформина с препаратом сульфонилмочевины и иНГЛТ-2. На инсулинотерапии находились 5 человек. Основные показатели углеводного обмена у пациентов с ПГПТ и СД отражены в таблице 3.
Среди поздних осложнений СД диабетическая нефропатия была диагностирована у 12 из 33 обследованных пациентов (36,4%). По результатам офтальмологического осмотра 13 больных признаки диабетической ретинопатии отмечены у двух человек (15,4%), симптомы диабетической дистальной нейропатии – у 13 из 21 обследованных (61,9%) на момент исследования пациентов с ПГПТ и СД.
В рамках поиска взаимосвязей между показателями минерального и углеводного обмена у больных ПГПТ был дополнительно проведен корреляционный анализ по методу Спирмена (при поправке Бонферрони р0=0,003). По результатам анализа общей группы обследованных пациентов отмечено, что уровень гликемии натощак ассоциировался с показателями костного обмена: с концентрацией остеокальцина (r1=-0,243, p1 <0,001) и С-концевого телопептида коллагена 1-го типа (r2=-0,255, p2 <0,001). Показатель гликированного гемоглобина имел тенденцию к отрицательной корреляции с остеокальцином (r1=-0,328, p1=0,009) и С-концевым телопептидом коллагена 1-го типа (r2=-0,259, p2=0,040). Помимо этого, показатели углеводного обмена ожидаемо зависели от фильтрационной функции почек: значение расчетной СКФ имело тенденцию к отрицательной корреляции с гликемией натощак и умеренной корреляции с уровнем гликированного гемоглобина (r1=-0,142, p1=0,008 и r2=-0,253, p2=0,024 соответственно).
ОБСУЖДЕНИЕ
По результатам нашего исследования, частота предиабетических нарушений углеводного обмена в исследуемой общей когорте пациентов с ПГПТ составила 4,9% (95% ДИ: 3–8), что не превышает общепопуляционные показатели в России. Согласно результатам исследования NATION, в 2016 г. в нашей стране среди людей 20–79 лет у 19,3% участников (95% ДИ: 18,8–19,7) был выявлен предиабет [12]. Однако, по нашим результатам, СД 2-го типа у больных ПГПТ встречается чаще, чем в общей российской популяции (5,4%; 95% ДИ: 5,1–5,7), достигая 12% (95% ДИ: 9–16) [12]. Таким образом, в целом наши результаты подтверждают данные отечественных и зарубежных исследований по более высокой распространенности нарушений углеводного обмена среди пациентов с опухолевой патологией околощитовидных желез [3, 13].
Пациентов с нарушениями углеводного обмена отличали закономерно больший ИМТ, а также более низкие значения сывороточной концентрации остеокальцина. По данным корреляционного анализа, показатели гликемии имели обратную взаимосвязь с маркерами костного обмена и ожидаемо с СКФ, несмотря на отсутствие прямых взаимосвязей с основными параметрами минерального обмена (ПТГ, альбумин-скорректированным кальцием, фосфором).
В отношении остеокальцина предполагается, что этот метаболит костной ткани участвует в регуляции углеводного обмена. Снижение его сывороточной концентрации ассоциировано с увеличением объема висцерального жира, НТГ и снижением секреции инсулина [14, 15]. Аналогично нашим результатам Gianotti L. et al. обнаружили у пациентов с ПГПТ отрицательную корреляцию остеокальцина с глюкозой натощак и положительную – с индексом HOMA2-S% [7].
Известно, что продуцируемый остеобластами и остеоцитами остеокальцин стимулирует секрецию адипонектина и улучшает чувствительность инсулин-зависимых тканей [14, 16].
В клетках жировой и мышечной ткани животных моделей он способствует экспрессии транспортеров глюкозы GLUT-4 [17, 18]. Кроме того, остеокальцин повышает секрецию инсулина и пролиферацию β-клеток поджелудочной железы, оказывая на них прямое действие, а также способствует уменьшению жировой массы [16]. В свою очередь, инсулин, воздействуя через специфические рецепторы на остеобластах, приводит к повышению экспрессии гена остеокальцина, синтезу белка и его превращению в метаболически активную форму посредством декарбоксилирования. Процесс декарбоксилирования, связанного с гидроксиапатитами остеокальцина, происходит при снижении рН среды на фоне резорбции костной ткани, запускаемой инсулином [19, 20]. При ПГПТ происходит интенсификация костного обмена под воздействием стойко повышенного паратгормона, а следовательно, и образование активной формы остеокальцина. Согласно нашим результатам, уровень остеокальцина у лиц с ПГПТ и нарушениями углеводного обмена ниже, что может являться причиной ухудшения показателей гликемии при его недостаточном влиянии на инсулин-зависимые ткани и развития инсулинорезистентности.
При анализе сахароснижающей терапии у больных ПГПТ основой лечения служил метформин, что соответствовало российским клиническим рекомендациям по ведению больных СД 2-го типа [21], с достижением в большинстве случаев целевых показателей гликемии и компенсации заболевания. Потребность в инсулинотерапии среди пациентов была невысокой (11%). Таким образом, принимая во внимание результаты ранее проведенных исследований, инсулинорезистентность можно рассматривать как ключевое звено в патогенезе нарушений углеводного обмена при ПГПТ [5, 13, 22]. Исходя из этого, метформин можно рассматривать как препарат выбора у таких больных при отсутствии значимых противопоказаний, в первую очередь со стороны фильтрационной функции почек. Однако требуется проведение рандомизированных клинических исследований в данной популяции.
Тяжелых поздних осложнений СД у наших пациентов не наблюдалось, однако стоит отметить что их скрининг на момент исследования являлся ограниченным, в связи с чем было рекомендовано плановое расширенное обследование.
ЗАКЛЮЧЕНИЕ
Несмотря на отсутствие четких связей показателей минерального и углеводного обмена, среди пациентов с ПГПТ СД встречается чаще, чем в общей популяции. Вероятной причиной нарушений углеводного обмена при патологии околощитовидных желез может выступать инсулинорезистентность, в развитии которой не исключается роль костного метаболита остеокальцина. Пероральная сахароснижающая терапия с использованием метформина в качестве препарата первой линии в большинстве случаев позволяет достигнуть компенсации СД при ПГПТ.



