Медицина XXI века характеризуется новыми подходами к лечению пациента. Все большее внимание уделяется профилактике и раннему началу лечения, а также индивидуальному подбору терапии каждому пациенту для достижения наилучших результатов.
В этом аспекте актуально знание молекулярно-генетических механизмов развития заболевания.
 В возникновении нарушений проводимости сердца главная роль отводится изменению нормального тока ионов через каналы кардиомиоцитов. Причиной таких изменений могут стать мутации в соматических клетках, закодированные в геноме человека. Выявление патологического генотипа у пациента позволяет врачу определить тактику лечения или профилактики заболевания. Это обусловливает интерес к исследованиям потенциальных генетических предикторов различных нарушений проводимости сердца. Ранее в работах научной школы сердечно-сосудистых заболеваний Красноярского государственного медицинского университета были освещены закономерности наследования (аутосомно-доминантный тип) первичного синдрома слабости синусного узла (СССУ) и определены его генетические маркеры — полиморфизмы гена β1-адренорецептора и гена транскрипционного фактора SP4 [1, 2]. Изучен полиморфизм I/D гена ангиотензинпревращающего фермента и проведен анализ митохондриальной ДНК у больных с первичными нарушениями проводимости сердца [3]. Доказано преобладание гомозиготного генотипа по более редкому аллелю DD гена α-2β-адренорецептора (ADRA2B) у больных с СССУ и преобладание гомозиготного генотипа II гена ADRA2B у больных с первичной фибрилляцией предсердий [4, 5].
В возникновении нарушений проводимости сердца главная роль отводится изменению нормального тока ионов через каналы кардиомиоцитов. Причиной таких изменений могут стать мутации в соматических клетках, закодированные в геноме человека. Выявление патологического генотипа у пациента позволяет врачу определить тактику лечения или профилактики заболевания. Это обусловливает интерес к исследованиям потенциальных генетических предикторов различных нарушений проводимости сердца. Ранее в работах научной школы сердечно-сосудистых заболеваний Красноярского государственного медицинского университета были освещены закономерности наследования (аутосомно-доминантный тип) первичного синдрома слабости синусного узла (СССУ) и определены его генетические маркеры — полиморфизмы гена β1-адренорецептора и гена транскрипционного фактора SP4 [1, 2]. Изучен полиморфизм I/D гена ангиотензинпревращающего фермента и проведен анализ митохондриальной ДНК у больных с первичными нарушениями проводимости сердца [3]. Доказано преобладание гомозиготного генотипа по более редкому аллелю DD гена α-2β-адренорецептора (ADRA2B) у больных с СССУ и преобладание гомозиготного генотипа II гена ADRA2B у больных с первичной фибрилляцией предсердий [4, 5].
Целью настоящего исследования являлось изучение роли полиморфного аллельного варианта гена ADRA2B в развитии первичных нарушений проводимости сердца: атриовентрикулярных блокад (АВБ), СССУ.
Материал и методы
Настоящее исследование было проспективным. Из базы данных кафедры внутренних болезней № 1 Красноярского государственного медицинского университета отобраны семьи с первичными нарушениями проводимости сердца. В исследовании участвовали пробанды и их родственники I, II, III степени родства.
Всего включены 71 пациент с АВБ (35 женщин и 36 мужчин) и 92 пациента с СССУ (61 женщина и 31 мужчина).
 Всем пробандам и их родственникам проведены клинико-инструментальное кардиологическое обследование (клинический осмотр, электрокардиография, эхокардиография, велоэргометрия, холтеровское мониторирование, чреспищеводная стимуляция предсердий), а также молекулярно-генетическое исследование полиморфизма I/D гена ADRA2B. Генотипирование I/D полиморфизма гена ADRA2B осуществляли с помощью полимеразной цепной реакции в лаборатории медицинской генетики ФГБУ «НИИ терапии» СО РАМН Новосибирска.
Всем пробандам и их родственникам проведены клинико-инструментальное кардиологическое обследование (клинический осмотр, электрокардиография, эхокардиография, велоэргометрия, холтеровское мониторирование, чреспищеводная стимуляция предсердий), а также молекулярно-генетическое исследование полиморфизма I/D гена ADRA2B. Генотипирование I/D полиморфизма гена ADRA2B осуществляли с помощью полимеразной цепной реакции в лаборатории медицинской генетики ФГБУ «НИИ терапии» СО РАМН Новосибирска.
Группа контроля представлена популяционной выборкой из 657 человек, жителей Новосибирска, обследованных в рамках программы Всемирной организации здравоохранения «MONICA».
Статистическую обработку данных выполняли с использованием пакета прикладных программ «Excel», «Statistica » и «SPSS 13». Качественные критерии представлены в виде процентных долей со стандартной ошибкой доли. Для определения статистической значимости различий между качественными признаками применяли критерий χ2. Если ожидаемые частоты были менее 5, то использовали точный критерий Фишера. Различия в распределении частот аллелей и генотипов изучаемых генов между группами оценивали посредством критерия χ2. Если объем выборки не превышал 5 случаев, применяли критерий Фишера. Относительный риск заболевания по конкретному аллелю или генотипу вычисляли как отношение шансов (ОШ). Для оценки ассоциации между определенными генотипами и риском развития заболевания оценивалось ОШ по стандартной формуле ОШ = (a×d)/(b×c), где a — частота аллеля (генотипа) в выборке больных, b — частота аллеля (генотипа) в контрольной группе, c — сумма частот остальных аллелей (генотипов) в выборке больных, d — сумма частот остальных аллелей (генотипов) в контрольной выборке. OШ указано с 95% доверительным интервалом (ДИ). Критический уровень значимости (p) при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Результаты
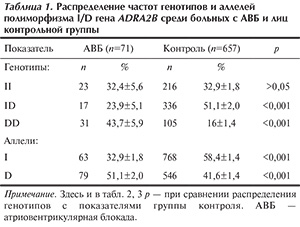
Распределение частот генотипов и аллелей I/D полиморфизма гена ADRA2B среди больных с АВБ и лиц контрольной группы представлено в табл. 1.
 Частоты генотипов полиморфизма I/D гена ADRA2B в популяции Новосибирска находились в равновесии Харди—Вайнберга. Частоты генотипов и аллелей, изученных геномных локусов в контрольной популяционной выборке соответствуют данным по другим европеоидным популяциям.
Частоты генотипов полиморфизма I/D гена ADRA2B в популяции Новосибирска находились в равновесии Харди—Вайнберга. Частоты генотипов и аллелей, изученных геномных локусов в контрольной популяционной выборке соответствуют данным по другим европеоидным популяциям.
По результатам исследования, частота носителей гомозиготного генотипа по редкому аллелю (DD) среди больных с АВБ (43,7±5,9%) была выше, чем в контрольной выборке (16±1,4%; р<0,001). Отмечена также явная тенденция к снижению частоты носителей гетерозиготного генотипа ID среди больных с АВБ (23,9±5,1%) по сравнению с группой контроля (51,1±2%; р<0,001).
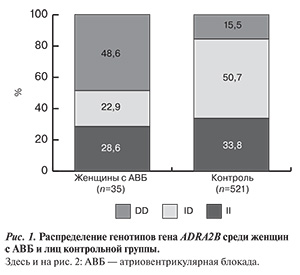
Результаты анализа распределения генотипов гена ADRA2B у женщин с АВБ представлены на рис. 1.
По результатам исследования, частота носителей гомозиготного генотипа по редкому аллелю (DD) у женщин с АВБ (48,6±8,4%) была выше, чем в контрольной выборке (15,5±1,6%; р<0,001), что соответствует распределению в общей выборке. Аналогична тенденция к снижению частоты носителей гетерозиготного генотипа ID у женщин с АВБ (22,9±7,1%) по сравнению с группой контроля (50,7±2,2%; р<0,001).
Частота носителей аллеля I гена ADRA2B у женщин с АВБ составляла 40±5,9% (28 случаев), у лиц контрольной группы — 59,1±1,5% (616 случаев). Частоты распространения носителей аллеля D гена ADRA2B в этой группе обследуемых распределялись следующим образом: больные с АВБ — 60±5,9% (n=42) и контрольная группа — 40,9±1,5% (n=426; р<0,05).
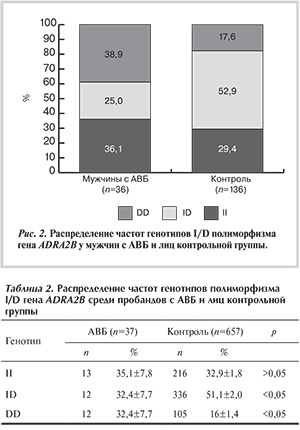
Распределение генотипов гена ADRA2B также проанализировано у мужчин с АВБ (рис. 2). По результатам исследования, частота носителей гомозиготного генотипа по редкому аллелю (DD) среди мужчин с АВБ (38,9±8,1%) была выше, чем в контрольной группе (17,6±3,3%; р<0,005), что соответствует распределению в общей выборке. Аналогична тенденция к снижению носителей гетерозиготного генотипа ID среди мужчин с АВБ (25±7,2%) по сравнению с группой контроля (52,9±4,3%; р<0,005).
 Частота носителей аллеля I гена ADRA2B среди мужчин с АВБ составляла 48,6±5,9% (n=35), у лиц контрольной группы — 55,9±3% (n=152). Частоты распространения носителей аллеля D гена ADRA2B в этой группе обследуемых распределялись следующим образом: больные с АВБ — 51,4±5,9% (n=37), контрольная группа — 44,1±3% (n=120); ОШ 1,357 (при 95% ДИ от 0,626 до 2,941; р>0,05).
Частота носителей аллеля I гена ADRA2B среди мужчин с АВБ составляла 48,6±5,9% (n=35), у лиц контрольной группы — 55,9±3% (n=152). Частоты распространения носителей аллеля D гена ADRA2B в этой группе обследуемых распределялись следующим образом: больные с АВБ — 51,4±5,9% (n=37), контрольная группа — 44,1±3% (n=120); ОШ 1,357 (при 95% ДИ от 0,626 до 2,941; р>0,05).
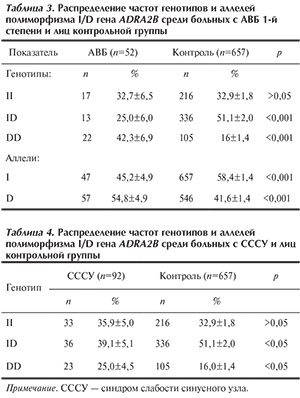
В ходе исследования проанализировано распределение генотипов гена ADRA2B среди пробандов с АВБ. Результаты представлены в табл. 2.
По результатам исследования, частота носителей гомозиготного генотипа по редкому аллелю (DD) среди пробандов с АВБ (32,4±7,7%) была выше, чем в контрольной выборке (16±1,4%; р<0,05), что соответствует распределению в общей выборке. Отмечается также снижение количества гетерозиготных носителей генотипа ID у пробандов с АВБ (32,4±7,7%) по сравнению с группой контроля (51,1±2%; р<0,05).
Частота носителей аллеля I гена ADRA2B среди пробандов с АВБ составляла 51,4±5,8% (n=38), у лиц контрольной группы — 58,4±1,4% (n=768). Частоты распространения носителей аллеля D гена ADRA2B в этой группе обследуемых распределялись следующим образом: больные с АВБ — 48,6±5,8% (n=36) и контрольная группа — 41,6±1,4% (n=546) (ОШ 1,106 при 95% ДИ от 0,552 до 2,214; р>0,05).
Кроме того, проанализировано распределение генотипов гена ADRA2B отдельно у больных с АВБ 1-й степени (n=52). Частоты генотипов и аллелей полиморфизма I/D гена ADRA2B распределились аналогично (табл. 3).
Носителей генотипа DD было достоверно больше среди больных с АВБ 1-й степени — 42,3±6,9% (n=22), чем в контрольной выборке —16±1,4% (n=105). В то же время гетерозиготные носители в общей популяции встречались в 2 раза чаще — 51,1±2% по сравнению с больными с АВБ 1-й степени — 25±6%.
Кроме того, проанализировано распределение частот генотипов и аллелей гена ADRA2B среди мужчин и женщин c СССУ, а также в группе пробандов СССУ.
По результатам исследования, частота носителей гомозиготного генотипа по редкому аллелю (DD) в группе СССУ (25±4,5%) была выше, чем в контрольной выборке (16±1,4%; р<0,05). Отмечено также снижение частоты носителей гетерозиготного генотипа ID в группе СССУ (39,1±5,1%) по сравнению с группой контроля (51,1±2%; р<0,05).
Частота носителей аллеля I гена ADRA2B у больных в группе СССУ составляла 55,4±3,7% (102 случая), у лиц контрольной группы — 58,4±1,4% (768 случаев). Частоты распространения носителей аллеля D гена ADRA2B распределялись следующим образом: больные с СССУ — 44,6±3,7% (n=82), контрольная группа — 41,6±1,4% (n=546) (ОШ 1,142 при 95% ДИ от 0,742 до 0,802; р>0,05).
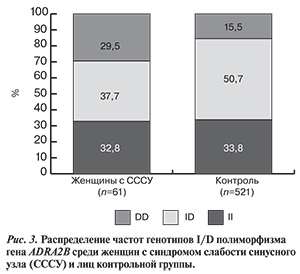
При выделении в отдельную подгруппу женщин с СССУ наблюдается статистически значимое преобладание гомозиготного генотипа по редкому аллелю DD в 29,5±5,8% случаев по сравнению с контрольной группой — 15,5±1,6% случаев (ОШ 1,317 при 95% ДИ от 0,908 до 1,91; р>0,05) (рис. 3).
Среди мужчин с СССУ распределение генотипов гена ADRA2B не отличалось от такового в группе контроля. Оценка распределения генотипов гена ADRA2B среди пробандов с СССУ также не выявила статистически значимых результатов.
Обсуждение
 Впервые описания полиморфизмов гена α-2β-адренорецептора появились в конце XX века. В 1999 г. были получены данные, указывающие на то, что полиморфизм подтипа ADRA2B может влиять на интенсивность основного обмена. В 2003 г. был выявлен полиморфизм гена ADRA2B, характеризующийся делецией аминокислотных остатков в 3-глутаминовой кислоте и приводящий к нарушению обмена веществ посредством изменения функций вегетативной нервной системы [6, 7]. Позднее было установлено, что полиморфизм гена ADRA2B в виде вставки/делеции (I/D) связан с различными сердечно-сосудистыми и метаболическими фенотипами [8]. Так, исследования показали, что полиморфизм гена ADRA2B, представленный 12Glu9, может снижать секрецию инсулина и повышать риск развития сахарного диабета 2-го типа [9]. Генотипирование китайского населения показало, что наличие аллеля D в гене ADRA2B связано с благоприятным метаболическим профилем [10]. Другие авторы в своих работах указывают, что мутации гена ADRA2B не всегда приводят к развитию метаболического синдрома, однако связаны с высоким уровнем диастолического артериального давления [11]. М. Muszkat и соавт. [12] установили, что гомозиготные варианты гена ADRA2B снижают чувствительность сосудов к агонистам ADRA2B, однако это свойство подвержено индивидуальной изменчивости. Снижение экспрессии ADRA2B усиливает зависимость артериального давления и тонуса сосудов от продукции NO [13]. Е. Kintsurashvili и соавт. [14] в исследованиях на мышах доказали, что гиперэкспрессия данного гена приводит к развитию устойчивой гипертензии. Установлена ассоциация гомозиготного аллеля полиморфизма гена ADRA2B с бессимптомной ишемией миокарда у больных сахарным диабетом 2-го типа в сочетании с ишемической болезнью сердца [15]. Делеционный вариант аллеля часто встречается у славян (31%) и связан in vivo со снижением поточно-опосредованной дилатации брахиальной артерии и снижением кровотока по коронарным сосудам [16]. Носители гомозиготного мутантного генотипа DD имеют повышенный риск нарушения функции эндотелия, объясняющий повышение риска инфаркта миокарда.
Впервые описания полиморфизмов гена α-2β-адренорецептора появились в конце XX века. В 1999 г. были получены данные, указывающие на то, что полиморфизм подтипа ADRA2B может влиять на интенсивность основного обмена. В 2003 г. был выявлен полиморфизм гена ADRA2B, характеризующийся делецией аминокислотных остатков в 3-глутаминовой кислоте и приводящий к нарушению обмена веществ посредством изменения функций вегетативной нервной системы [6, 7]. Позднее было установлено, что полиморфизм гена ADRA2B в виде вставки/делеции (I/D) связан с различными сердечно-сосудистыми и метаболическими фенотипами [8]. Так, исследования показали, что полиморфизм гена ADRA2B, представленный 12Glu9, может снижать секрецию инсулина и повышать риск развития сахарного диабета 2-го типа [9]. Генотипирование китайского населения показало, что наличие аллеля D в гене ADRA2B связано с благоприятным метаболическим профилем [10]. Другие авторы в своих работах указывают, что мутации гена ADRA2B не всегда приводят к развитию метаболического синдрома, однако связаны с высоким уровнем диастолического артериального давления [11]. М. Muszkat и соавт. [12] установили, что гомозиготные варианты гена ADRA2B снижают чувствительность сосудов к агонистам ADRA2B, однако это свойство подвержено индивидуальной изменчивости. Снижение экспрессии ADRA2B усиливает зависимость артериального давления и тонуса сосудов от продукции NO [13]. Е. Kintsurashvili и соавт. [14] в исследованиях на мышах доказали, что гиперэкспрессия данного гена приводит к развитию устойчивой гипертензии. Установлена ассоциация гомозиготного аллеля полиморфизма гена ADRA2B с бессимптомной ишемией миокарда у больных сахарным диабетом 2-го типа в сочетании с ишемической болезнью сердца [15]. Делеционный вариант аллеля часто встречается у славян (31%) и связан in vivo со снижением поточно-опосредованной дилатации брахиальной артерии и снижением кровотока по коронарным сосудам [16]. Носители гомозиготного мутантного генотипа DD имеют повышенный риск нарушения функции эндотелия, объясняющий повышение риска инфаркта миокарда.
Заключение
У больных с атриовентрикулярной блокадой и синдромом слабости синусного узла наблюдаются статистически значимое преобладание гомозиготного генотипа DD гена ADRA2B по редкому аллелю и тенденция к снижению количества гетерозиготных носителей того же гена по сравнению с популяцией. В будущем для более точной диагностики и разработки оптимальных методов профилактики и терапии будет использоваться информация об индивидуальных генетических особенностях конкретных пациентов. Именно такая персонализированная медицина, направленная на лечение конкретного больного, а не на лечение болезни, должна совершить переворот в здравоохранении и повысить его безопасность, рентабельность и, что наиболее важно, его профилактическую и клиническую эффективность.



