Ген эндотелиальной NO-синтазы (eNOS) кодирует NО-синтазу III типа — фермент, необходимый для синтеза оксида азота (NO) в клетках эндотелия. Ген eNOS расположен в длинном плече 7-й хромосомы, локус 36 и состоит из 26 экзонов. В настоящее время описаны 11 видов полиморфизма гена eNOS, наиболее изученными являются полиморфизм 4a/b 4-го интрона, полиморфизм G894T (Glu298Asp) 7-го экзона и полиморфизм Т-786С промотора гена eNOS [1—3].
Проведенные ранее исследования показали, что наличие полиморфизмов гена эндотелиальной синтазы NO в геноме человека является предиктором развития таких заболеваний, как эссенциальная артериальная гипертония (АГ), инфаркт миокарда (ИМ), фибрилляция предсердий (ФП) [4—6]. Кроме того, полиморфные аллельные варианты гена eNOS служат маркерами дисфункции эндотелия у больных ишемической болезнью сердца (ИБС) [7]. Образование эндотелиальной синтазы NO — важный компонент регуляции тонуса кровеносных и лимфатических сосудов, а также предупреждения тромбообразования. Известно, что NO угнетает пролиферацию гладких мышечных клеток, ингибирует агрегацию тромбоцитов и адгезию нейтрофилов к эндотелию сосудов [8, 9]. В то же время NO участвует в активации циклоГМФ-зависимых протеинкиназ, открывающих ионные каналы кардиомиоцитов. Циркуляция ионов через мембрану кардиомиоцита обеспечивает функции возбудимости и проводимости сердечной мышцы. Следовательно, нарушение функционирования ионных каналов кардиомиоцита, вызванное недостаточным синтезом NO, может приводить к развитию различных нарушений проводимости сердца.
В этом аспекте ген eNOS представляет интерес в качестве потенциального генетического маркера нарушений проводимости сердца.
Цель исследования: изучить роль полиморфных аллельных вариантов гена eNOS в развитии первичных нарушений проводимости сердца: атриовентрикулярной блокады (АВБ) и синдрома слабости синусного узла (СССУ).
Материал и методы
Настоящее исследование было проспективным. Из базы данных кафедры внутренних болезней №1 Красноярского государственного медицинского университета (КрасГМУ ) были отобраны семьи с первичными нарушениями проводимости сердца. В исследовании участвовали пробанды и их родственники I, II и III степени родства. Всего в исследование были включены 159 человек.
Критерии включения в исследование: любой пол, любой возраст, проживание в Красноярске, подтвержденный диагноз АВБ различной степени и/или СССУ, способность выполнять необходимые процедуры, согласие на исследование.
Критерии исключения: проживание в других регионах Российской Федерации, нежелание выполнять протокол исследования или процедуры, неуточненный диагноз АВБ различной степени и/или СССУ, моногенные формы АВБ различной степени и/или СССУ, участие пациентов в других клинических исследованиях.
Группа АВБ: 69 человек (36 мужчин и 33 женщины), из них 36 пробандов. Группа СССУ: 90 человек (33 мужчины и 57 женщин), из них 29 пробандов. Группа контроля представлена популяционной выборкой из 220 человек (136 женщин и 84 мужчины), жителей Новосибирска, обследованных в рамках программы ВОЗ «MONICA». Средний возраст лиц группы контроля составил 37,2±0,4 года.
Все участники исследования подписывали информированное согласие, утвержденное локальным этическим комитетом КрасГМУ от 22.06.2009 г.
Исследование одобрено этическим комитетом КрасГМУ.
Всем пробандам и их родственникам проведено клинико-инструментальное кардиологическое обследование: клинический осмотр, электрокардиография (ЭКГ), холтеровское мониторирование ЭКГ, эхокардиография, велоэргометрия, а также молекулярно-генетическое исследование полиморфизма 4а/4b гена eNOS. Генотипирование 4а/4b полиморфизма гена eNOS проводили с помощью полимеразной цепной реакции в лаборатории медицинской генетики ФГБУ «НИИ терапии» СО РАМН Новосибирска.
Обследование контрольной группы включало социально-демографические характеристики, измерение антропометрических данных (рост, масса тела), опрос о курении, потреблении алкоголя (частота и типичная доза), уровне физической активности, измерение артериального давления, определение липидного состава крови (уровни общего холестерина, триглицеридов, холестерина липопротеидов высокой плотности), опрос на выявление стенокардии напряжения (Rose), ЭКГ покоя в 12 отведениях с оценкой по Миннесотскому коду, атропиновый тест для исключения СССУ.
 Статистическую обработку данных выполняли с использованием пакета прикладных программ «Excel», «Statistica» и «SPSS 13». Качественные критерии представлены в виде процентных долей со стандартной ошибкой доли. Для определения статистической значимости различий между качественными признаками применяли критерий χ2. Если ожидаемые частоты были менее 5, то использовали точный критерий Фишера. Различия в распределении частот аллелей и генотипов изучаемых генов между группами оценивали посредством критерия χ2. Если объем выборки не превышал 5 случаев, применяли критерий Фишера. Относительный риск заболевания по конкретному аллелю или генотипу вычисляли как отношение шансов (ОШ). Для оценки ассоциации между определенными генотипами и риском развития заболевания оценивали ОШ по стандартной формуле ОШ=(a×d)/(b×c), где a — частота аллеля (генотипа) в выборке больных, b — частота аллеля (генотипа) в контрольной группе, c — сумма частот остальных аллелей (генотипов) в выборке больных, d — сумма частот остальных аллелей (генотипов) в контрольной выборке. OШ указано с 95% доверительным интервалом (ДИ). Критический уровень значимости (p) при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Статистическую обработку данных выполняли с использованием пакета прикладных программ «Excel», «Statistica» и «SPSS 13». Качественные критерии представлены в виде процентных долей со стандартной ошибкой доли. Для определения статистической значимости различий между качественными признаками применяли критерий χ2. Если ожидаемые частоты были менее 5, то использовали точный критерий Фишера. Различия в распределении частот аллелей и генотипов изучаемых генов между группами оценивали посредством критерия χ2. Если объем выборки не превышал 5 случаев, применяли критерий Фишера. Относительный риск заболевания по конкретному аллелю или генотипу вычисляли как отношение шансов (ОШ). Для оценки ассоциации между определенными генотипами и риском развития заболевания оценивали ОШ по стандартной формуле ОШ=(a×d)/(b×c), где a — частота аллеля (генотипа) в выборке больных, b — частота аллеля (генотипа) в контрольной группе, c — сумма частот остальных аллелей (генотипов) в выборке больных, d — сумма частот остальных аллелей (генотипов) в контрольной выборке. OШ указано с 95% доверительным интервалом (ДИ). Критический уровень значимости (p) при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Результаты
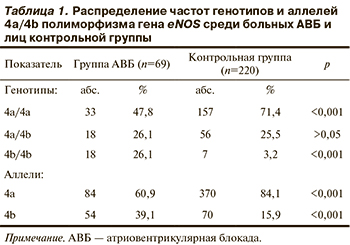
Результаты анализа 4a/4b полиморфизма гена eNOS у больных АВБ и лиц контрольной группы представлены в табл. 1.
По результатам исследования установлено, что частота носителей гомозиготного генотипа по редкому аллелю (4b/4b) среди больных АВБ была выше, чем в контрольной выборке (р<0,001). Отмечено также уменьшение числа носителей гомозиготного генотипа по распространенному аллелю (4а/4а) среди больных АВБ по сравнению с группой контроля (р<0,001). Частоты гетерозиготных генотипов (4а/4b) были примерно одинаковыми у больных АВБ (26,1%) и в группе контроля (25,5%) (OШ 0,294 при 95% ДИ от 0,192 до 0,451; р>0,05). Частота носителей аллеля 4b гена eNOS среди больных АВБ (39,1%) была достоверно выше, чем среди лиц контрольной группы (15,9%; р<0,01) (см. табл. 1).
Частоты генотипов 4a/4b полиморфизма гена eNOS в популяции Новосибирска находились в равновесии Харди—Вайнберга. Частоты генотипов и аллелей, изученных геномных локусов в контрольной популяционной выборке, соответствуют данным по другим европеоидным популяциям.
Анализ частот аллелей в изучаемых группах позволил выявить отличие частоты аллелей в выборке женщин с АВБ от таковой контрольной группы. Распределение генотипов в группе женщин с АВБ и контрольной группе представлено на рис. 1. Гомозиготный генотип по более редкому аллелю 4b гена eNOS в группе женщин с АВБ (27,3%) встречался достоверно чаще, чем в контрольной группе (4,2%). Как и в группе в целом наблюдалось уменьшение числа носителей гомозиготного генотипа по распространенному аллелю 4a: (48,5%) в отличие от контрольной группы (68,8%). Число гетерозиготных носителей гена eNOS было примерно одинаковым в основной и контрольной группах — 24,2 и 27,1% соответственно (ОШ 0,291 при 95% ДИот 0,167 до 0,507; р <0,001) (см. рис. 1).
При анализе распределения частот аллелей 4a и 4b гена eNOS в группе женщин с АВБ установлено достоверное преобладание редкого аллеля 4b (39,4%) по сравнению с группой контроля (17,7%). В то же время аллель 4а встречался значительно реже — 60,6% в группе женщин с АВБ и 82,3% в контрольной группе (ОШ 0,784 при 95% ДИ от 0,368 до 1,669; р<0,001).
Аналогичным образом проанализировано распределение частот генотипов и аллелей 4a/4b полиморфизма гена eNOS в группе мужчин с АВБ.
Гомозиготный генотип по более редкому аллелю 4b гена eNOS в группе мужчин с АВБ встречался достоверно чаще (25%), чем в группе контроля (2,4%), также наблюдалась аналогичная тенденция общей группы — уменьшение числа носителей гомозиготного генотипа по распространенному аллелю 4a (47,2%) в отличие от контрольной группы (73,4%). Количество гетерозиготных носителей гена eNOS было примерно одинаковым в основной и контрольной группах — 27,8 и 24,2% соответственно (ОШ 0,297 при 95% ДИ от 0,174 до 0,509; р <0,001) (см. рис. 2). Частота редкого аллеля 4b среди мужчин с АВБ была достоверно выше (38,9%) по сравнению с группой контроля (14,5%), а аллель 4а встречался значительно реже — 61,1 и 85,5% соответственно (ОШ 1,357 при 95% ДИот 0,626 до 2,941; р<0,001).
Анализ распределения частот генотипов и аллелей 4a/4b полиморфизма гена eNOS в подгруппе пробандов с АВБ (n=36) также показал уменьшение числа носителей генотипа 4а/4а (47,2%) по сравнению с группой контроля (71,4%) и значительное, почти в 7 раз, преобладание носителей генотипа 4b/4b — 22,2% по сравнению с группой контроля — 3,2% (ОШ 0,315 при 95% ДИ от 0,184 до 0,542; р<0,001). Суммарная частота гетерозиготного генотипа (4a/4b) и гомозиготного генотипа (4b/4b) по редкому аллелю (носители других генотипов) у пробандов с АВБ (52,8%) была выше, чем в группе контроля (28,6%)(OШ 0,359 при 95% ДИ от 0,175 до 0,735; p<0,05).
Анализ распределения частот генотипов и аллелей 4a/4b полиморфизма гена eNOS в подгруппе больных АВБ I степени (n=50) показал, что больные АВБ I степени значительно чаще имели гомозиготный генотип 4b/4b (30%) гена eNOS по сравнению с группой контроля (3,2%). Суммарная частота гетерозиготного генотипа (4a/4b) и гомозиготного генотипа (4b/4b) по редкому аллелю (носители других генотипов) у больных АВБ I степени была несколько выше (58%), чем в группе контроля (28,6%) (OШ 0,291 при 95% ДИ от 0,154 до 0,547; p<0,001).
Помимо изучения вклада гена eNOS в развитие нарушения атриовентрикулярной проводимости проанализирована роль полиморфизма 4a/4b в генезе СССУ. Распределение частот генотипов и аллелей 4a/4b полиморфизма гена eNOS среди больных СССУ по сравнению с лицами контрольной группы представлено в табл. 2.
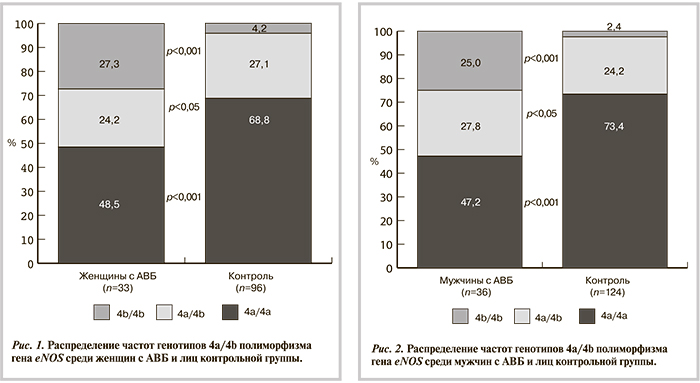
По результатам исследования установлено, что частота носителей гомозиготного генотипа по редкому аллелю (4b/4b) среди больных СССУ была выше, чем в контрольной выборке (р<0,001). Кроме того, отмечено снижение частоты носителей гомозиготного генотипа по распространенному аллелю (4а/4а) среди больных СССУ по сравнению с группой контроля (р<0,001). Частота гетерозиготного генотипа (4а/4b) у больных СССУ была выше, чем в группе контроля, но достоверно не различалась (см. табл. 2).
Суммарная частота гетерозиготного генотипа (4a/4b) и гомозиготного генотипа (4b/4b) по редкому аллелю (носители других генотипов) была в 2 раза выше у больных СССУ (61,1%), чем в группе контроля (28,6%) (OШ 0,255 при 95% ДИ от 0,255 до 0,427; p<0,001).
Больные СССУ также были разделены на подгруппы в зависимости от пола. Распределение генотипов 4a/4b полиморфизма гена eNOS среди женщин отражено на рис. 3.
В подгруппе женщин с СССУ носители редкого генотипа 4b/4b (26,3%) встречались в 6 раз чаще, чем в контрольной группе (4,2%), а также достоверно реже, чем в группе контроля, встречались носители распространенного аллеля 4а/4а (42,1 и 68,8% соответственно). Кроме того, установлено преобладание аллеля 4b среди женщин с СССУ (42,1%) по сравнению с контролем (17,7%) (OШ 0,260 при 95% ДИ от 0,166 до 0,408; p<0,001).
Аналогично проанализировано распределение частот генотипов и аллелей гена eNOS в подгруппе мужчин с СССУ (рис. 4).
В подгруппе мужчин с СССУ носители редкого генотипа 4b/4b (39,4%) встречались в 16 раз чаще, чем в контрольной группе (2,4%), а также достоверно реже встречались носители гомозиготного генотипа по распространенному аллелю 4а/4а (33,3%) по сравнению с группой контроля (73,4%) (см. рис. 4). Аллель 4b также был преобладающим среди мужчин с СССУ (53%) по сравнению с контролем (14,5%) (OШ 0,168 при 95% ДИ от 0,097 до 0,298; p<0,001).
Пробанды с СССУ были выделены в отдельную подгруппу (n=29). В подгруппе пробандов с СССУ носители редкого генотипа 4b/4b (27,6%) встречались в 8 раз чаще, чем в контрольной группе (3,2%), а также достоверно реже встречались носители распространенного генотипа 4а/4а (41,4%) по сравнению с группой контроля (71,4%). Аллель 4b также был преобладающим среди пробандов с СССУ (43,1%) по сравнению с контролем (15,9%) (OШ 0,250 при 95% ДИ от 0,140 до 0,446; p<0,001).
Суммарная частота гетерозиготного (4a/4b) и гомозиготного (4b/4b) генотипов по редкому аллелю (носители других генотипов) у пробандов с СССУ была выше (58,6%), чем в группе контроля (28,6%) (OШ 0,283 при 95% ДИ от 0,128 до 0,627; p<0,001).
Обсуждение
В европейской популяции аллель 4b гена еNOS встречается значительно чаще, чем аллель с 4а повторами. Распределение частот аллелей в популяции составляет соответственно 4b/4b — 0,41, 4b/4a — 0,46 и 4а/4a — 0,13. У австралийских европеоидов и японцев, гомозиготных по аллелю еNOS 4а, уровень нитратов и нитритов в крови, напрямую связанный со скоростью выработки NO эндотелием сосудов, достоверно выше, чем у лиц с генотипом 4b/4b.
Это свидетельствует о потенциальной роли генотипа 4a/4a как фактора риска развития заболеваний, сопровождающихся нарушением нормальной выработки NO [10]. Установлено, что полиморфизм Glu298/Asp гена eNOS является маркером дисфункции эндотелия у больных ИБС. Снижение выработки NO приводит к изменению сосудистой стенки, что может инициировать атерогенез и атеро-тромбоз [7, 11]. Нарушение регуляции сосудистого тонуса, вызванное мутацией гена eNOS, связано с риском развития эссенциальной АГ. При этом установлено, что полиморфизмы G894T и 4b/a имеют значение в развитии АГ у азиатов, а полиморфизм Т-786C — у европеоидов [5, 12, 13].
Кроме того, в ряде исследований показано, что патологические генотипы eNOS играют роль в развитии таких заболеваний, как ИМ, ФП, сахарный диабет 1-го типа, открытоугольная глаукома [4, 6, 14, 15].
Группой украинских ученых обследованы дети с брадиаритмиями. Выявлены достоверные различия по полиморфизму Т786С промотора гена еNOS. Частота патологического аллеля С среди детей составила 34,5% у гетерозигот и 15,8% у гомозигот по сравнению с 45,8 и 7,14% в контрольной группе. При этом число патологических гомозигот в группе детей с аритмиями в 2,2 раза превышало таковое в контрольной группе [16].
Заключение
Результаты проведенного исследования показывают, что в группе больных с атриовентрикулярными блокадами (как среди мужчин, так и среди женщин) имеется статистически значимое преобладание гомозиготного генотипа по более редкому аллелю 4b/4b и снижение частоты носителей распространенного аллеля 4a/4a гена еNOS. Кроме того, отмечено значимое преобладание носителей более редкого аллеля 4b гена еNOS в группе больных с атриовентрикулярными блокадами.
Аналогичная тенденция наблюдается среди больных с синдромом слабости синусного узла: преобладание носителей редкого генотипа 4b/4b и аллеля 4b во всех группах обследуемых по сравнению с контрольной группой.



