Этиологические факторы нарушений проводимости сердца разнообразны и могут быть сведены практически к любым заболеваниям сердечно-сосудистой системы. В то же время в последние два десятилетия внимание исследователей привлекают и генетически детерминированные (первичные) нарушения проводимости сердца, связанные с некоторыми передающимися по наследству аномалиями в строении проводящей системы сердца. Так, R.E. DeForest (1956) изучал семью, в которой неполная блокада левой ножки пучка Гиса (БЛНПГ) развилась у 4 членов семьи в 2 поколениях [1]. H.N. Segall (1961) описал семью, в которой у отца, сына и дочери были выявлены признаки БЛНПГ, предсердные аритмии и желудочковая экстрасистолия на электрокардиограмме (ЭКГ) и повторяющиеся приступы Морганьи—Адамса—Стокса (МАС). Отец умер в 74 года, спустя 14 лет после первого синкопального эпизода. У 2 его братьев на ЭКГ были выявлены признаки синдрома Вольфа—Паркинсона—Уайта без влияния на состояние сердечно-сосудистой системы [2].
J.M. Combrink и соавт. (1962) описали южноафриканскую семью, в которой мать страдала блокадой правой ножки пучка Гиса (БПНПГ) и умерла в возрасте 35 лет при первом эпизоде МАС. Из ее
4 детей у 3 также имелась БПНПГ. Оба родителя матери умерли в возрасте 30 лет, ранее не предъявляя никаких жалоб. У одного из ее братьев было нарушение проводимости сердца (неизвестное),
у другого — декстракардия, остальные родственники были здоровы [3]. Дальнейшая генеалогия этой семьи была описана D.P. Myburgh и соавт. (1980). У одного из 7 внуков наблюдалась БПНПГ [4].
A. Lorber и соавт. (1988) наблюдали отца и 2 сыновей с электрокардиографическими признаками блокады задней ветви левой ножки пучка Гиса (ЛНПГ) и неполной БЛНПГ, которая привела к отклонению оси сердца вправо [5].
G.S. Husson и соавт. (1973) сообщили о семье, в которой девочка c выявленной в 2 года полной атриовентрикулярной блокадой (АВБ) сердца умерла в 10 лет от фибрилляции желудочков. У брата в возрасте 15 лет развилась полная БПНПГ и полная АВБ в 17 лет. У 17-летней сестры имелись удлиненный интервал QT и БПНПГ [6].
J.J. Schott и соавт. (1999) во французской семье с болезнью Лева—Ленегра выявили локус на 19-й хромосоме, отвечающий за развитие дефектов проводимости сердца. Учитывая потенциальную роль потока натрия в проводимости сердечного импульса, эти же авторы проанализировали ген SCN5A и идентифицировали мутацию (600163.0009) у членов этой французской семьи [7].
В голландской семье с врожденным дефектом проводимости J.J. Schott и соавт. (1999) идентифицировали делецию в гене SCN5A (600163.0010). Авторы предположили, что в зависимости от вида мутации в натриевом канале генотип может быть как гомозиготным доминантным, так и гетерозиготным [7].
М. Gambetta и соавт. (1973) описали семью, в которой у 8 человек в 4 поколениях имелся удлиненный интервал PR. Патология передавалась по мужской линии через 2 поколения [8].
J.P. Fauchier и соавт. (1979) описали 4 братьев с различием в возрасте в 20 лет с синоатриальной блокадой, АВБ и пароксизмальными предсердными тахикардиями. Нарушения прогрессировали с увеличением возраста. У 2 младших братьев на ЭКГ выявлялась неполная БЛНПГ. Авторы назвали данное нарушение проводимости сердца «семейный идиопатический бинодальный блок» и выявили аутосомно-доминантный путь наследования. Они также предположили наличие различных степеней неспецифического фиброза в клетках синусного узла и ткани предсердия [9].
М. Barak и соавт. (1987) описали плод на 35-й неделе беременности, имевший АВБ II степени. Этот дефект проводимости сердца был диагностирован с помощью ультрасонографии. У 7 членов этой семьи имелась дисфункция синусного узла и/или различные степени АВБ, 3 детей в возрасте от 6 мес до 9 лет были здоровыми. Симптоматика имелась у 2 взрослых членов семьи. Одному был имплантирован кардиостимулятор вследствие развившейся полной АВБ и эпизода МАС, другой имел в анамнезе несколько приступов МАС.
Ген ADRA2B имеет функциональный делеционный полиморфизм Ins>Del Codon 299. Исследование с участием 380 здоровых японцев позволило выявить, что полиморфизм I/D гена ADRA2B является достаточно распространенным в данной этнической группе [11]. Распространенность редкого аллеля составляет 35%. Частота сердечных сокращений у гомозигот DD была значительно ниже, чем у других генотипов. Поэтому представляет интерес выяснение распространенности этого аллеля у больных с нарушениями проводимости сердца и их родственников по сравнению с контрольной группой.
Целью исследования явилось изучение распространенности аллелей гена ADRA2B у больных с наследственными нарушениями проводимости и их родственников по сравнению с контрольной группой.
Материал и методы
Из базы данных кафедры терапии №1 Красноярского государственного медицинского университета им.
проф. В.Ф. Войно-Ясенецкого были отобраны семьи с идиопатическими нарушениями проводимости сердца: 99 пробандов с различными нарушениями внутрижелудочковой проводимости и 102 их родственника I, II и III степени родства, 55 пробандов с АВБ различных степеней и 50 их родственников I, II и III степени родства. Средний возраст пробандов с блокадами ножек пучка Гиса (БНПГ) составил 54,3 года, их родственников — 38,2 года. Средний возраст пробандов с АВБ составил
52,2 года, их родственников — 36,3 года. Всем пробандам и их родственникам I, II, III степени родства было проведено клинико-инструментальное исследование: клинический осмотр, ЭКГ, холтеровское мониторирование (ХМ) ЭКГ, велоэргометрия, эхокардиография.
Молекулярно-генетическое исследование больных с нарушениями сердечной проводимости и их родственников I, II и III степени родства проводили в лаборатории молекулярно-генетических исследований терапевтических заболеваний НИИ терапии СО РАМН (Новосибирск).
Для определения полиморфизма гена ADRA2B были взяты образцы крови у 796 человек, из которых 154 — больные с блокадами сердца, 152 их здоровых родственника I, II, III степени родства и 490 лиц контрольной группы.
Группу контроля подбирали по полу и возрасту из популяционной выборки жителей Новосибирска,
обследованных в рамках международного проекта ВОЗ «MONICA» (Мониторинг заболеваемости и смертности от сердечно-сосудистых заболеваний) [12]. Были отобраны 490 человек без сердечно-сосудистой патологии, средний возраст которых составил 60 лет. Исключение блокад сердца и другой сердечно-сосудистой патологии в рамках проекта MONICA проводилось стандартными эпидемиологическими и дополнительными методами выявления сердечно-сосудистых заболеваний и факторов риска: измерение артериального давления, антропометрия (рост, масса тела), социально-демографические характеристики, опрос о курении, употреблении алкоголя (частота и типичная доза), уровне физической активности, оценка липидного состава крови (общий холестерин, триглицериды и холестерин липопротеидов высокой плотности), опрос для выявления стенокардии напряжения (Rose), ЭКГ покоя в 12 отведениях с оценкой по Миннесотскому коду. Обследуемые
основной и контрольной группы были европеоиды.
Пробанды с блокадами сердца и их больные родственники были объединены в одну группу, так как
исследовалась выборка семей с наследственно обусловленными блокадами сердца. Нам представляется
это целесообразным, так как у этих родственников был подтвержден диагноз первичных, наследственно обусловленных нарушений проводимости сердца, т. е. все признаки патологии (по данным ретроспективных ЭКГ, ХМ ЭКГ) проявлялись у них до возникновения какой-либо вторичной сердечно-сосудистой патологии (ишемическая болезнь сердца, гипертоническая болезнь), которая могла быть причиной нарушений проводимости. Выборка этих больных наблюдалась с 1990 г., когда на ретроспективных ЭКГ или ХМ ЭКГ были выявлены признаки заболевания и при тщательном кардиологическом обследовании не выявлено сопутствующей сердечно-сосудистой патологии,
которая бы могла обусловить нарушение проведения импульса в сердце.
ДНК из крови выделяли методом фенолхлороформной экстракции [13, 14]. Генотипирование полиморфизма I/D гена ADRA2B проводили с помощью полимеразной цепной реакции (ПЦР). Структура праймеров: прямой — 5’-AGGGT-GTTTG-TGGGG-CATCT-CC-3’, обратный — 5’-CAAGC-TGAGG-CCGGA-GACAC-TG-3’. Смесь для ПЦР объемом 12,5 мкл включала Трис-HCl (pH 9,0) 75 мM, (NH4)2SO4 20 мM, Тween-20 0,01%, каждого праймера по 0,4 мкM, по 0,24 мМ раствора каждого из четырех dNTP, MgCl2 2,5 мM, 0,6 единиц Тag полимеразы; 0,5 мкг ДНК. Амплификацию проводили в следующем температурном режиме: 95 °С/1 мин, 68 °С/1 мин, 72 °С/1 мин — 10 циклов, 95 °С/30 с, 68 °С/30 с, 72 °С/30 с — 20 циклов. Наличие продукта ПЦР идентифицировали методом гель-электрофореза в 4% полиакриламидном геле с последующей окраской бромистым этидием. Длина продукта составляла 112 п.н. для инсерционного аллеля и 103 п.н. для делеционного. Таким образом, при генотипе II детектировался только
продукт размером 112 п.н., при генотипе DD — размером 103 п.н., при генотипе ID — оба указанных продукта. Статистическую обработку данных проводили с использованием пакета программ Statistica 7.0. Первым этапом определяли частоты (распространенность) аллелей и генотипов изучаемых генов-кандидатов.
Соответствие распределения аллелей и генотипов равновесию Харди—Вайнберга, сравнительный анализ частот генотипов перечисленных генов с контрольной группой выполняли с использованием критерия χ2 и двустороннего критерия Фишера. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Согласно данным, представленным в таблице, гомозиготный генотип II гена α2В-адренорецептора у больных с внутрижелудочковыми нарушениями проводимости сердца встречается достоверно чаще, чем в контрольной группе. В то же время у больных с АВБ (т. е. вариант блока импульса на более высоком уровне проводящей системы сердца) встречался гомозиготный мутантный генотип DD. Это, несомненно, подтверждает нашу гипотезу, что наличие полиморфизма гена α2В-адренорецептора является предиктором возникновения различных нарушений проводимости сердца на разных уровнях проводящей системы сердца.
При объединении больных с блокадами сердца (АВБ и БНПГ) в одну группу и сравнении с контрольной группой значимых различий не выявлено (рис. 1). Объединение больных с различными нарушениями проводимости сердца в одну группу обусловлено тем, что проводящая система сердца в эмбриональном периоде формируется из одного мезенхимального листка, поэтому нами предполагались изменения на всех уровнях проводящей системы сердца. Однако наша гипотеза не подтвердилась, поэтому было решено разделить обследуемых больных в зависимости от уровня нарушения проводимости сердца. В данном случае больные, имеющие поражение на уровне атриовентрикулярного узла (атриовентрикулярные блокады I и II степеней), и больные с поражением
ножек пучка Гиса (БПНПГ, БЛНПГ).
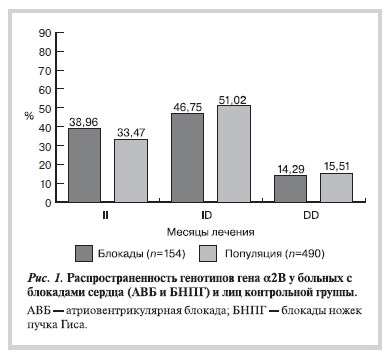
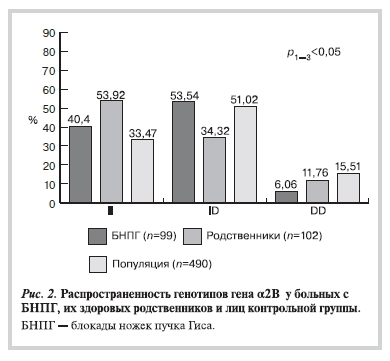
При разделении больных с блокадами сердца в зависимости от уровня поражения на 2 группы (рис. 2)
выявлено значимое преобладание гомозиготного генотипа по аллелю II у больных с БНПГ (40,4%) по сравнению c лицами контрольной группы (33,37%). Согласно полученным данным, носительство генотипа II гена α2В-адренорецептора у больных с различными внутрижелудочковыми нарушениями проводимости является генетическим фактором риска возникновения данных нарушений проведения импульса на уровне желудочков.
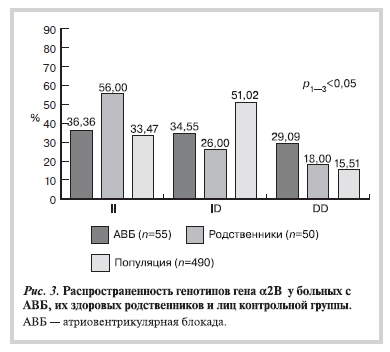
В группе больных с АВБ (рис. 3) выявлено статистически значимое преобладание гомозиготного генотипа по более редкому аллелю DD гена α2B-адренорецептора (29,09%) по сравнению c лицами контрольной группы (15,51%). Таким образом, больные с выявленным мутантным генотипом
DD гена α2В-адренорецептора имеют более высокий риск возникновения АВБ различных степеней.
Таблица. Распространенность генотипов гена α2В-адренорецепторов у больных с АВБ, БНПГ и лиц контрольной группы.
Однако делеционный вариант аллеля часто встречается у славян (31%) и связан in vivo со снижением
поточно-опосредованной дилатации брахиальной артерии и снижением кровотока по коронарным сосудам.Установлено, что носители гомозиготного мутантногогенотипа DD имеют повышенный риск нарушенияфункции эндотелия, объясняющий повышение риска развития инфаркта миокарда. Хотя остается неясным, как влияет гетерозиготный полиморфизм I/D на функцию эндотелия: прямо или опосредованно (через нарушение симпатической активации) [15]. По данным М.А. Школьниковой (2011), прогрессирующее поражение проводящей системы сердца наследуется по аутосомно-доминантному типу и имеет ассоциацию с геном натриевого канала сердца [16].
Таким образом, гомозиготный генотип по аллелю II гена α2B у больных с БНПГ и гомозиготный генотип
по более редкому аллелю DD у больных с АВБ могут быть использованы для выявления предрасположенности к наследственно-обусловленным нарушениям проводимости сердца. Выявленные генетические маркеры нарушений проводимости сердца на различных уровнях проводящей системы сердца могут быть использованы для ранней диагностики заболеваний в семьях больных, отягощенных по этой патологии. Отобранные больные с генетическими факторами риска должны распределяться во вторую группу диспансерного учета и находиться под наблюдением кардиолога с проведением 2 раза в год осмотра, ЭКГ и ХМ ЭКГ. При ведении таких больных, имеющих фактор риска развития патологии проводящей системы сердца и носительство полиморфизма гена α2В-адренорецептора, должны осуществляться принципы персонифицированной медицины, т. е. противопоказанием является назначение препаратов, ухудшающих нарушение проведения импульса в сердце, таких как β-адреноблокаторы, антагонисты кальция группы верапамила и дилтиазема, ингибиторы каналов If.



