В последнее время привлекает внимание поиск генетических маркеров заболеваний, ассоциированных с внезапной сердечной смертью (ВСС). Точечные мутации генов калиевых, натриевых и кальциевых ионных каналов приводят к изменениям электрофизиологических свойств миокардиоцитов проводящей системы сердца и характеризуются чрезвычайно высоким риском ВСС. Однако частота таких семейных форм нарушений ритма мала и может служить объяснением только небольшой части случаев ВСС. Одним из возможных путей решения этой проблемы становится изучение механизмов регуляции экспрессии генов, определяющих функционирование проводящей системы сердца. На животной модели показано, что для дифференцировки и специализации миокардиоцитов проводящей системы необходима экспрессия транскрипционного фактора HF1B. К первому месяцу жизни у мышей с «выключенным» геном обнаруживаются нарушения распределения коннексинов 40, 43, снижение артериальной васкуляризации миокарда [1]. При частичном снижении экспрессии гена структурные аномалии сердца не определяются, но сохраняется высокая частота ВСС за счет развития фатальных желудочковых аритмий и нарушений атриовентрикулярной проводимости [2]. Этот эффект также объясняется и тем, что в отсутствие фактора HF1B в эмбриональном периоде возникает дефицит рецептора нейротропина trcC, определяющего специализацию миокардиоцитов атриовентрикулярного соединения [3].
Патогенетическим звеном нарушения внутриклеточной проводимости является снижение количества или изменение структуры белков коннексинов — специализированных мембранных структур, осуществляющих прямую связь с соседними клетками. В геноме человека идентифицировано 20 видов коннексинов, в миокарде предсердий преобладающим является коннексин 40 (Cx40) [4]. Таким образом, многообразие коннексинов придает специфические свойства межклеточным контактам для контроля потока молекулярной информации и определяет свойства проводящей системы сердца в норме и в патологии. У мышей с дефицитом гена Сx40 наблюдается замедление межпредсердного проведения, увеличивается риск развития предсердных аритмий и дисфункции синусового узла [5]. У человека мутации в области промотора гена Cx40 (-44G->A), снижающие его активность, приводят к аномальному распределению gap-каналов, и, как следствие, к электрофизиологической гетерогенности. Этот эффект наблюдается у лиц с пароксизмами фибрилляции предсердий на фоне функционирования дополнительных путей проводящей системы, где миокард предсердий более уязвим к возникновению микро-re-entry [6].
Целью настоящей работы явилось исследование полиморфизма генов, кодирующих белки, которые определяют структурное и функциональное состояние проводящей системы, и изучение связи с различными нарушениями ритма.
Материал и методы
Настоящее исследование было проспективным. Из базы данных кафедры терапии №1 Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого были отобраны 29 семей, имеющих первичный, наследственный синдром слабости синусового узла (СССУ). Среди пробандов было 20 женщин и 9 мужчин, средний возраст составил 58±0,2 года. Среди родственников I, II и III степени родства было 65 мужчин и 68 женщин (средний возраст 39±0,1 года).
Всем пробандам и их родственникам I, II, III степени родства было проведено клинико-инструментальное исследование: клинический осмотр, электрокардиография (ЭКГ), велоэргометрия, холтеровское мониторирование ЭКГ, атропиновая проба, электрофизиологическое исследование (чреспищеводная стимуляция левого предсердия до и после медикаментозной вегетативной блокады), эхокардиоскопия, кардиоритмография.
Молекулярно-генетическое исследование у больных с СССУ и их родственников I, II и III степени родства проводили в лаборатории медицинской генетики ГУ НИИ терапии СО РАМН Новосибирска.
Для определения полиморфизма гена Cx40 были взяты образцы крови у 312 человек, из которых 71 — больные с диагнозом СССУ, 44 — их здоровые родственники I, II, III степени родства и 197 — контрольная группа.
Экстракцию ДНК из крови осуществляли методом фенолхлороформной экстракции [7, 8].
Для определения ОНП маркера гена Сx40, локализованного в промоторе (замена G на A в позиции -44), выполняли аллель-специфическую полимеразную цепную реакцию (ПЦР) по методике M. Firouzi [6].
Для определения ОНП -44G>A гена Cx40 использовали следующие праймеры 5´-CCCTCTTTTTAATCGTATCTGTGGC-3´ (прямой) и 5´-GGTGGAGGGAAGAAGACTTTTAG-3´ (обратный). После ПЦР продукт длиной 150 нуклеотидных пар обрабатывали рестриктазой HaeIII. При наличии аллеля G продукт разрезали на фрагменты 126 и 24 нуклеотидных пары [9].
Статистическую обработку данных проводили с использованием пакета программ Statistica 7.0. Первым этапом определяли частоты аллелей и генотипов изучаемых генов-кандидатов. Соответствие распределения аллелей и генотипов равновесию Харди—Вайнберга и сравнительный анализ частот генотипов перечисленных генов с контрольной группой проводили при помощи критерия χ2 и точного критерия Фишера.
Результаты и обсуждение
По полиморфизму 44G>A гена Cx40 были прогенотипированы 71 больной с СССУ, 44 их здоровых родственника I, II и III степени родства и 197 лиц контрольной группы.
По результатам аллель-специфической ПЦР выявлены 3 вида генотипов ADRA2B у больных с СССУ, их здоровых родственников и лиц контрольной группы: II — гомозиготный дикий, ID — гетерозиготный, DD — гомозиготный мутантный.
Выявлено (см. рисунок, см. таблицу) достоверное преобладание гетерозиготного генотипа 44G>A у больных с СССУ (45,07±5,9%) по сравнению c лицами контрольной группы (29,44±3,2%).
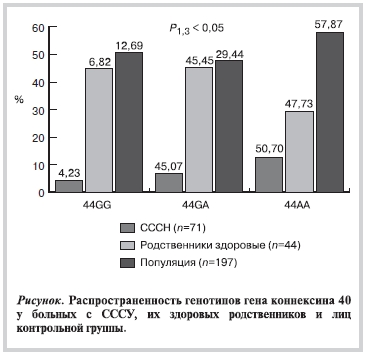
Таблица. Распространенность генотипов гена Cx40 у больных с СССУ, их здоровых родственников и лиц контрольной группы
Примечание. СССУ — синдром слабости синусового узла.
Согласно результатам M. Firouzi [6] была выявлена ассоциация гомозиготного полиморфизма с возникновением микро-re-entry в предсердиях как первичного электрофизиологического дефекта. Предположено, что при мутантном гомозиготном генотипе активность промотора гена снижается в 2 раза. Это отражается на количестве белка, особенно если учесть короткие сроки жизни коннексина 40 (приблизительно 2 ч). При гетерозиготном генотипе активность промотора гена носит усредненный характер. Возникающая анизотропия вследствие неравномерности распределения межклеточных щелевых контактов предрасполагает к появлению зон с однонаправленным блокированием импульса, гетерогенной рефрактерностью клеток и отсутствию зон с восстановленной возбудимостью в пределах миокарда предсердий. По-видимому, у обладателей гетерозиготного генотипа срабатывает фактор «усреднения» электрофизиологических параметров миокардиоцитов, определяя относительно благоприятный прогноз не только в плане развития микро-re-entry, но и других аритмий. Так, в популяции Нидерландов распространенность гетерозогот составляет 31%, а гомозигот по мутантному аллелю — 6% [10].
В других работах по изучению полиморфизма -44G->A продемонстрировано, что в сочетании с мутациями в гене SCN5A, кодирующем натриевые ионные каналы, носительство редкого гомозиготного генотипа предрасполагает к угнетению функции автоматизма в миокардиоцитах предсердий, «остановке предсердий» [11]. У больных с CCCУ, в основе которого лежит снижение автоматизма, по-видимому снижено «нейтрализующее» действие мутантного аллеля. Повышение концентрации катехоламинов и ионов Ca при интактной проводимости щелевых контактов способно поддерживать аномальную автоматическую активность миокардиоцитов предсердий.



