Одной из наиболее принятых гипотез развития острого коронарного синдрома (ОКС) является концепция нестабильности атеросклеротической бляшки (АСБ) [1, 2]. Показано, что процесс дестабилизации АСБ представляет собой классическую воспалительную реакцию, в которой участвуют эндотелиальные клетки, макрофаги, Т-лимфоциты, нейтрофилы и гладкие мышечные клетки (ГМК) [3]. Повышенный уровень воспалительных маркеров в крови может отражать активное воспаление, развивающееся в нестабильной АСБ.
C‑реактивный белок (СРБ) является неспецифическим маркером воспалительных процессов в организме. В сыворотке здоровых людей СРБ обнаруживается в следовых количествах. Любой воспалительный стимул вызывает значительное увеличение концентрации СРБ, причем степень повышения зависит от интенсивности воспаления [4]. По данным многих исследований, повышенный уровень СРБ в крови у здоровых лиц является фактором риска развития ишемической болезни сердца (ИБС) и острого инфаркта миокарда (ИМ), ишемического инсульта, перемежающейся хромоты, а у больных сердечно‑сосудистыми заболеваниями — неблагоприятным прогностическим признаком [5, 6].
Результаты недавно проведенных исследований показали, что индивидуальные вариации уровней СРБ в плазме крови в значительной степени генетически обусловлены. В гене CRP обнаружено множество полиморфных участков, аллельные варианты которых связаны как с уровнем СРБ в плазме крови, так и с риском развития сердечно‑сосудистых заболеваний, в частности ИБС и ОКС [7]. Наиболее исследуемыми являются однонуклеотидные биаллельные полиморфизмы G(-717)A, C(-286)T,
T (-757 C и триаллельный полиморфизм (-390)С/T/A в промоторной области гена CRP [8], а также C1444T в 3’-нетранслируемой области [9]. Повышение уровня СРБ в плазме крови наблюдалось, в частности, для аллеля T1444, для аллелей (‑390)Т и (‑390) А [9, 10, 11]. Эти данные позволили предположить, что ассоциация вариантов гена CRP с риском развития ИБС и ОКС у здоровых, равно как с неблагоприятным прогнозом у больных ИБС, обусловлены функциональной ролью полиморфных вариантов, влияющих на уровень СРБ в норме и при воспалении.
Известно, что частоты конкретных аллелей изучаемых генетических маркеров могут существенно раз‑
личаться в разных популяциях [12]. Можно считать доказанным, что предрасположенность к тем или иным полигенным заболеваниям, к числу которых относится большинство сердечно‑сосудистых заболеваний, возникает в разных этнических группах на разном генетическом фоне, сформировавшемся в процессе эволюции. В связи с этим возникает необходимость отдельного
исследования значимости факторов генетической предрасположенности к заболеванию, ранее обнаруженных у тех или иных народностей, для любого другого этноса. Целью нашего исследования был анализ влияния аллельного полиморфизма C1444T гена CRP в русской этнической группе на риск развития и прогноз ИМ, а также на уровень СРБ и связь последнего с течением ИМ и дальнейшим прогнозом.
Материал и методы
Клиническая характеристика больных. В исследование включены 232 русских больных ИМ (52,3±10,3 года), из них 175 мужчин (50,1±10,6 года) и 57 женщин (55,2±10,1 года). Контрольную группу составили 159 русских без сердечно-сосудистых и других тяжелых сопутствующих заболеваний в анамнезе (60,5±14 лет), из них 76 мужчин (57,3±13,9 года), 83 женщины (63,1±14 года). Среди больных ИМ у 202 диагностирован крупноочаговый ИМ (c зубцом Q — Q-ИМ), у 30 — интрамуральный ИМ (без зубца Q — неQ-ИМ).
Диагностические критерии ИМ: характерная динамика маркеров повреждения миокарда — тропонинов
Т или I, креатинфосфокиназы (КФК) и ее кардиоспецифического изофермента МВ в сочетании хотя бы
с одним из следующих критериев: 1) болевой приступ на протяжении более 20 мин; 2) изменения на электрокардиограмме (ЭКГ): а) для Q-ИМ — подъем сегмента ST в 2 соседних отведениях на уровне точки J на 0,2 мВ и более для мужчин и 0,15 мВ и более для женщин в отведениях V2—V3 и на 0,1 мВ и более в отведениях I, II, III, aVL, aVF, V4—V6; 2) образование патологического зубца Q: любой в отведениях V1—V3 и продолжительностью 0,03 с и более в отведениях I, II, III, aVL, aVF, V4—V6; б) для не Q-ИМ — горизонтальная и косонисходящая депрессия сегмента ST на 0,1 мВ и более, косовосходящая депрессия на 0,2 мВ и более, инверсия зубца Т >1 мм в отведениях I, II, III, aVL, aVF, V1—V6.
Лица контрольной группы проходили обследование, включающее сбор анамнеза, ЭКГ в 12 отведениях,
общий и биохимический анализы крови. В исследова ние включали лиц без коронарного анамнеза и перенесенного инсульта, у ближайших родственников которых в возрасте моложе 50 лет не было ИМ, стенокардии, инсульта, окклюзирующего поражения периферических или сонных артерий.
Критериями исключения для больных и лиц контрольной группы являлись тяжелые заболевания, самостоятельно влияющие на прогноз: анемия, тяжелый сахарный диабет, тиреотоксикоз, почечная недостаточность (повышение уровня креатинина крови более чем в 2 раза от существующей нормы), печеночная недостаточность (уровень аланинаминотрансферазы в крови в 3 раза больше нормы), онкологические заболевания; инфекционно‑воспалительные заболевания в период обострения; аутоиммунные заболевания; длительное лечение кортикостероидами; тяжелые хирургические
операции в течение 2 мес перед ИМ или перед включением (для контрольной группы); проведение коронарной ангиопластики или аортокоронарного шунтирования (АКШ) в течение 6 мес перед ИМ.
В блоке интенсивной терапии всем больным в первый день проводили сбор анамнеза, регистрацию ЭКГ, двухмерную эхокардиографию, рентгенографию органов грудной клетки, общий анализ крови и мочи, анализ крови на маркеры повреждения миокарда, общий холестерин, холестерин липопротеидов низкой плотности, холестерин липопротеидов высокой плотности, триглицериды и СРБ, получение крови для последующего генетического исследования. Отдельным больным по показаниям выполняли коронарографию.
Конечными точками для оценки неблагоприятного исхода считали смерть, повторный ИМ, повторную госпитализацию в связи с ИМ или нестабильной стенокардией, проведение операции АКШ или транслюминальной коронарной ангиопластики (ТБКА), декомпенсацию симптомов недостаточности кровообращения, острое нарушение мозгового кровообращения.
Концентрацию СРБ определяли иммуноферментным методом с использованием набора фирмы
Cytoimmune Sciences исходно (на момент госпитализации), на 3‑и сутки, при выписке (7–14‑й день), через месяц от начала ИМ, через 6 мес и через год. За норму принимали концентрацию СРБ ≤2,0 мг/л.
Метод генотипирования. ДНК выделяли из лимфоцитов периферической крови. В качестве консерванта добавляли раствор 0,5 М ЭДТА в количестве 250 мкл на 5 мл крови. Выделение ДНК осуществляли модифицированным методом с использованием экстракции смесью фенол-хлороформ. Геномное типирование проводили методом анализа полиморфизма длины рестрикционных фрагментов продуктов ПЦР. В каждый эксперимент включали отрицательный контроль, где ДНК‑матрицу для ПЦР заменяли водой. В качестве положительного контроля использовали образцы с ранее установленным генотипом по полиморфизму C1444T CRP, который был подтвержден секвенированием. Для анализа однонуклеотидной замены C на T в положении 1444 3’-нетранслируемой области гена CRP фрагмент ДНК длиной 325 п.н., содержащий этот участок, амплифицировали с использованием прямых аллелеспецифических праймеров: 5’-TCGTTAACTATGCTGGGAAAC-3’ (SSP C), 5’-TCGTTAACTATGCTGGGAAAT-3’ (SSP T) и общего обратного праймера 5’-TGATGAGCACTCTGGACCCAA‑3’, сконструированных с применением пакета программ Vector NTI 7,1 и Primo. Для амплификации фрагмента длиной 500 п.н., включающего полиморфный участок С1444Т и служащего внутренним положительным контролем амплификации, использовали праймер 5’-CCCACGTCTCTGTCTCTGGT-3’.
Амплификационная смесь в объеме 10 мкл содержала 70 мМ Трис‑HCl pH 9,0, 20 мМ (NH4)2SO4, 1,0 мМ
MgCl2, 0,025% Tween 20, 0,025% NP‑40, по 5 пкмоль каждого праймера, 0,2 мМ dNTP, 0,256 мкмоль 20% DMSO, 0,5 ед. Taq‑полимеразы (Sileks, Россия) и 100–250 нг ДНК. На реакционную смесь наслаивали минеральное масло. Программа амплификации для аллеля C: 1) 95 °С — 5 мин; 2) 10 циклов: 95 °С — 1 мин; 64 °С — 1 мин; 72 °С — 1 мин; 3) 20 циклов: 95 °С — 30 с; 58 °С — 50 с; 72 °С — 50 с. Программа амплификации для аллеля T: 1) 95 °С — 5 мин; 2) 10 циклов: 95 °С — 1 мин; 63 °С — 1 мин; 72 °С — 1 мин; 3) 20 циклов: 95 °С — 30 с; 56 °С — 50 с; 72 °С — 50 с. ПЦР проводили в амплификаторе МС16 (АО ДНК Технология, Россия). Наличие продуктов амплификации проверяли электрофорезом в 2% агарозном геле в присутствии бромида этидия. Анализ гелей проводили в системе видеодокументации гелей (АО ДНК Технология, Россия).
Статистический анализ. Анализ отклонения наблюдаемых частот генотипов от равновесия Харди—Вайнберга проводили с помощью алгоритма максимизации математического ожидания (expectation maximization — EM) с использованием свободно распространяемой программы Haploview 3.32. Сравнение частот аллелей, частот носительства аллелей и генотипов в сравниваемых группах проводили с помощью точного двустороннего критерия Фишера с использованием онлайн-вер‑
сии программы GraphPad Instat. Силу выявленных ассоциаций оценивали в значениях отношения шансов (OШ) и его 95% доверительного интервала (ДИ) также с использованием программы GraphPad Instat. Статистически значимым считали различие сравниваемых величин при p<0,05. Для сравнения концентраций СРБ в различных группах больных ИМ использовали непараметрический тест Манна—Уитни. Для определения прогностической значимости уровня СРБ проводили логистический регрессионный анализ, а также анализ выживания по методу Каплана—Мейера.
Таблица 1. Распределение аллелей и генотипов полиморфного участка C1444T гена CRP у больных ИМ и здоровых индивидов.
Результаты
Полиморфизм C1444T гена CRP при ИМ и в контрольной группе. Частоты аллелей и генотипов полиморфного частка C1444T гена CRP у пациентов с ИМ и здоровых лиц приведены в табл. 1. Для частот всех генотипов в выборке больных с ИМ и в контроле соблюдалось равновесие Харди—Вайнберга. Выявлено значимое различие (p=0,006; OШ=0,3 при 95% ДИ от 0,15 до 0,74) в частоте носительства аллеля C1444 (сумма генотипов C/C и C/T), которая в контрольной группе была выше.
Соответственно, в группе больных ИМ генотип T/T встречался значимо чаще, чем в контроле (p=0,006;
OШ=3,0 при 95% ДИ от 1,3 до 6,5), и может рассматриваться как фактор риска развития ИМ. При сравнении групп больных с неQ-ИМ и с Q-ИМ значимых различий по вариантам генотипа и частоте аллелей участка C1444T гена CRP не выявлено (табл. 2).
Таблица 2. Распределение аллелей и генотипов полиморфного участка C1444T гена CRP у больных ИМ без подъема и с подъемом ST (неQ-ИМ и Q-ИМ).
Таблица 3. Распределение аллелей и генотипов полиморфного участка C1444T гена CRP у больных ИМ моложе 40 лет, старше 40 лет и здоровых индивидов старше 40 лет.
Таблица 4. Концентрации СРБ в сыворотке крови больных ИМ — носителей различных генотипов CRP C1444T — в первые сутки заболевания.
Мы отдельно проанализировали распределение аллелей/генотипов участка C1444T в подгруппе больных, у которых ИМ произошел в возрасте 40 лет и моложе, и в подгруппе больных старше 40 лет (табл. 3). При этом сравнение для обеих возрастных подгрупп больных проводили с лицами контрольной группы старше 40 лет. Оказалось, что отличия по частоте носительства аллеля С и генотипа ТТ в обеих подгруппах больных от контрольной группы были идентичны наблюдаемым в общей группе больных ИМ, без разделения по возрасту (см. табл. 2).
Мы не обнаружили связи между носительством аллелей/генотипов CRP и однолетним прогнозом у больных ИМ. Анализ проводили для всех больных ИМ, отдельно для Q‑ИМ и неQ‑ИМ, а также для подгрупп больных моложе 40 и старше 40 лет. Анализ ассоциации полиморфизма C1444T с концентрацией СРБ в крови у пациентов с ИМ, измеренной при поступлении в стационар, позволил выявить значимую связь генотипа Т/Т с более высоким уровнем СРБ (табл. 4).
Исходный уровень и динамика изменения концентрации СРБ в сыворотке крови при ИМ и в контрольной группе. И в группе Q-ИМ и в группе неQ‑ИМ уровень СРБ в сыворотке крови был статистически значимо выше, чем в контроле (табл. 5). Хотя исходные значения концентрации СРБ в группе не Q-ИМ выше, чем в группе Q‑ИМ, различия между ними не достигают уровня статистической значимости.
Таблица 5. Концентрация СРБ в группе Q ИМ, неQ ИМ и в контроле.
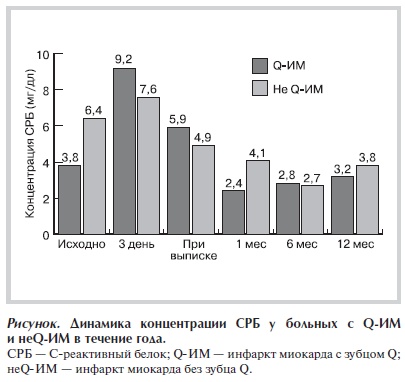
На рисунке представлена динамика изменения концентрации СРБ в сыворотке крови больных с Q-ИМ
и больных с неQ-ИМ. Наблюдалась сходная динамика в период госпитализации: на 3‑е сутки уровень
маркера был максимальным, а на момент выписки (10–14‑й день) наблюдалось значимое снижение концентрации СРБ по сравнению с исходной. К концу месяца от начала ИМ уровень СРБ почти возвращался к норме (2,4 мг/л) в группе Q‑ИМ, тогда как в группе неQ‑ИМ оставался повышенным (4,1 мг/л); различия между группами Q-ИМ и неQ-ИМ достигали статистической значимости только в этой временной точке. За период дальнейшего наблюдения (в течение года) концентрации СРБ достоверно не менялись.
Проведение первичной ТБКА в группе Q-ИМ способствовало большему снижению уровня СРБ за время
пребывания в стационаре по сравнению с таковым в группе консервативной терапии (СРБ при выписке
3,6 мг/л и 6,3 мг/л соответственно; р<0,05).
Прогностическое значение уровня СРБ зависело от формы ИМ, особенностей терапии и временно`й точки, в которой определяли уровень СРБ. Ниже описаны ситуации, когда повышение СРБ достоверно ухудшало прогноз.
У больных с Q-ИМ повышенный уровень СРБ (более 2 мг/л) через месяц от начала ИМ оказался маркером неблагоприятного прогноза (ОР 1,3; р<0,05). В группе пациентов с ST ИМ, которым не проводилось инвазивное лечение, прогностически значимыми оказались повышенные уровни СРБ на 3-е сутки (ОР 1,2; р<0,01) и особенно при выписке (ОР 1,3; р<0,0001). У больных с Q-ИМ и первичной ТБКА предиктором неблагоприятного прогноза оказался повышенный уровень СРБ через 1 мес от начала ИМ (ОР 1,2; р<0,05).
У больных с неQ-ИМ прогноз был достоверно хуже в случае повышения уровня СРБ при выписке (ОР 1,2; р<0,05) и через 1 мес (ОР 1,4; р<0,05). У пациентов этой группы, которым было проведено инвазивное лечение, предиктором неблагоприятного прогноза оказался повышенным уровень СРБ через 1 мес после ИМ (ОР 1,3; p<0,05). В группе больных с неQ-ИМ, которым проводилось консервативное лечение, уровень СРБ не был связан с прогнозом.
Обсуждение
Распределение аллелей и генотипов полиморфизма C1444T гена CRP в контрольной группе лиц русской этнической принадлежности близко к данным, полученных для других популяций европеоидов. Так, частота предрасполагающего к ИМ генотипа T/T, по нашим данным составляющая в контрольной группе русских 4,6% (см. табл. 2), колеблется в популяциях европеоидов из Северо‑Западной Европы и США от 7,3 до 4,3% [11]. Данных по анализу этого полиморфизма в русской этнической группе в литературе мы не нашли.
В нашем исследовании при сравнении групп больных ИМ и здоровых русских выявлена значимая
позитивная ассоциация ИМ с генотипом T/T полиморфного участка C1444T гена CRP. Соответственно
носителей аллеля С (С/С±С/Т) было значимо больше в контрольной группе. Кроме того, носители генотипа T/T, больные ИМ, характеризуются более высоким уровнем СРБ в плазме крови. В совокупности эти данные согласуются со сложившимся представлением о СРБ как о независимом факторе риска развития атеросклероза и его осложнений — ИМ, ишемического инсульта, перемежающейся хромоты [13]. Они позволяют рассматривать носительство генотипа T/T C1444T гена CRP как генетический маркер риска развития ИМ. Поскольку различий по частотам этого генотипа у больных с ИМ с подъемом или без подъема ST не наблюдается, можно сделать вывод, что генотип T/T является маркером риска развития обеих форм ИМ. Кроме того, не различаются по частотам носительства аллелей/генотипов участка C1444T подгруппы больных моложе 40 лет и старше 40 лет. То, что при сравнении с контролем значимые ассоциации ИМ с генотипом Т/Т и носительством С наблюдаются в обеих возрастных подгруппах, можно рассматривать как вывод о вовлечении гена CRP в развитие ИМ.
Полиморфизм C1444T располагается в 3’-нетранслируемой области гена CRP и, следовательно, не может напрямую ни изменять эффективность связывания транскрипционных факторов с промоторной частью гена, ни кодировать измененный белок. Высказывалось предположение, согласно которому функциональная роль этого полиморфизма связана с влиянием на стабильность мРНК, что приводит в случае аллеля Т к более высокому уровню СРБ в крови [11]. Подобный механизм был показан для полиморфизма в 3’-нетранслируемой области гена протромбина [14]. Однако нельзя исключить и такой возможности, что полиморфизм C1444T находится в неравновесном сцеплении с другой функционально важной областью гена CRP.
По данным литературы, генотип Т/Т (или аллель Т) также ассоциирован с более высокой концентрацией СРБ в крови у других европеоидов — здоровых и больных ИБС [9–11]. Однако такой ассоциации не было обнаружено у здоровых японцев [15]. Таким образом, наблюдаются этническая гетерогенность в функциональной значимости полиморфизма C1444T гена CRP, и результаты, полученные для русских нельзя автоматически переносить на другие популяции России.
Между тем и другие полиморфизмы CRP, такие как триаллельный полиморфизм (-390)С/T/A, G(-717)A,
изучаются с целью выявления взаимосвязи с уровнем СРБ в крови и с развитием сердечно‑сосудистых заболеваний [10, 11, 16, 17]. C.R. Balistreri и соавт. показали, что частота аллеля С полиморфизма G1059C гена CRP-достоверно выше у больных, перенесших ИМ, чем у здоровых представителей итальянской популяции [16]. В исследовании североамериканской популяции наличие аллеля С этого полиморфизма определяло более высокий уровень СРБ в крови у здоровых, но не сопровождалось увеличением частоты развития артериальных тромбозов [17]. В исследовании Third National Health and Nutrition Examination Survey наблюдали, что с концентрацией СРБ в крови связан ряд полиморфизмов гена CRP, но среди них только триаллельный полиморфизм (-390)C/T/A ассоциирован с риском развития ИБС [18]. В работе, проведенной на базе Фрамингемского исследования, изучали ассоциацию
13 полиморфизмов гена CRP с уровнем СРБ [10] и для 9 из них выявили такую взаимосвязь. Однако ассоциаций исследуемых полиморфных участков с риском развития ИБС не наблюдали [10]. Подобные результаты были получены и в других исследованиях, в частности в исследовании LURIC, NHLBI Family Heart Study, Роттердамском и др. [19, 20, 21].
Таким образом, в ряде исследований, включая наше, обнаружено влияние генотипа CRP на риск развития ИМ [11, 22, 23]. В других исследованиях подобные связи не прослеживаются. Нужны более крупные исследования на однородных популяциях, чтобы окончательно выявить роль генотипа CRP в развитии ИМ.
В мире до сих пор не прекращаются дискуссии о роли СРБ в развитии ИМ. В части работ показано, что
СРБ активно участвует в воспалительных реакциях, приводящих к дестабилизации АСБ. Предполагаемые механизмы — индукция белком дисфункции эндотелия, увеличение синтеза молекул адгезии, стимуляция образования пенистых клеток, активация системы комплемента в АСБ [24–27]. Другие исследователи оспаривают ведущую роль СРБ в развитии и прогрессировании ИБС [25,28–30]. По их мнению, СРБ — всего лишь неспецифический маркер воспаления или «пассивный свидетель». Результаты исследований, в которых обнаружена ассоциация генотипа CRP с ИМ, в том числе нашей работы, свидетельствуют в пользу представления об активной роли СРБ в развитии ИМ. Здесь важно заметить, что в последние годы для определения СРБ в научных исследованиях используются только
высокочувствительные количественные способы определения, в основном методы иммуноферментного анализа. Такими методами изучалась концентрация белков нашей работе и во всех исследованиях, с которыми мы сравниваем свои результаты.
В группе больных с Q-ИМ на момент госпитализации мы наблюдали умеренно повышенный уровень СРБ
(3,8 мг/л). Затем отмечалось почти 3‑кратное увеличение концентрации СРБ на 3‑и сутки, когда показатель достигал максимального уровня, с последующим постепенным снижением к концу пребывания больных в стационаре (7–14‑й день). Резкое повышение уровня СРБ при Q-ИМ на 3‑и сутки, по‑видимому, связано с обширной областью повреждения и некроза миокарда, приводящей к активации воспаления. Тенденция к нормализации концентрации СРБ к концу периода лечения в стационаре, скорее всего, обусловлена уменьшением воспаления в зоне некроза на фоне процессов
рубцевания. Наши результаты согласуются с данными А. Ziakas и соавт. [31] и N. Brunetti и соавт. [32], согласно которым максимальные уровни СРБ отмечались на 3‑и сутки госпитализации, а после выписки показатель снижался, достигая нормы к 6‑му месяцу наблюдения. Однако, в отличие от маркеров некроза (тропонин, КФК), очевидной связи между уровнем СРБ и объемом повреждения мы не наблюдали, т.е. повышение концентрации СРБ, вероятно, лишь частично связано с объемом повреждения. В нашем исследовании значимого влияния различий в тактике лечения и сроках коронарной реперфузии на динамику уровня СРБ у пациентов в группе Q-ИМ не наблюдалось.
Прогностическая ценность СРБ при Q-ИМ в настоящее время активно изучается и остается спорной,
не уточнены и сроки определения показателя как маркера неблагоприятного прогноза. По нашим данным, предикторная способность СРБ проявляется через 1 мес после ИМ. Возможно, уровень СРБ в это время в меньшей степени связан с размером участка некроза и по этому обладает большей прогностической ценностью. Полученные нами данные согласуются с результатами исследования К. Kinjo и соавт. [33], включавшего более 1300 больных с Q-ИМ. Авторы выявили прогностическую ценность СРБ, определенного через 25 дней после ИМ. Повышение уровня СРБ более 3,8 мг/л соот‑
ветствовало увеличению относительного риска сердечно‑сосудистой смерти в 5,27 раза. Данные В. Scirica и соавт. [34] также свидетельствуют о предикторной значимости исходного уровня СРБ при Q-ИМ.
В других исследованиях также отмечают прогностическую ценность концентрации СРБ, однако оптимальные сроки ее определения отличаются от наблюдаемых нами. По данным О. Dimitrievic и соавт. [35], повышенный уровень СРБ через 24–72 ч от начала острого ИМ указывает на 8-кратное повышение риска неблагоприятных событий в течение 12 мес наблюдения. В то же время эти авторы ставят под сомнение предикторную способность отсроченных определений СРБ. Р. Steg и соавт. также не выявили прогностическую значимость СРБ, определенного при выписке больного из стационара [36]. В это исследование были включены 515 пациентов с ОКС, из которых более 50% — с Q‑ИМ.
Количество неблагоприятных осложнений в группах с уровнем СРБ ниже и выше среднего за 1 год было одинаковым. Обращает внимание крайне высокий средний уровень СРБ при выписке — 20 мг/л, что, возможно, повлияло на результат работы.
Предикторная способность СРБ подтверждена нами не только для группы Q‑ИМ в целом, но и для пациентов с подготовленной ТБКА. Сходные результаты получены и в других исследованиях. Так, Y.J. Hong и соавт. [37] показали, что высокие уровни СРБ (более 10 мг/л) связаны с пониженной выживаемостью после первичной или подготовленной ТБКА у пациентов с ИМ. По данным Н.К. Yip и соавт. [38], даже менее существенное повышение исходного уровня СРБ (2,37 мг/л) значимо при определении 30‑дневного прогноза у больных, перенесших первичную ТБКА в первые 6 ч ИМ.
В нашем исследовании в группе неQ‑ИМ исходная концентрация СРБ оказалась выше, чем в группе
с Q‑ИМ (различия не достигали статистической значимости). Принимая во внимание отсроченную секрециюСРБ после какого‑либо стимула (тромбоз, инфекция, повреждение и др.), исходные значения этого маркера можно считать характеристикой воспалительного фона, на котором развился ИМ. Повышение концентрации СРБ при неQ‑ИМ скорее всего обусловлено зоной некроза, тяжестью и распространенностью атеросклеротических и воспалительных изменений в коронарных сосудах [39]. За время пребывания в стационаре на фонеактивной антиангинальной, антитромботической тера‑
пии, а также лечения статинами, в группе неQ-ИМ мы наблюдали снижение концентрации СРБ. Такая динамика, по‑видимому, обусловлена уменьшением воспалительных процессов в зоне АСБ на фоне лечения. В первую очередь этому, вероятно, способствует терапия статинами [40], обладающими противовоспалительными свойствами; согласно некоторым данным, вклад вносит и терапия антиагрегантами [41]. По нашим данным, инвазивное лечение способствует большему снижению
уровня СРБ в обеих группах к моменту выписки по сравнению с таковым у пациентов, которым проводилась только консервативная терапия.
Согласно полученным нами результатам, у пациентов с неблагоприятным течением заболевания были выявлены более высокие концентрации СРБ. Аналогичный результат получен Н. Koukkunen и соавт. [42], выявившими повышение количества летальных исходов в 3,5–6 раз у пациентов с нестабильной стенокардией и высокими уровнями СРБ. По нашим данным, ОР неблагоприятных исходов при повышении уровня СРБ вполне соответствует результатам крупных исследований OPUS-TIMI 16 и TACTICS‑TIMI 18 (ОР 1,25 и 1,10 соответственно) [43]. В целом выраженное повышение уровня маркеров воспаления в группе с осложненным течением неQ-ИМ в настоящее время не подвергается
сомнению.
Заключение
При сравнении групп больных инфарктом миокарда и здоровых русских выявлена значимая позитивная
ассоциация инфаркта миокарда с генотипом T/T полиморфного участка C1444T гена CRP. Есть основания считать, что концентрация С‑реактивного белка в значительной степени генетически обусловлена: носители генотипа T/T, больные инфарктом миокарда, характеризуются более высоким уровнем С-реактивного белка в плазме крови. Наши результаты свидетельствуют об активном участии С-реактивного белка в развитии различных вариантов инфаркта миокарда. Уровень С-реактивного белка существенно влияет на течение болезни и прогноз. Оптимальное время определения С-реактивного белка у больных инфарктом миокарда остается предметом дискуссии.
Работа поддержана грантом РФФИ №07-04-01715-а и Госконтрактом № 8/3‑409н‑09 «Новые методы в профилактике, диагностике и лечении атеросклероза».



