ВВЕДЕНИЕ
Ревматоидный артрит (РА) – иммуновоспалительное ревматическое заболевание (ИВРЗ), характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов, включая органы дыхания. При РА возможно развитие интерстициального заболевания легких (ИЗЛ), формирование легочных ревматоидных узелков, развитие плеврита. У пациентов с РА могут наблюдаться сопутствующие заболевания, такие как бронхиальная астма, бронхоэктатическая болезнь, хроническая обструктивная болезнь легких. Иммуносупрессивное лечение РА также порой осложняется легочными инфекциями, включая туберкулез. Возможно лекарственное поражение легких, в частности, при назначении метотрексата [1, 2].
Представляем клиническое наблюдение, демонстрирующее сложности дифференциальной диагностики поражения легких различного генеза при РА.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка Л., 68 лет, страдающая ожирением 2-й степени (индекс массы тела 36,85 кг/м2), в ноябре 2022 г. была госпитализирована в отделение терапии Медицинского научно-образовательного центра МГУ им. М.В. Ломоносова с жалобами на ноющие боли, в мелких суставах кистей, лучезапястных, коленных, плечевых суставах, максимально выраженные в ночные и утренние часы, утреннюю скованность в кистях длительностью до 30 мин, ограничение движений в суставах в течение дня, одышку при небольшой физической нагрузке, эпизодический сухой кашель, выраженную общую слабость.
В сентябре 2016 г. по данным компьютерной томографии (КТ) в легких были впервые выявлены мультифокальные двусторонние изменения. Примерно с этого же времени появились боли в суставах, выраженная утренняя скованность. С декабря 2016 г. прогрессировала дыхательная недостаточность, что потребовало госпитализации в марте 2017 г. В результате обследования был диагностирован серопозитивный РА с высокой гиперпродукцией ревматоидного фактора (РФ – 668 МЕ/мл), антител к циклическому цитруллинированному пептиду (АЦЦП – 67,2 Ед/мл) и выраженной лабораторной воспалительной активностью (С-реактивный белок – 47,3 мг/л). Антинуклеарный фактор (АНФ) – отрицательный. При КТ в легких были выявлены двусторонние множественные очаги до 4–6 мм в диаметре, вероятно, фиброзного характера, в S6 справа – перибронхиальные очаговые уплотнения до 51 × 85 × 50 мм, с участком консолидации, вероятно, воспалительного характера. Обращало на себя внимание наличие кальцификации внутригрудных и правых подмышечных, подключичных лимфоузлов. Со слов пациентки, при обследовании данных в пользу туберкулеза получено не было. Поражение легких рассматривалось в рамках ИЗЛ при РА.
Пациентке была назначена терапия глюкокортикоидами (ГК) и метотрексатом, которую она в дальнейшем регулярно не принимала. С июня 2022 г. отмечалось ухудшение состояния с усилением артралгий и вовлечением новых суставов, формированием деформации пальцев кистей по типу бутоньерки и шеи лебедя, нарастанием одышки с появлением сухого кашля. В октябре 2022 г. пациентка возобновила лечение метотрексатом в дозе 20 мг/сут.
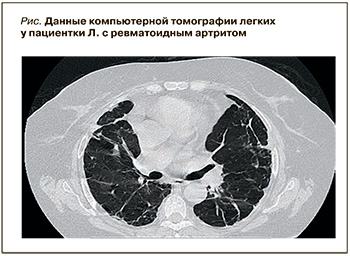
В ноябре 2022 г., как отмечалось, пациентка была госпитализирована в Медицинский научно-образовательный центр МГУ им. М.В. Ломоносова, где у нее были выявлены признаки высокой активности РА – клинические (симметричный артрит с болями воспалительного характера, DAS28 5,4, рентгенологические признаки эрозивного артрита 3-й стадии) и лабораторные (С-реактивный белок – 10 норм, РФ – 8,5 норм). Это сопровождалось тяжелым поражением легких, потребовавшим оксигенотерапии, с выраженной бронхиальной обструкцией (объем форсированного выдоха за 1-ю секунду 45%, жизненная емкость легких 52%, форсированная жизненная емкость легких 54%), аускультативной картиной крепитации по всем полям легких, КТ-признаками двусторонних изменений в легких (рис.) с паттерном неспецифической интерстициальной пневмонии (НСИП), формированием тракционных бронхоэктазов, умеренной количественной лимфаденопатией подмышечных и шейных лимфоузлов. Лечение включало бронхолитики и муколитики (будесонид, ипратропия бромид + фенотерол, амброксол), на фоне его проведения наблюдались положительная аускультативная динамика, уменьшение одышки. Вероятность «метотрексатового легкого» была отвергнута с учетом нерегулярного приема пациенткой метотрексата и назначения этого препарата на фоне уже имевшегося поражения легких. Принимая во внимание наличие кальцификации лимфоузлов, больной была выполнена туберкулиновая проба (T-spot), получен пограничный результат.
Пациентка была направлена в Центральный научно-исследовательский институт туберкулеза для обследования с целью исключения туберкулезной инфекции, где были получены отрицательные результаты пробы с туберкулезным рекомбинантным аллергеном, трехкратного исследования в мокроте кислотоустойчивых микобактерий и ДНК микобактерий туберкулеза. Таким образом, данных в пользу специфического процесса выявлено не было, кальцинаты в левом легком, подмышечных лимфоузлах и селезенке были расценены как остаточные изменения после перенесенного (вероятно, в детстве) туберкулеза. Лечение, включавшее ГК (ингаляционно, преднизолон внутримышечно 60 мг/сут в течение 10 дней, затем внутрь 5 мг/ сут), бронхолики и муколитики, сопровождалось уменьшением одышки.
При повторной госпитализации в Медицинский научно-образовательный центр МГУ им. М.В. Ломоносова в январе 2023 г. на фоне приема метилпреднизолона 4 мг/сут у пациентки наблюдалось улучшение функции внешнего дыхания (объем форсированного выдоха за 1-ю секунду 49%, жизненная емкость легких 61 %, форсированная жизненная емкость легких 61 %), КТ легких без существенной динамики. Отмечалось уменьшение артралгий в суставах кистей, коленных, голеностопных суставах (DAS28 4,9) и снижение лабораторной воспалительной активности РА (С-реактивный белок – 5,8 мг/л). Поражение легких было расценено в рамках ИЗЛ при РА. В качестве лечебной стратегии выбрана монотерапия ГК (метилпреднизолон 8 мг/сут), назначен курс фторхинолонов (офлоксацин 200 мг/сут). Продолжено наблюдение пациентки.
ОБСУЖДЕНИЕ
В представленном клиническом наблюдении у пациентки с РА можно было предполагать различные варианты поражения легких: в рамках высокой активности РА, из-за лекарственной реакции на метотрексат или вследствие инфекционных осложнений, в первую очередь туберкулеза.
К наиболее тяжелым проявлениям поражения легких при РА относятся ИЗЛ. Они могут становиться манифестным проявлением заболевания, предшествуя клиническим признакам артрита, как это и было в представленном клиническом наблюдении. Частота ИЗЛ при РА в клинической практике составляет 6–15%, а с учетом данных КТ достигает 30–70%. Выделяют несколько морфологических типов поражения легких: НСИП (как представленном случае), обычную интерстициальную пневмонию (ОИП), криптогенную организующуюся пневмонию, лимфоцитарную и десквамативную пневмонии, а также диффузные альвеолярные повреждения. Чаще всего при ИЗЛ у пациентов с РА встречаются ОИП (44–66%) и НСИП (22–44%). ИЗЛ выступают второй причиной смертности среди больных РА и требуют агрессивного лечения [1]. В настоящее время спектр терапии ИЗЛ при РА и других ИВРЗ включает как иммуносупрессанты, так и антифиброзные препараты, применяемые при прогрессирующем типе поражения. Примеры последних – нинтеданиб, эффективность которого у пациентов с РА была доказана в клинических исследованиях, и пирфенидон [3, 4].
Для поражения легких в результате применения метотрексата свойственна НСИП с симптомом матового стекла по данным КТ на ранних стадиях заболевания и базального фиброза на более поздних этапах. Значительно реже выявляют облитерирующей бронхиолит [2]. Стоит упомянуть, что метотрексат, помимо интерстициальных изменений, может приводить к развитию лимфопролиферативного заболевания с возможным вовлечением легких по типу лимфоматоидного гранулематоза [5].
В представленном наблюдении поражение легких развилось до развития артрита и начала терапии ГК и метотрексатом. Данные КТ свидетельствовали о ревматологическом генезе поражения легких (НСИП, тракционные бронхоэктазы). Через 2 мес после отмены метотрексата, который применялся нерегулярно, регрессия изменений в легких при КТ не наблюдалось, в то время как при «метотрексатовом легком» после отмены препарата рентгенологические изменения исчезают в среднем через месяц [6].
Были основания предполагать наличие у пациентки туберкулеза, который в ходе подробного обследования был исключен. Интересно, что АЦЦП, служащие специфическим маркером РА, по данным исследований могут определяться с частотой 40–60% у пациентов с туберкулезом как при легочной, так и внелегочной его форме [7, 8]. В рамках туберкулезной инфекции рассматривают болезнь Понсе, характеризующуюся реактивным неэрозивным олиго- или полиартритом с поражением суставов кистей, лучезапястных, локтевых и коленных суставов на фоне туберкулезной инфекции без присутствия микобактерий в суставах [9, 10]. Непосредственно туберкулезному артриту свойственно эрозивное деформирующее поражение тазобедренных и коленных суставов [11]. В приведенном случае наблюдался эрозивный полиартрит с преимущественным поражением метких суставов.
ЗАКЛЮЧЕНИЕ
Таким образом, у пациентов с РА поражение легких может доминировать в клинической картине и представлять существенные сложности для диагностики и лечения.



