Наличие продолжительного (более 3 мес) поражения почек с развитием или без протеинурии и/или дисфункции почек (ДП), приводящей к снижению скорости клубочковой фильтрации (СКФ), является признаком хронической болезни почек (ХБП) [1]. Чаще всего к ее развитию приводят сахарный диабет (СД) и артериальная гипертензия (АГ), реже — непосредственно первичная гломерулярная патология. ХБП ассоциируется с чрезвычайно высоким риском развития сердечно-сосудистых заболеваний (ССЗ) и в первую очередь ишемической болезни сердца (ИБС) [2]. На всех стадиях ХБП у пациентов регистрируется повышенный риск развития сердечно-сосудистых осложнений (ССО), в несколько раз превышающий вероятность терминальной стадии почечной недостаточности или диализа [3]. В связи с этим, согласно современным взглядам, пациенты с ХБП (СКФ ниже 60 мл/мин) относятся к группе лиц с очень высоким риском развития ССО [4].
Центральную роль в формировании высокого риска развития ИБС у пациентов с ХБП играют проатерогенные метаболические расстройства, ускоряющие также прогрессирование ренального континуума. Например, часто возникающая при ХБП дислипидемия способствует не только повышению вероятности тяжелых ССО, но и усугубляет ДП [5]. Признаки нарушения липидного, углеводного и пуринового обменов в их взаимосвязи нередко выявляют уже на ранних стадиях заболевания. Их выраженность существенно возрастает при снижении СКФ.
В частности, гиперурикемия — независимый фактор риска развития ССЗ, часто регистрируется у пациентов с АГ и коррелирует с тяжестью нефросклероза. Повышенный уровень гликированного гемоглобина (HbA1c) — критерий адекватности контроля гликемии у пациентов с СД, также является маркером высокого риска развития ССО и смерти в общей популяции, в том числе у лиц с ХБП недиабетического генеза [3, 6]. При этом, несмотря на тесную связь между ДП и развитием ИБС, до настоящего времени накоплено недостаточно данных, касающихся состояния коронарных артерий (КА) у пациентов с ХБП, особенно у больных с гломерулярной патологией недиабетического генеза.
В последние годы в литературе довольно широко обсуждаются результаты ряда проспективных исследований, свидетельствующих о прогностически благоприятном влиянии статинотерапии на течение ХБП и интенсивность прогрессирования кардиоренального континуума. По данным одного из них, статинотерапия, проводимая на фоне базового лечения ингибиторами ангиотензинпревращающего фермента (АПФ)/антагонистами ангиотензиновых рецепторов (сартанами), приводит к более существенному снижению уровня протеинурии и темпов прогрессирования ХБП [7].
Цель исследования: изучить состояние КА и динамику показателей липидного обмена, уровня HbA1c, мочевой кислоты и СКФ на фоне применения аторвастатина в комплексе стандартного ангиопротективного лечения больных ХБП недиабетического генеза.
Материал и методы
Обследованы 54 пациента (41 мужчина и 13 женщин, средний возраст 60,2±1,5 года). Их них 31 (57,4%) пациент с хроническим гломерулонефритом, 23 (42,6%) — с гипертензивной нефропатией.
С целью определения состояния КА и верификации диагноза ИБС пациентам с ХБП проводили коронарографию (КГ).
Функцию почек оценивали по уровню креатинина в крови и СКФ, которую определяли прямым методом по клиренсу эндогенного креатинина и расчетным методом (в мл/мин) по формуле Кокрофта—Гаулта (1976).
В зависимости от СКФ все пациенты были распределены в 2 группы: 1-я включала 31 больного со СКФ <60 мл/мин (средний возраст 60,2±2,2 года), 2-я — 23 пациента со СКФ≥60 мл/мин (средний возраст 60,2±1,9 года). В группах мужчины составляли соответственно 87,1 и 60,9%, пациенты с гипертензивной нефропатией — 25,8 и 56,5%, с хроническим гломерулонефритом — 74,2 и 43,5%.
Все обследованные пациенты получали ингибиторы АПФ или сартаны и антиагреганты. Пациентам 1-й группы дополнительно назначали аторвастатин 20 мг/сут. При госпитализации больных и через 6 мес определяли уровни артериального давления — АД (систолического — САД, диастолического — ДАД и пульсового — ПАД), общего холестерина (ОХС), холестерина (ХС) липопротеидов низкой плотности (ЛНП), ХС липопротеидов очень низкой плотности (ЛОНП), ХС липопротеидов высокой плотности (ЛВП), триглицеридов (ТГ). Состояние углеводного обмена оценивали по уровню гликемии и содержанию HbA1c методом V. Cromy и соавт. (1986). Состояние пуринового обмена оценивали по концентрации в плазме крови мочевой кислоты, определенной колориметрическим методом Мюллера—Зейферта.
Селективную КГ выполняли через феморальный или радиальный доступ диагностическим катетером 6F. Изображения были записаны во многих проекциях для левой и правой КА.
Статистическую обработку полученных данных проводили с помощью пакетов программ Excel 2007 и Statistica 6.0. Данные представлены в виде средних значений и их стандартных отклонений (M±m). Достоверность различий между группами определялась по непарному t-критерию Стьюдента или U-критерию Манна-Уитни. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Результаты недавно проведенных клинических исследований свидетельствуют о том, что прогрессирование ХБП приводит к увеличению риска возникновения ИБС [2].
В то же время данных, касающихся состояния артерий коронарного бассейна у больных ХБП гломерулярного генеза, недостаточно.
Мы провели КГ всем включенным в исследование больным ХБН. При этом у 41 (75,9%) из них выявлены существенные атеросклеротические поражения КА (стеноз более 50%). В большинстве случаев у больных 1-й и 2-й групп наблюдалось поражение передней нисходящей межжелудочковой артерии — 77,4 и 73,4%, а у каждого третьего пациента еще и правой КА – 32,3 и 34,7% соответственно. Поражение ствола левой КА достоверно чаще наблюдали у больных со СКФ<60 мл/мин: 12,9 и 4,3%. Существенные патологические изменения (стеноз более 50%) в 1, 2 и 3 КА выявлены соответственно, у 45,2, 19,4 и 12,9% пациентов 1-й группы и у 41,2, 29,4 и 5,9% — 2-й группы.
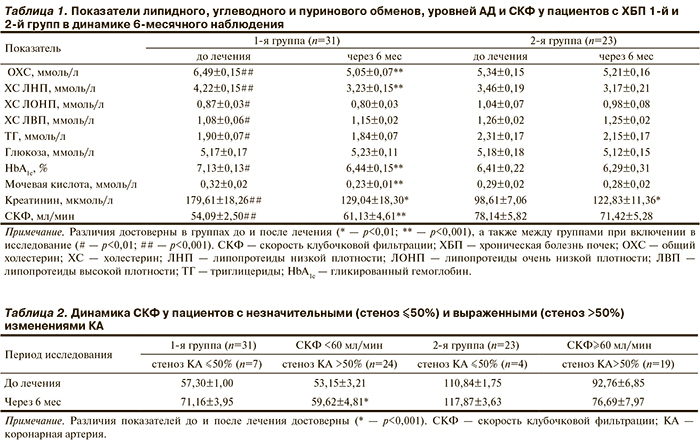
Анализ показателей липидного обмена до лечения показал, что повышение средних уровней атерогенных фракций липидов выше целевых для пациентов из группы высокого риска [4] отмечалось у всех (100%) больных ХБП обеих групп. Достоверно более высокими уровни ОХС, ХС ЛНП, ХС ЛОНП и ТГ были у лиц с изначально более низкой СКФ (<60 мл/мин), т. е. у больных 1-й группы по сравнению со 2-й группой. Через 6 мес наблюдения наблюдалось достоверное уменьшение уровня атерогенных фракций липидов у больных, получавших статинотерапию (1-я группа): ОХС — с 6,49±0,15 до 5,05±0,07 ммоль/л (p<0,001), ХС ЛНП — с 4,22±0,15 до 3,23±0,15 ммоль/л (p<0,001). У пациентов 2-й группы существенной динамики средних значений этих показателей не выявлено (табл. 1).
Прием аторвастатина приводил к некоторому снижению уровня HbA1с, среднее значение которого до лечения также было достоверно выше у пациентов со СКФ<60 мл/мин (1-я группа), несмотря на отсутствие у них СД. В динамике наблюдения в этой группе больных содержание HbA1с снизилось с 7,13±0,13 до 6,44±0,15% (p<0,001), концентрация мочевой кислоты в крови — с 0,32±0,02 до 0,23±0,01 ммоль/л (p<0,001). В то же время во 2-й группе эти показатели практически не изменились (HbA1с — с 6,41±0,22 до 6,29±0,31%, уровень мочевой кислоты — с 0,29±0,02 до 0,28±0,02 ммоль/л) (см. табл. 1).
При включении в исследование повышение АД отмечали у 31 (100%) пациента 1-й группы (САД — 162,90±4,21 мм рт.ст.; ДАД — 97,42±1,57 мм рт.ст.; ПАД — 65,48±3,20 мм рт.ст.) и у 22 (95,7%) лиц 2-й группы (САД — 162,26±3,16 мм рт.ст.; ДАД — 96,17±1,11 мм рт.ст.; ПАД — 66,09±2,51 мм рт.ст.) (см. табл. 1). После лечения, которое включало базовую терапию ингибиторами АПФ или сартанами, установлено достоверное снижение средних уровней АД у пациентов обеих групп. У больных, получавших аторвастатин, уровни САД и ПАД оказались ниже, чем у тех, кто его не принимал: в 1-й и 2-й группе соответственно САД — 128,52±1,22 и 133,00±1,14 мм рт.ст.; ПАД — 42,77±1,34 и 47,78±1,14 мм рт.ст. (p<0,01).
В 1-й группе удалось достичь дополнительного достоверного снижения САД на 5 мм рт.ст., а ПАД — на 4 мм рт.ст. (p<0,01), что согласуется с результатами мета-анализа P. Strazzullo (2007) [8].
На фоне 6-месячной терапии у пациентов 1-й группы констатировано улучшение функции почек, о чем свидетельствовало достоверное увеличение средней СКФ с 54,09±2,50 до 61,13±4,61 мл/мин (см. табл. 1). У больных, не принимавших статины, уровень СКФ, наоборот, имел тенденцию к снижению (с 78,14±5,82 до 71,42±5,28 мл/мин).
Нами изучена динамика СКФ на фоне лечения аторвастатином у больных со стенозом хотя бы одной КА, превышающим 50% (табл. 2). Следует подчеркнуть, что в начале исследования в обеих группах у пациентов с гемодинамически значимым стенозом КА по сравнению с больными без такового наблюдалась более низкая средняя СКФ. Лечение аторвастатином сопровождалось улучшением фильтрационной функции почек, о чем свидетельствовало достоверное повышение СКФ у лиц с изначально более низкими ее уровнями (1-я группа, СКФ<60 мл/мин) — с 53,15±3,21 до 59,62±4,81 мл/мин (р<0,001). В то же время у больных, которые не получали статинов (2-я группа, СКФ≥60 мл/мин), через 6 мес наблюдения отмечали тенденцию к снижению СКФ: с 92,76±6,85 до 76,69±7,97 мл/мин.
Таким образом, у больных ХБП недиабетического генеза статинотерапия не только улучшает состояние липидного обмена, но и способствует некоторому снижению уровней HbA1c и мочевой кислоты, а также улучшает контроль АД и функциональное состояние почек, особенно у лиц с гемодинамически значимыми стенозами КА.
Выводы
- Приблизительно у 75% пациентов с хронической болезнью почек недиабетического генеза при коронарографии диагностируют стенозы коронарных артерий, превышающие 50% их просвета, у остальных — стенозы менее 50%. Чаще всего гемодинамически значимые изменения сосудов регистрируются в передней нисходящей межжелудочковой артерии (77,4% в 1-й группе, 73,4% во 2-й группе).
- При хронической болезни почек наблюдается повышение средних уровней атерогенных фракций липидов, гликированного гемоглобина и мочевой кислоты. Более выраженные метаболические изменения проатерогенного характера регистрируются в группе пациентов с более низкой скоростью клубочковой фильтрации (<60 мл/мин).
- Прием аторвастатина в составе комплексной терапии хронической болезни почек недиабетического генеза позволяет существенно снижать уровни не только атерогенных фракций липидов, но и гликированного гемоглобина и мочевой кислоты. На фоне аторвастатина достигается достоверное дополнительное снижение средних уровней систолического и пульсового артериального давления по сравнению с таковыми у больных хронической болезнью почек, не получавших статины.
- Шестимесячная терапия аторвастатином в суточной дозе 20 мг способствует улучшению фильтрационной функции почек при хронической болезни почек, что особенно важно для больных с гемодинамически значимыми стенозами коронарных артерий. У больных с изначально сниженной скоростью клубочковой фильтрации последняя достоверно увеличилась на 11,5%, в то время как у больных, не получавших статины, наблюдалась тенденция к ее снижению через 6 мес наблюдения.



