Перипроцедурный инфаркт миокарда (ИМ) — наиболее частое раннее осложнение у пациентов, которым проводится чрескожное коронарное вмешательство (ЧКВ), ухудшает как краткосрочный, так и отдаленный прогноз у пациентов [1]. Помимо анатомических особенностей поражения коронарных артерий развитие перипроцедурных осложнений связано также со многими другими факторами. В ряде исследований показано значение маркеров воспаления в прогнозировании острых и отдаленных исходов у пациентов, перенесших ЧКВ. Исходный уровень C-реактивного белка (СРБ) в нескольких исследованиях оказался независимым предиктором отдаленного прогноза пациентов, которым имплантировалиcь непокрытые стенты (НПС), а также частоты развития перипроцедурных осложнений [5—7].
Воспалительная реакция, вызванная травмой сосуда в месте имплантации стента, сопровождается накоплением лейкоцитов [8]. В одной из работ исходный уровень лейкоцитов в крови до ЧКВ коррелировал с отдаленным прогнозом [9], а скорость оседания эритроцитов (СОЭ) была независимым предиктором развития коронарного атеросклероза и его осложнений [10—14]. Прогностическое значение СОЭ у больных с ЧКВ практически не изучалось.
Липопротеин-ассоциированная фосфолипаза A2 (Лп-ФЛА2) представляет собой относительно новый маркер воспаления. Степень повышения уровня Лп-ФЛА2 после имплантации НПС коррелировала с частотой развития отдаленных неблагоприятных коронарных исходов [15]. Прием статинов приводит к снижению уровня CРБ, что коррелирует с более низкой частотой развития перипроцедурных ИМ при имплантации НПС. В настоящее время появляются данные о том, что статины также снижают уровень Лп-ФЛА2 [16].
Появление стентов с лекарственным покрытием (СЛП) привело к значительному снижению частоты развития внутристентового рестеноза и потребности в проведении повторной реваскуляризации миокарда [2, 3, 17]. Локальное выделение лекарственного препарата в месте имплантации стента приводит к уменьшению выраженности воспаления и пролиферативных процессов, что уменьшает образование неоинтимы. Прогностическое значение ряда маркеров воспаления изучено в основном
у больных, которым имплантировали НПС с разной частотой назначения статинов. Прием статинов перед ЧКВ в настоящее время является общепринятой практикой. Сохраняют ли маркеры воспаления свою значимость при имплантации СЛП в случае исходного длительного приема статинов, до конца неясно.
Целью данного исследования было определение прогностического значения Лп-ФЛА2, CРБ, СОЭ,
количества лейкоцитов до ЧКВ с имплантацией СЛП у пациентов со стабильной ИБС, длительно принимающих статины. В промежуточном анализе оценивались исходы в раннем госпитальном периоде после имплантации.
Материал и методы
Пациенты. В проспективное исследование вошли пациенты со стабильной формой ИБС, получающие
статины не менее 1 мес, которым по показаниям проводилось стентирование коронарных артерий с декабря 2009 г. по декабрь 2010 г. с имплантацией, по крайней мере, одного СЛП.
В исследование не включали пациентов с острым коронарным синдромом, хронической сердечной недостаточностью III—IV функционального класса, перенесших инсульт в течение 6 мес до ЧКВ, с тяжелыми заболеваниями печени, мышц, почек, острыми или хроническими воспалительными заболеваниями, онкологическими заболеваниями, а также пациентов, принимающих противовоспалительные препараты за исключением ацетилсалициловой кислоты (АСК).
Процедура стентирования. Эндоваскулярное лечение проводили с применением стандартной техники
стентирования. Выбор СЛП оставлялся на усмотрение эндоваскулярного хирурга. Использовали стенты,
покрытые сиролимусом (СПС), паклитакселем (СПП), зотаралимусом (СПЗ) и эверолимусом (СПЭ). В зави-
симости от клинической ситуации до процедуры пациенты принимали клопидогрел либо в виде нагрузочной дозы 300—600 мг, либо в течение 5 дней до плановой процедуры в дозе 75—150 мг/сут. Все больные, по крайней мере, за 24 ч до процедуры получали либо нагрузочную дозу АСК 300 мг, либо длительную терапию АСК до проведения ЧКВ. В начале процедуры внутривенно вводили гепарин с учетом массы тела пациента под контролем активированного времени свертывания. После
процедуры назначали прием АСК в дозе 75—300 мг/сут, а также прием клопидогрела в дозе 75—150 мг/сут в течение срока, рекомендованного лечащими врачами.
Лабораторные анализы. Образцы крови брали непосредственно до процедуры ЧКВ, а для определения уровня тропонина I — повторно через 12—18 ч после процедуры. Уровень Лп-ФЛА2 определяли с помощью теста PLAC (diaDexus, США), высокочувствительного CРБ — с помощью теста CRPVARIO (SENTINELCH, Италия). Для определения СОЭ использовали метод Вестергрена.
Наблюдение за пациентами и определение исходов. Ранние исходы оценивали во время первичной госпитализации. Первичной конечной точкой в исследовании была суммарная частота развития неблагоприятных сердечно-сосудистых исходов (НССИ) — сердечно-сосудистая смерть, ИМ, инсульт, тромбоз стента (не приведшего к развитию ИМ). Перипроцедурный ИМ (тип 4а) определяли как повышение уровня тропонина I более чем в 3 раза по сравнению с верхней границей нормы (ВГН) [18]. Тромбоз стента (ТС) оценивали согласно классификации Academic Research Consortium [19].
Статистический анализ. Конечные переменные неблагоприятных исходов для статистического анализа
включали в комбинированный результат — серьезные неблагоприятные кардиальные и цереброваскулярные исходы, представляющие собой комбинацию летальных исходов от сердечно-сосудистых причин, инсульта, ИМ, ТС, не приведшего к развитию ИМ. С целью определения сходимости результатов были рассчитаны границы доверительного интервала, соответствующего 95% вероятности.
Для анализа демографических и базовых показателей, а также клинических исходов использовали дескриптивный анализ. Статистика включала таблицы частотности и кросс-табуляцию (среднее
арифметическое, стандартное отклонение, медиана, минимум, максимум, диапазон, квинтили, число
валидных случаев для непрерывных переменных, а также число, частотность и процентное отношение
для качественных переменных с указанием 95% доверительного интервала).
Для оценки влияния демографических факторов, сопутствующих заболеваний и базовых показателей (факторов риска пациентов в качестве независимых величин) на переменные клинических исходов
использовали логарифмическую и простую модели линейной регрессии (GLM).
Отклонения биохимических переменных от фоновых для каждой оценки анализировали с помощью
модели ANCOVA.
В дополнение к этому были проанализированы кумулятивные соотношения числа пациентов с серьезными неблагоприятными кардиальными и цереброваскулярными исходами в соответствии с датой события с помощью методики анализа выживания. В качестве цензурированной даты рассматривались даты выбывания или смерти. Совокупные отношения выживания оценивали по методике Каплана—Мейера, сравнение выборок выполнено с помощью логарифмического рангового критерия. В целях определения прогностических факторов времени выжи вания была разработана модель пропорциональных рисков Кокса для каждого негативного исхода после подтверждения того, что
предположение пропорциональности рисков действительно. Все статистические анализы были выполнены при двустороннем уровне значимости 5%.
Результаты
С декабря 2009 г. по декабрь 2010 г. в исследование включены 602 больных, исходные клинические характеристики которых отражены в табл. 1. Большинство составили мужчины (86%), средний возраст достигал 60,4 года. Преобладали больные со стенокардией I—II функционального класса, около 60% ранее перенесли ИМ. Сократительная функция миокарда левого желудочка в целом была сохранена (средняя фракция выброса 57,8±4,7%). Отмечалась высокая частота реваскуляризации миокарда в анамнезе (36%), в большинстве случаев ЧКВ. Более 80% пациентов страдали артериальной гипертонией.
Лекарственная терапия. В табл. 2 представлены данные по лекарственной терапии, получаемой пациентами в обеих группах. C учетом критериев включения все больные до проведения ЧКВ находились на длительной терапии статинами. Частота использования блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов была низкой, что связано с исключением больных с острым коронарным синдромом. Практически все пациенты принимали АСК. Все пациенты получали клопидогрел, нагрузочная доза которого использовалась лишь у каждого пятого пациента. Частота
назначения ингибиторов ангиотензинпревращающего фермента/блокаторов рецепторов ангиотензина II и β-адреноблокаторов была высокой и в обеих группах достоверно не различалась.
Ангиографические характеристики пациентов. Согласно ангиографическим характеристикам вклю-
ченные в исследование больные относились к группе высокого риска (табл. 3). У каждого третьего пациента выявлены трехсосудистое поражение и высокая частота тяжелого поражения типа С; часто стентировались передняя нисходящая артерия и бифуркационные поражения. СЛП первого (СПС, СПП) и второго (СПЗ, СПЭ) поколения использовались одинаково часто, при этом наиболее часто имплантировались СПС. В среднем у одного пациента имплантировались 1,46 стента.
Таблица 1. Исходные клинические характеристики пациентов.
Таблица 2. Прием лекарственных препаратов до стентирования.
Таблица 3. Ангиографическая характеристика пациентов.
Таблица 4. Исходные лабораторные данные.
Лабораторные данные. Исходные лабораторные данные представлены в табл. 4. На фоне приема статинов уровень холестерина липопротеидов низкой плотности был относительно невысоким, что не удивительно, учитывая прием статинов, хотя частота достижения целевого уровня (1,8 мммоль/л) и была небольшой (23,5%). Уровень маркеров воспаления был низким, что, возможно, было связано с длительным приемом статинов, оказывающих противовоспалительный эффект. Исходно уровень тропонина I был в норме, хотя и отличался от нуля, что позволило исключить пациентов с безболевым острым ИМ.
Ранние клинические исходы. Средняя длительность пребывания в стационаре после ЧКВ составила 4,9 дня. Все включенные больные были выписаны из стационара. На госпитальном этапе НССИ развились у 10,6% пациентов: ИМ — у 10,3%, из них с зубцом Q в 0,3% случаев. Церебральных осложнений не было. Ангиографически верифицированный ТС (с равной частотой развития острого и подострого) развился у 6 пациентов. У 2 пациентов ТС не привел к возникновению ИМ. В целом частота развития НССИ на госпитальном этапе была представлена исключительно ИМ и двумя случаями ТС, не приведшими к ИМ.
Предикторы развития НССИ во время госпитального этапа. НССИ чаще возникали при стентировании
огибающей артерии, технически сложных процедурах (вмешательстве на поражениях типа С, окклюзиях), при имплантации СПП, а также при необходимости имплантации большего количества стентов и соответственно более высокой общей длине стентов.
Единственным лабораторным маркером воспаления, прогностическая значимость которого выявлена
в данном исследовании, оказалась СОЭ. Кроме того, неблагоприятным прогностическим признаком было использование блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов. Частота их применения была выше в группе с НССИ, что связано с их назначением в случае развития угрозы осложнений во время ЧКВ.
При использовании многофакторного логистического регрессивного анализа независимыми предикторами развития НССИ на госпитальном этапе оказались СОЭ (p<0,01) и суммарная длина имплантированных стентов (p=0,002).
Обсуждение
Согласно полученным данным, несмотря на применение близкой к оптимальной терапии, в частности,
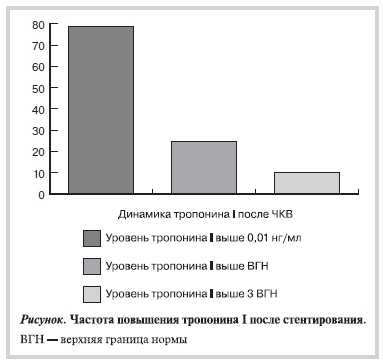
длительном приеме статинов до проведения ЧКВ, частота перипроцедурного ИМ остается высокой, хотя доля Q-ИМ минимальна — 0,3%. Повреждение миокарда встречалось еще чаще — уровень тропонина I превышал ВГН после процедуры у каждого четвертого пациента (см. рисунок). В других работах, где условием включения был длительный прием статинов, частота перипроцедурного ИМ была сопоставимой [14].
Мы провели анализ частоты развития осложнений и различных показателей воспаления у больных, находящихся на длительной терапии статинами, в случае имплантации СЛП. Основной находкой нашего исследования явилось то, что у данной категории больных СОЭ и суммарная длина имплантированных стентов являются независимыми предикторами развития ранних госпитальных осложнений, в абсолютном большинстве представленных перипроцедурным ИМ.
Прогностическое значение длины имплантированных стентов, выявленное в нашем исследовании,
отмечалось и в других исследованиях [5], однако прогностическое значение СОЭ у больных с СЛП изучено недостаточно.
СОЭ — один из самых часто используемых маркеров острого и хронического воспаления. Основными преимуществами этого показателя являются простота в использовании и дешевизна. СОЭ зависит от множества факторов, в основном от содержания белков острой фазы воспаления (фибриноген, иммуноглобулины, α2-макроглобулины), что делает его весьма чувствительным, хотя и неспецифическим маркером воспаления.
Ранее было показано, что СОЭ является независимым предиктором развития ИБС, коронарного атерос-
клероза, а также ИМ и сердечно-сосудистых осложнений [8—12]. Прогностическое значение СОЭ у больных с СЛП не изучалось. В нашей работе именно СОЭ оказалась единственным из маркеров воспаления, независимым предиктором развития острых осложнений.
Такие показатели, как уровень CРБ, Лп-ФЛА2, содержание лейкоцитов крови не проявили себя значимыми предикторами НССИ в раннем периоде. В других работах, где изучалось значение указанных маркеров, были получены данные, согласно которым CРБ является значимым предиктором развития НССИ в течение 30 дней после ЧКВ [3—5]. Однако эти исследования часто включали больных с острым ИМ, у которых повышенный уровень CРБ, возможно, был связан с некрозом миокарда до ЧКВ. В случае исключения больных ИМ из анализа CРБ как предиктор НССИ переставал быть значимыми [3, 4]. Кроме того, в этих работах частота приема статинов до ЧКВ была низкой. В наше исследование включались только больные со стабильной стенокардией. Острые безболевые ИМ были исключены с помощью исходного определения уровня тропонина I. Особенностями нашего исследования явились использование только СЛП, а также длительный прием статинов у всех больных до ЧКВ. В нескольких работах было показано снижение частоты развития перипроцедурного ИМ при назначении статинов за несколько часов до ЧКВ
[14, 17]. Статины, оказывая противовоспалительный эффект, при длительном приеме приводят к снижению уровня CРБ. Это подтверждается исходным низким уровнем воспалительных маркеров до ЧКВ в нашем исследовании. В других исследованиях прогностическая роль уровня CРБ была значимой только при его высоких значениях. Лекарственное покрытие СЛП также дает противовоспалительный эффект, что может «сглаживать» острую воспалительную реакцию во время стентирования. Таким образом, СОЭ, как мы предполагаем, оказалась наиболее чувствительным маркером, по зволяющим выявить остаточное воспаление на фоне приема статинов и имплантации СЛП.
Недостатком нашего исследования явилось относительно небольшое число включенных больных.
Кроме того, неспецифический характер повышения СОЭ не позволяет исключить влияние других факторов, не связанных с воспалением. Указанный анализ является предварительным. В дальнейшем планируется провести анализ отдаленных исходов, а также их связи с уровнем воспалительных маркеров и приема различных статинов.
Клиническое значение. Согласно данным проведенного исследования ЧКВ у пациентов со стабильной
ИБС, длительно принимающих статины, в случае исходно повышенной СОЭ риск развития НССИ,
главным образом повреждения миокарда, на госпитальном этапе после имплантации СЛП повышен.
Риск развития сосудистых осложнений повышается также с увеличением суммарной длины имплантиро-
ванных стентов.



