Печень играет главную роль в гомеостазе, поэтому ее поражение неизбежно сопровождается негативным воздействием на многие органы, включая сердце и легкие [1, 2]. Легочная артериальная гипертензия (ЛАГ) является редким, но признанным осложнением хронических заболеваний печени, среди которых наиболее частой причиной возникновения служит цирроз печени (ЦП). Большой интерес в настоящее время представляют наблюдения за естественным течением ЦП и его различными системными проявлениями [3, 4].
Патология печени существенно влияет на легочной кровоток. Известно, что у больных ЦП в патологический процесс вовлекается малый круг кровообращения (МКК) с развитием ЛАГ. Однако в настоящее время нет достоверных сведений о происхождении ЛАГ у больных портальной гипертензией (ПГ) [4—6]. При этом степень компенсации нарушений является одним из определяющих факторов в оценке их общего состояния и прогноза течения заболевания [2].
В структуре общей смертности пациентов с заболеваниями печени нарушения центральной гемодинамики составляют до 60% [6—8]. Механизм, благодаря которому ПГ способствует развитию ЛАГ, остается неясным, однако в настоящее время не вызывает сомнения, что ЛАГ представляет собой группу клинических синдромов с разной этиологией, в патогенезе которых принимают участие различные биохимические процессы и типы клеток. Предполагают, что легочная вазоконстрикция — раннее патогенетическое звено ЛАГ, в основе которого лежат нарушение функции или экспрессии калиевых каналов в гладких мышечных клетках и дисфункция эндотелия (ДЭ) [5].
Наиболее точный метод («золотой стандарт» диагностики ЛАГ) — инвазивное измерение давления в легочных сосудах с помощью их катетеризации. Тем не менее для постановки диагноза «легочная гипертензия», согласно современным рекомендациям консенсуса экспертов ACC/AHA (2009), ключевыми являются только те методы обследования, которые позволяют определить давление в легочной артерии (ЛА) [5, 6]. Это можно сделать с помощью такого неинвазивного метода, как допплер-эхокардиография (ЭхоКГ) [8—13]. Скрининговое обследование с применением ЭхоКГ для определения ЛАГ у пациентов с заболеваниями печени целесообразно у больных с клиническими проявлениями заболевания/или кандидатов для трансплантации печени [13—15].
Цель работы: изучение функционального состояния легочно-сердечной гемодинамики у больных ЦП различной степени тяжести в сопоставлении с показателями портального кровотока и во взаимосвязи с вазорегулирующей функцией эндотелия.
Материал и методы
Исследование проводилось на базе отделения гастроэнтерологии Томской областной клинической больницы (ОГАУЗ ТОКБ) на кафедре терапии факультета повышения квалификации и профессиональной переподготовки специалистов ГБОУ ВПО СибГМУ Минздрава России с 2006 по 2009 г. Обследован 81 больной ЦП: 37 (45,7%) мужчин и 44 (54,3%) женщины. В исследование были включены пациенты в возрасте от 26 до 71 года (средний возраст 50±10,4 года).
У всех пациентов, включенных в исследование, было выявлено поражение печени, диагностированное на стадии ЦП. Комплекс исследований включал анализ клинико-эпидемиологических, анамнестических данных, патоморфологическое изучение биоптатов печени (при выполнении биопсии печени по показаниям), а также выполнение инструментальных исследований. Диагноз ЦП подтвержден морфологически (лапароскопия с прицельной биопсией) у 12 больных, у остальных выставлен на основании наличия признаков диффузного повреждения печени, синдрома печеночно-клеточной недостаточности, синдрома ПГ (варикозное расширение вен пищевода и желудка, асцит).
Тяжесть течения заболевания у больных ЦП оценивали в соответствии с классификацией по Чайлд—Пью. Среди больных ЦП 45,7% были отнесены к классу В; 34,6% — к классу С по Чайлд–Пью, и лишь 19,8% соответствовали классу А. Группы пациентов были сопоставимы по полу и возрасту.
По этиологии ЦП выделено 3 группы: к 1-й группе отнесены 22 пациента (27,2% от числа всех обследованных), злоупотребляющие этанолом. У всех больных алкоголь явился «изолированным» этиологическим фактором поражения печени. Изолированное вирусное поражение печени было выявлено у 20 (24,7%) больных (2-я группа). На фоне действия токсичного агента и вируса на печень была выделена 3-я группа пациентов — 39 (48%).
Из исследования были исключены пациенты с противовирусным лечением в анамнезе, пациенты с другими заболеваниями печени (болезнь Вильсона—Коновалова и Бадда—Киари, гемохроматоз, первичный амилоидоз печени, аномалии сосудов портального тракта, билиарный и кардиальный ЦП), а также с другой тяжелой сопутствующей патологией, которая могла бы влиять на тяжесть поражения печени. Исключали больных, злоупотребляющих лекарственными препаратами, страдающих наркоманией, пациентов с легочной патологией (бронхоэктатическая болезнь, бронхиальная астма, туберкулез легких, хроническая обструктивная болезнь легких, интерстициальные болезни легких), сердечной патологией (пороки сердца, патология клапанов сердца, нестабильная стенокардия, стенокардия напряжения III—IV функционального класса – ФК, атриовентрикулярная блокада II—III степени, артериальная гипертензия 3-й степени), сахарным диабетом 1-го и 2-го типов и эндокринопатиями, патологией почек с почечной недостаточностью, онкологическими заболеваниями, острыми психозами и психическими расстройствами.
Из всех сопутствующих заболеваний у исследуемого контингента больных наиболее часто встречались заболевания сердечно-сосудистой системы. В 6,1% случаев у больных ЦП была выявлена ишемическая болезнь сердца — стенокардия напряжения I и II ФК, а также гипертоническая болезнь I и II стадии. Учитывая возможное формирование хронической обструктивной болезни легких у пациентов с большой длительностью курения, проводили оценку вентиляционных показателей у курящих и некурящих больных ЦП. Сравнительный анализ в этих группах показал отсутствие отклонений вентиляционных параметров от нормы по сравнению с должными величинами.
Контрольную группу составили 20 практически здоровых пациентов (в исследовании участвовали пациенты с трикуспидальной регургитацией, по данным ЭхоКГ), сопоставимых по полу и возрасту.
ЭхоКГ проводили всем больным по стандартной методике Американской ассоциации эхокардиографии [8, 14] на аппарате Logiq-7. Оценивали общую сократимость миокарда, состояние клапанного аппарата, измеряли размеры стенок и полостей желудочков и предсердий по стандартной методике в двух- и одномерном режимах, а также в режимах импульсной и непрерывно-волновой допплер-ЭхоКГ.
По общепринятой методике из парастернального и апикального доступов в 2-, 4- и 5-камерном сечении по длинной и короткой осям камер сердца определяли следующие параметры левых отделов сердца: размер просвета корня аорты на уровне клапана (Ао, мм), диаметр полости левого предсердия (ЛП, мм), конечный систолический размер (КСР, мм) полости левого желудочка (ЛЖ), конечный диастолический размер полости (КДР, мм) ЛЖ, конечный систолический объем (КСО, мл) ЛЖ, конечный диастолический объем (КДО, мл) ЛЖ, толщину межжелудочковой перегородки (ТМЖП, мм), толщину задней стенки левого желудочка (ТЗСЛЖ, мм), а также правых отделов сердца: диастолический размер полости правого желудочка (ПЖ, мм), систолическое давление (СД, мм рт.ст.) в ПЖ. Рассчитывали ударный объем (мл), фракцию выброса (ФВ, %), фракцию укорочения (%) ЛЖ. Количественную оценку степени легочной гипертензии осуществляли путем измерения диаметра основного ствола ЛА, скорости кровотока в ЛА (V в ЛА, см/с) и максимального систолического давления в ЛА (СДЛАmax, мм рт.ст.) [10—14]. Расчет СДЛАmax проводили по определению значения максимальной скорости трикуспидального систолического потока регургитации, а затем по уравнению Бернулли определяли систолический градиент давления между ПЖ и правым предсердием (ПП) (dP=4V2). К полученным значениям желудочково-предсердного градиента давления прибавляли давление в ПП (ДПП). Величину ДПП рассчитывали по параметрам нижней полой вены (норма 5 мм рт.ст., но при дилатированной нижней полой вене, которая коллабирует на вдохе менее 50%, равно 10 мм рт.ст.). Полученный результат отражал СДЛАmax.
В отсутствие обструкции выходного отдела ПЖ СДЛАmax эквивалентно СДПЖ. СДЛАmax считали нормальным, если в покое оно не превышало 25 мм рт.ст. При повышении его до 35 мм рт.ст. ЛАГ считали минимально увеличенным. Давление 36—45 мм рт.ст. свидетельствовало о небольшой степени ЛАГ.
Умеренная ЛАГ характеризовалась повышением давления до 46—55 мм рт.ст., а выраженная — более 55 мм рт.ст. [15—22].
Функциональные сосудистые пробы с допплерографической оценкой степени дилатации плечевой артерии (ПА) проводили по методике, предложенной D. Celermajer и соавт. (1992), на ультразвуковой диагностической системе ACUSON 128 XP/10 (США).
Функцию эндотелия изучали на основе пробы с реактивной гиперемией (РГ) и нитроглицерином [22, 23]. Определяли диаметр ПА и толщину комплекса интима—медиа (ТИМ). За норму принимали ТИМ<1,0 мм. Варьирование ТИМ в пределах 1—1,1 мм включительно оценивали как утолщение интимы, критерием наличия атеросклеротической бляшки было превышение ТИМ 1,1 мм. О сохранной функции эндотелия сосуда свидетельствовало увеличение диаметра ПА при окклюзионной пробе на 10% и более, о ДЭ — менее 10%.
Норма эндотелийнезависимой вазодилатации (ЭНЗВД) ПА — 20% и более, ДЭ — менее 20%. У всех обследованных ТИМ находилась в пределах 0,6—0,7 мм, что соответствовало обычным значениям для данной возрастной группы (средний возраст обследованных 50±10,4 года). Кроме того, следует отметить, что ни у одного из обследованных не были выявлены увеличение ТИМ общей сонной артерии (ОСА) и атеросклеротические бляшки в просвете ОСА. Таким образом, у всех больных ЦП ультразвуковых признаков генерализованного атеросклероза обнаружено не было.
Для статистической обработки материала использовали статистический пакет Statistica v. 6.0. Проверку групп на нормальность распределения признаков проводили с помощью теста Колмогорова—Смирнова, а также графического представления выборок на фоне кривой Гаусса. Статистическую значимость при сравнении двух независимых количественных переменных при распределении признака, отличающегося от нормального, оценивали с помощью U-критерия Манна—Уитни. Для определения связи между переменными при несоответствии нормальному закону распределения или балльных оценках вычисляли коэффициент корреляции Спирмена. Множественные сравнения проводили с применением многофакторного дисперсионного анализа (для независимых переменных) [24]. Статистически значимыми считали различия при p≤0,05.
Результаты и обсуждение
Известно, что ЦП — системное заболевание организма с наличием гипердинамической внутриорганной циркуляции как проявления ПГ, которая приводит к полиорганным нарушениям [8, 11, 15, 23]. Печеночная гемодинамика чрезвычайно чувствительна к любому воздействию на организм, а ее первичные нарушения могут влиять на функцию сердца, являясь причиной формирования ЛАГ [9, 18, 25—27].
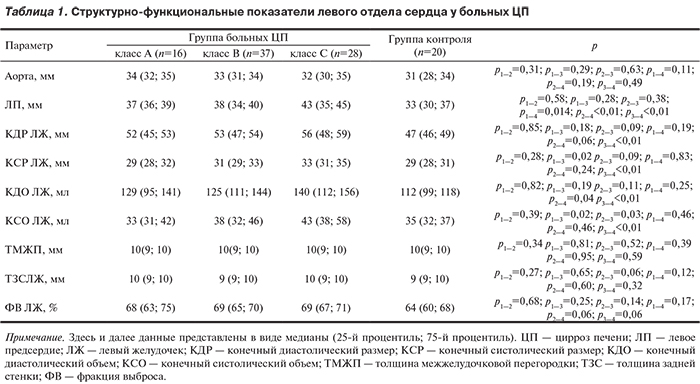
Как показало наше исследование, у больных ЦП происходят изменения структурно-функциональных показателей сердца и динамика некоторых из них зависит от стадии компенсации заболевания (табл. 1)
Из представленных данных видно, что размер просвета корня аорты на уровне клапана не превышал нормальных значений и при сравнении не различался между классами ЦП и от контрольной группы. Диаметр полости ЛП у больных ЦП классов А и В имел нормальные значения в отличие от пациентов класса С, у которых перегрузка объемом МКК привела к дилатации ЛП. Дилатация ЛП нарастала с утяжелением ЦП (r=0,14; р=0,01) от класса А к классу С.
Таким образом, проведенный анализ параметров ЭхоКГ левых отделов сердца показал, что по сравнению с контрольной группой уже на начальных стадиях ЦП происходит дилатация ЛП. В целом общее число больных ЦП с дилатацией ЛП составило 35,8%. Так, если у 87,5% больных ЦП класса А размеры ЛП не превышали нормы, то число больных класса В с дилатацией ЛП увеличилось до 37,8%. У 46,4% пациентов класса С этот показатель был выше установленной нормы (более 41 мм) и в целом по группе составил 43 (35; 45) мм. На стадии С происходит увеличение показателей ЛЖ: КСР и КДР, а также КСО и КДО. Увеличение КДР ЛЖ отмечено только у пациентов 3-й группы, что указывает на дилатацию полости ЛЖ, тогда как значения данного параметра в 1-й и 2-й группах соответствовали норме. Необходимо отметить, что при сравнении данного показателя между всеми группами статистически значимые различия были выявлены только для группы класса С по сравнению с группой контроля (р<0,01). КСР ЛЖ у больных ЦП всех классов не отличался от нормы, однако сравнительный анализ показал, что этот параметр статистически значимо различается у больных классов А и С (р=0,02), а также у пациентов с ЦП класса С по сравнению с контрольной группой (р<0,01). В целом увеличение КСР ЛЖ было выявлено только у одной пациентки с ЦП класса С. Параметры, отражающие объемы ЛЖ (КДО и КСО), не превышали нормальных значений в каждом классе, однако отличались высокой статистической значимостью при сравнении больных ЦП класса С с группой контроля (р<0,01). Отмечены также статистически значимые отличия КДО ЛЖ у пациентов с ЦП классов В и С при сравнении с контрольной группой (р<0,05). В целом среди всех больных ЦП увеличение КДО ЛЖ выявлено у 22,2%, увеличение КСО ЛЖ — лишь у 7,4%. Такие морфометрические параметры левых отделов сердца, как ТМЖП и ТЗСЛЖ, не превышали границ нормы. При их сравнении между классами ЦП и с группой контроля статистически значимых различий выявлено не было. ФВ ЛЖ не только не уменьшалась при утяжелении ЦП, но во всех трех классах отмечена тенденция к ее повышению по сравнению с группой контроля: 69% (67%; 71%) в отличие от 64% (60%; 68%), что может свидетельствовать о склонности к гипердинамическому состоянию кровотока, отмеченному в ряде исследований. Среди всех больных ЦП ФВ ЛЖ была ниже нормы только у 2 (2,5% от всех больных).

В соответствии с классификацией A. Ganau и соавт. (1992) на основании критерия относительной толщины стенки (ОТС) миокарда, рассчитанной по формуле: ОТС=(ТМЖП+ТЗСЛЖ)/КДР, выделяли следующие типы геометрической модели гипертрофии ЛЖ — концентрическая (ОТС>0,45) и эксцентрическая (ОТС<0,45). Результаты исследования показали, что у 91,4% больных ЦП выявлена эксцентрическая модель ремоделирования ЛЖ и лишь у 7 (8,6%) — концентрическая.
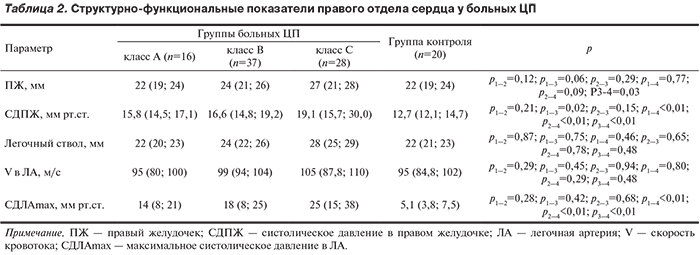
Согласно полученным нами данным, у больных ЦП отсрочены изменения структурно-функциональных показателей правых отделов сердца (табл. 2).
На фоне снижения компенсации заболевания у пациентов с ЦП класса С присоединяется дилатация ПЖ (более 27 мм). В группах с ЦП классов А и В данный параметр не отличался от нормы. При сравнительном анализе этого показателя между больными ЦП и группой контроля статистически значимых отличий не выявлено, за исключением сравнения группы пациентов с ЦП класса С с контрольной группой (р=0,03). Среди всех больных ЦП дилатация ПЖ выявлена у 27,2%, причем у 39,3% пациентов с ЦП класса С. Уже на начальной стадии ЦП (класс А) отмечены более высокие значения показателей СДПЖ и СДЛАmax по сравнению с группой контроля (р<0,01). Выявлено, что СДПЖ нарастал с утяжелением ЦП (r=0,30; р=0,02). Показатель, отражающий диаметр основного ствола ЛА, увеличивался соответственно степени тяжести ЦП (r=0,30; р=0,02), однако статистически значимо не отличался от такового в группе контроля. Аналогичные результаты получены по показателю скорости кровотока в ЛА. Общее число пациентов со скоростью кровотока в ЛА>120 см/с составило 4,9%, чаще в классе С (7,1%). В целом у всех пациентов без учета степени тяжести и этиологии медиана артериального давления (АД) составила 120/75 мм рт.ст., частоты сердечных сокращений — 75 уд/мин. Следует отметить, что анализ выполнялся без учета пола, а также уровня АД в группах сравнения, что могло повлиять на полученные значения параметров центральной гемодинамики.
Основным параметром, позволяющим диагностировать наличие и степень выраженности ЛАГ, является СДЛАmax. Выявлено, что СДЛАmax нарастало с утяжелением ЦП (r=0,09; р=0,05). Анализ признаков ЛАГ на ЭхоКГ показал, что увеличение СДЛАmax было выявлено у 11,1% пациентов: у 1 (6,3%) больного с начальной стадией ЦП; в группе пациентов класса В признаки ЛАГ выявлены в 5,4% случаев, чаще всего (21,4%) ЛАГ регистрировалась у пациентов с терминальной стадией ЦП. Таким образом, распространенность ЛАГ у больных ЦП класса С была значительно выше, чем в группе класса А (21,4 и 6,3% соответственно; р<0,05).
ЛАГ у больных ЦП была умеренной степени, т.е. СДЛАmax не превышало 50 мм рт.ст.
Таким образом, изменения внутрисердечной гемодинамики зависят от степени тяжести ЦП и проявляются на его начальной стадии в виде дилатации ЛП, нарастания СДПЖ и СДЛАmax, на поздней стадии — в виде увеличения объемов и ремоделирования ЛЖ, а также дилатации ПЖ. Одной из возможных причин дилатации ЛП у больных ЦП в терминальной стадии (класс С) может быть гиперволемия МКК, связанная с портопульмональным шунтированием, которое приводит к увеличению притока крови к ЛП. Наиболее частыми причинами дилатации ЛП могут быть также пол, возраст, наличие ишемической болезни сердца, алкогольное поражение сердца, метаболические нарушения в организме пациента и др.
Для характеристики тяжести ЛАГ, ассоциированной с ПГ, согласно современным рекомендациям Европейского общества кардиологов и Европейского респираторного общества по диагностике и лечению ЛАГ (2009), нами использовался модифицированный вариант классификации NYHA (Нью-Йоркской ассоциации сердца) [9—11, 14] в соответствии с классификацией Всемирной организации здравоохранения (1998) [9, 10, 13, 14]. Среди всех больных ЦП с ЛАГ, выявленной с помощью ЭхоКГ, были выделены следующие ФК: II, III, а также IV по классификации NYHA.
Представления о патогенезе ЛАГ весьма неполны. Однако, по-видимому, при данном заболевании ключевую роль играет именно поражение эндотелия. С современных позиций эндотелий — сложный и многофункциональный орган, площадью более 5000 м2 и массой 2—3 кг. Эндотелиальные клетки в виде монослоя выстилают внутреннюю поверхность сосудов и камер сердца. Эндотелий не просто образует барьер между кровью и гладкой мускулатурой сосудов, но и действует в качестве модулятора функций сосудов, вырабатывая ряд вазоактивных веществ.
ДЭ проявляется хроническим дисбалансом между продукцией вазодилатирующих, ангиопротективных и вазоконстрикторных, протромботических и пролиферативных факторов [24]. Избыточная вазоконстрикция способствует повышению сосудистого тонуса и ремоделированию сосудов. В результате образуется порочный круг, когда повреждение эндотелия неуклонно прогрессирует и приводит к ремоделированию легочных сосудов, нарастанию сосудистой обструкции и облитерации [18, 28—31].
У всех обследованных лиц было получено качественное изображение ПА, что позволило оценить эндотелийзависимую вазодилатацию (ЭЗВД) и ЭНЗВД ПА. В общей группе больных были выделены два типа ЭЗВД, описанных в литературе: нормальная — у 49 (60,0%) пациентов и патологическая — у 32 (40%). Последняя включала только недостаточную степень вазодилатации в ответ на РГ (от 0 до 10%). Наличия вазоконстрикции у обследованных больных зарегистрировано не было. Распределение больных ЦП с нормальной и патологической ЭЗВД по классам градации Чайлд—Пью отражено в табл. 3.
Из представленных данных видно, что патологическая ЭЗВД у больных ЦП была выявлена в каждом классе по Чайлд—Пью с увеличением распространенности от класса А к классу С (см. табл. 3).
Аналогично представлено распределение больных ЦП с нормальной и патологической ЭНЗВД по классам градации Чайлд—Пью в табл. 4.
Таким образом, ДЭ выявлена уже на начальных стадиях ЦП и прогрессивно увеличивается от класса А к классу С. Так, у больных ЦП класса А ДЭ зарегистрирована у 18,6%, в классе В — у 27%, а в классе С — у 46,7%.
По результатам анализа распространенности ДЭ среди больных ЦП с ЛАГ, ДЭ статистически значимо встречалась чаще у больных ЦП с ЛАГ, чем у больных ЦП без признаков ЛАГ — у 6 (66,7%) и 25 (34,7%) соответственно (p=0,03). Среди всех больных ЦП с признаками ЛАГ (11,1%) большинство пациентов с ДЭ (44,4%) выявлены в классе С — терминальной стадии цирроза и по одному пациенту в классах А и В.
Таким образом, ДЭ имеет несомненное значение в формировании ЛАГ у больных ЦП. Этот фактор существует уже на начальных стадиях заболевания, что способствует вазоконстрикции, ремоделированию сосудов и формированию ЛАГ.
Нарушение сосудодвигательной функции эндотелия наблюдалось на всех стадиях цирроза, чаще у больных ЦП с ЛАГ, что указывает на ее важную роль в механизме формирования портолегочной гипертензии.
Заключение
Частотный анализ эхокардиографических признаков легочной артериальной гипертензии у обследованных нами пациентов показал, что увеличение максимального систолического артериального давления в легочной артерии выявлено у 11,1% больных циррозом печени во всех классах по Чайлд—Пью. Легочная артериальная гипертензия была умеренной степени тяжести (максимальное систолическое артериальное давление в легочной артерии не превышало 50 мм рт.ст.), причем частота развития ее у больных циррозом печени класса С была значительно выше, чем в классе А (21,4 и 6,3% соответственно; р<0,05). Расстройства вазорегулирующей функции эндотелия были взаимосвязаны с параметрами легочно-сердечной гемодинамики, функциональным состоянием правого желудочка и в большей степени были выражены в группе больных легочной артериальной гипертензией. Установлено, что нарушение сосудодвигательной функции эндотелия прогрессирует с утяжелением цирроза печени. Показана связь между допплер-эхокардиографическими параметрами легочного кровообращения и наличием дисфункции эндотелия у пациентов с циррозом печени различного генеза.
Полученные данные нашего исследования могут быть полезными в практическом здравоохранении при оценке тяжести и прогнозировании нарушений легочно-сердечной гемодинамики у больных циррозом печени.



