Ишемическая болезнь сердца (ИБС) — одно из наиболее актуальных заболеваний в развитых странах. Неудивительно, что пациенты с ИБС являются субъектами значительного числа рандомизированных исследований. Их результаты служат источником огромного количества новых данных по проблемам ИБС, однако трактовка этих данных и их приложение к практике нередко представляют затруднения. Выбор между реваскуляризацией и консервативным ведением пациента со стабильной ИБС является одним из таких проблемных вопросов, часто приводящих к дискуссиям между кардиологами, интервенционистами и кардиохирургами. В настоящем обзоре этот вопрос освещается с учетом последних рекомендаций ведущих кардиологических обществ и данных важнейших клинических исследований.
 Согласно формулировке Рабочей группы американских кардиологических сообществ по коронарной реваскуляризации, данное вмешательство оправдано, если его ожидаемый положительный эффект в отношении показателей качества жизни (симптомов, функционального состояния и пр.), а также в отношении прогноза превосходит ожидаемые нежелательные последствия [1]. Выбор в пользу консервативной медикаментозной тактики или реваскуляризации основывается на совокупности важнейших клинических характеристик пациента (табл. 1).
Согласно формулировке Рабочей группы американских кардиологических сообществ по коронарной реваскуляризации, данное вмешательство оправдано, если его ожидаемый положительный эффект в отношении показателей качества жизни (симптомов, функционального состояния и пр.), а также в отношении прогноза превосходит ожидаемые нежелательные последствия [1]. Выбор в пользу консервативной медикаментозной тактики или реваскуляризации основывается на совокупности важнейших клинических характеристик пациента (табл. 1).
Детализация и комбинирование указанных клинических параметров дает более 4000 возможных клинических сценариев [1, 2], поэтому выбор в реальной практике далеко не всегда очевиден.
Реваскуляризация для облегчения симптомов
Типичная лимитирующая стенокардия. Известно, что реваскуляризация превосходит консервативное лечение в облегчении или устранении ишемических болей [3].
В связи с этим сохранение лимитирующей стенокардии (III—IV функциональный класс по классификации Канадского общества кардиологов [4]), несмотря на проведение оптимальной медикаментозной терапии (ОМТ), при наличии значимого коронарного стеноза любой локализации, по данным коронарографии (КГ), является показанием к реваскуляризации. Аналогичным образом реваскуляризация рекомендуется при наличии лимитирующей стенокардии и поражении одного венозного шунта или более у пациента после коронарного шунтирования (КШ) [2].
Следует отметить, что значимость поражения при КГ европейские и американские рекомендации определяют по-разному: как >50% и >70% соответственно [1, 2, 5].
Канадская классификация стенокардии основана на субъективных жалобах пациента. Объективно оценить тяжесть стенокардии позволяет классификация результатов стресс-теста: I класс — >7,0 МЕТ, II класс — 4,0—6,9 МЕТ, III класс — 2,0—3,9 МЕТ, IV класс — <2,0 МЕТ [4].
Эквивалент стенокардии. Определить целесообразность реваскуляризации для облегчения симптомов в отсутствие типичной клинической картины более сложно. Согласно Европейским рекомендациям [2], показанием к реваскуляризации является эквивалент стенокардии (одышка) на фоне ОМТ при наличии стеноза коронарной артерии (КА) >50% любой локализации. Однако жалобы на одышку неспецифичны в отношении ишемии миокарда, а кроме того, не всякий ангиографически выявленный стеноз, особенно определяемый, согласно европейскому стандарту, как 50% сужение сосуда, имеет физиологическую значимость и действительно ответственен за ишемию. Представляется целесообразным в такой клинической ситуации учесть результаты стресс-теста. Реваскуляризация будет более обоснованной в случае подтверждения ишемии при нагрузочной пробе. Общепринятым порогом значимости является объем ишемии >10% левого желудочка (ЛЖ) [2]. Для получения данных об объеме ишемии требуется проведение нагрузочного теста с визуализацией миокарда: стресс-эхокардиографии (стресс-ЭхоКГ), однофотонной эмиссионной компьютерной томографии (ОФЭКТ), позитронно-эмиссионной томографии (ПЭТ) и др. Традиционная электрокардиография (ЭКГ) с физической нагрузкой этой информации не дает.

Соответственно наиболее корректной представляется следующая формулировка показаний к реваскуляризации на основании симптомов:
- лимитирующая стенокардия на фоне ОМТ при наличии стеноза КА >50% любой локализации или стеноза венозного шунта >50% любой локализации;
- эквивалент стенокардии (одышка) на фоне ОМТ при наличии стеноза КА >50% любой локализации или стеноза венозного шунта >50% любой локализации, в первую очередь в случае, если при проведении стресс-теста с визуализацией миокарда подтверждается ишемия более 10% ЛЖ.
Особые клинические ситуации. Существуют ситуации, когда наличие лимитирующих болей или их эквивалента при доказанном поражении коронарного русла может быть недостаточным для принятия решения о целесообразности реваскуляризации.
Если у пациента выявляют «пограничное» (50—60%) сужение КА, а данные стресс-теста указывают на низкий риск развития сердечно-сосудистых осложнений (подробнее о трактовке стресс-теста см. ниже), ишемический генез боли сомнителен. В таких случаях реваскуляризацию, как правило, не проводят.
Если при КГ выявляют хроническую окклюзию одного сосуда (за исключением проксимального отдела передней межжелудочковой артерии — ПМЖА), следует взвесить, насколько тяжесть симптомов оправдывает технически сложное вмешательство на одном сосуде, однако в целом реваскуляризация считается показанной.
Реваскуляризация для улучшения прогноза
Если целесообразность реваскуляризации для облегчения симптомов в основном определяется тяжестью стенокардии, то прогностический эффект реваскуляризации зависит от других факторов, перечисленных в табл. 1.
Коронарная анатомия и прогноз. Взаимосвязь характера поражения коронарного русла и прогноза хорошо известна. R. Califf и соавт. [6] продемонстрировали закономерное повышение сердечной смертности по мере увеличения числа КА, имеющих значимые стенозы, увеличения степени стеноза, а также прогностически неблагоприятную роль проксимального поражения ПМЖА. Кроме того, в течение многих лет известно, что наиболее неблагоприятный прогноз имеют находящиеся на медикаментозной терапии пациенты со стенозом ствола левой КА (ЛКА) [6]. Стеноз ЛКА, трехсосудистое поражение, поражение проксимального отдела ПМЖА характеризуют как «коронарную анатомию высокого риска».
Следует напомнить, что КГ не позволяет выявить уязвимую атеросклеротическую бляшку и прогнозировать место развития атеротромбоза, который, как правило, происходит там, где сужение до развития острого коронарного синдрома (ОКС) было гемодинамически незначимым (<50%) [7]. Неблагоприятная прогностическая роль тяжелого поражения коронарного русла связана с тем, что оно коррелирует с большим количеством гемодинамически незначимых уязвимых бляшек, которые и являются субстратом ОКС.

Более точно количественно охарактеризовать тяжесть поражения коронарного русла для оценки кардиального прогноза и выбора тактики лечения позволяет использование шкалы SYNTAX [8], с помощью которой для каждого поражения рассчитывается балл с учетом локализации, степени стенозирования и дополнительных ангиографических характеристик [9].
Функция ЛЖ и прогноз. Фракция выброса (ФВ) ЛЖ — важнейший фактор прогноза и выбора лечебной тактики. Уменьшение ФВ сопровождается снижением долгосрочной выживаемости больных ИБС, получающих медикаментозное лечение, причем при ФВ<35% наблюдается резкое ухудшение прогноза (12-летняя выживаемость составляет 21%) [10]. В связи с этим снижение ФВ ЛЖ, выявленное при неинвазивном исследовании, служит неблагоприятным прогностическим маркером, ФВ в покое или при проведении нагрузочного теста <35% указывает на высокий уровень риска.
Стратификация риска при стресс-тесте. Неинвазивный нагрузочный тест дает очень много необходимой информации — позволяет верифицировать диагноз, установить бассейн(ы) поражения КА, подтвердить или отвергнуть гемодинамическую значимость выявленных пограничных стенозов, оценить глобальную функцию ЛЖ на фоне нагрузки, выявить жизнеспособный миокард в зоне дисфункции ЛЖ [11]. Наиболее полную картину дают стресс-тесты с визуализацией миокарда, однако и обычный стресс-тест с ЭКГ весьма информативен.
Анализ полученных показателей дает возможность составить представление о риске развития кардиальных осложнений и определить показания к КГ, а во многих случаях установить целесообразность реваскуляризации, если данные КГ известны. Поэтому выполнение стресс-теста — ключевой этап обследования большинства пациентов со стабильной ИБС.
 Электрокардиографический нагрузочный тест общедоступен, лучше всего известен клиницистам и недорог, в том числе в плане стоимости необходимого оборудования — в связи с этим его рекомендуют использовать в первую очередь [7, 12]. При анализе его результатов о риске судят по величине нагрузки, которую пациент способен выполнить, степени изменений сегмента ST, длительности их восстановления и т.д. Примером оценки риска является расчет баллов по шкале Duke [13], на основании которой можно прогнозировать вероятность коронарных исходов в течение 5 лет. В соответствии с рассчитанным баллом пациента относят к одной из трех категорий риска — низкого (>+4 баллов, ежегодная смертность 0,25%); умеренного (-10—+4 балла, ежегодная смертность 1,25%) или высокого (<-10 баллов, ежегодная смертность 5%).
Электрокардиографический нагрузочный тест общедоступен, лучше всего известен клиницистам и недорог, в том числе в плане стоимости необходимого оборудования — в связи с этим его рекомендуют использовать в первую очередь [7, 12]. При анализе его результатов о риске судят по величине нагрузки, которую пациент способен выполнить, степени изменений сегмента ST, длительности их восстановления и т.д. Примером оценки риска является расчет баллов по шкале Duke [13], на основании которой можно прогнозировать вероятность коронарных исходов в течение 5 лет. В соответствии с рассчитанным баллом пациента относят к одной из трех категорий риска — низкого (>+4 баллов, ежегодная смертность 0,25%); умеренного (-10—+4 балла, ежегодная смертность 1,25%) или высокого (<-10 баллов, ежегодная смертность 5%).
Тесты с визуализацией миокарда. Как правило, это стресс-ЭхоКГ, ОФЭКТ, ПЭТ [14, 15]. Их используют как альтернативу ЭКГ-тесту в следующих ситуациях:
- если затруднена интерпретация изменений сегмента ST на ЭКГ нагрузки (например, полная блокада левой ножки пучка Гиса, гипертрофия ЛЖ, после перенесенного Q-инфаркта миокарда — ИМ и пр.);
- если пациент не способен выполнить достаточную для диагностики физическую нагрузку;
- в случае необходимости выяснения локализации значимого коронарного поражения (у пациентов, перенесших реваскуляризацию или имеющих «пограничные» стенозы»);
- при необходимости дифференциальной диагностики жизнеспособного миокарда и необратимого поражения в зоне хронической сократительной дисфункции ЛЖ.
По результатам стресс-теста с визуализацией пациентов также подразделяют на 3 группы риска. Параметры стратификации риска по неинвазивному тесту обобщены в табл. 2.
Как уже упоминалось выше, стресс-тест служит двум основным целям: 1) определение показаний к КГ; 2) оценка целесообразности реваскуляризации при наличии данных КГ. Действительно, результаты стресс-теста позволяют более точно стратифицировать пациентов по фактическому риску, в том числе имеющих анатомически тяжелые поражения коронарных артерий. Между тем общепринятая точка зрения состоит в том, что чем выше риск у пациента со стабильной ИБС, тем больше ожидаемый прогностический эффект реваскуляризации [16].
 В связи этим результат стресс-теста является важнейшим фактором принятия решения о реваскуляризации. Иллюстрации этого факта будут приведены ниже при рассмотрении вариантов конкретных клинических ситуаций.
В связи этим результат стресс-теста является важнейшим фактором принятия решения о реваскуляризации. Иллюстрации этого факта будут приведены ниже при рассмотрении вариантов конкретных клинических ситуаций.
Показания к реваскуляризации с целью улучшения прогноза. Ниже описаны основные клинические ситуации, при которых необходимо решить вопрос о целесообразности реваскуляризации с целью улучшения прогноза. В случаях, когда при ангиографически значимом поражении любого характера имеются лимитирующие ангинозные боли, показания к реваскуляризации определяются на основании симптомов, поэтому здесь они не обсуждаются.
Показания к реваскуляризации при коронарной анатомии высокого риска. Как следует из табл. 3, в опубликованных до 2012 г. рекомендациях, даже в большинстве случаев коронарной анатомии высокого риска (исключение составляет поражение ствола ЛКА, согласно данным M.R. Patel и соавт. [1]) реваскуляризация считалась целесообразной при подтверждении функциональной значимости поражений или при снижении ФВ ЛЖ. Очевидно, у пациентов, имеющих анатомически тяжелое поражение коронарного русла, но при этом хорошие результаты функциональных тестов, фактический риск ниже, чем при аналогичных данных КГ, но неблагоприятных результатах стресс-теста, и реваскуляризация у них считалась менее оправданной. Так, при поражении трех сосудов с нормальной ФВ ЛЖ и низким риском по неинвазивному тесту целесообразность реваскуляризации оценивается в 5 баллов из 9 возможных, а при аналогичных параметрах, но умеренном риске по стресс-тесту — в 9 баллов [1].
Вместе с тем, согласно опубликованным в 2012 г. рекомендациям американских кардиологических сообществ по лечению стабильной ИБС [5], выявление коронарной анатомии высокого риска, независимо от результатов стресс-теста, служит показанием к реваскуляризации (см. табл. 3). Исключение составляет вариант коронарной анатомии высокого риска с изолированным поражением ПМЖА — в этой ситуации новые американские рекомендации, как и предшествующие стандарты, рекомендуют реваскуляризацию только при положительном стресс-тесте, прежде всего, когда провоцируется обширная ишемия ЛЖ. Естественно, возникает вопрос, с чем связаны такие изменения. Прямой ответ на него дать затруднительно. Во всяком случае, авторы Рекомендаций 2012 г. в обосновании своей позиции ссылаются на работы, датированные 1981—2006 гг., которые, очевидно, были известны и ранее, и никаких новых данных, подтверждающих свой подход, не приводят [5].
Показания к реваскуляризации у пациентов без коронарных поражений высокого риска (табл. 4). В отсутствие наиболее неблагоприятных вариантов коронарных поражений реваскуляризация показана только при неинвазивном тесте высокого риска. Более жестко (реваскуляризация «возможна» вместо «показана») формулируются показания к вмешательству при хронической окклюзии из-за его технической сложности и более высокого риска развития осложнений.
 У перенесшего КШ пациента в отсутствие симптомов показанием к реваскуляризации служит поражение венозного шунта в сочетании с высоким риском по неинвазивному тесту. При поражении нативных нешунтированных сосудов и полной проходимости шунтов подход к выбору тактики такой же, как у пациентов без КШ в анамнезе.
У перенесшего КШ пациента в отсутствие симптомов показанием к реваскуляризации служит поражение венозного шунта в сочетании с высоким риском по неинвазивному тесту. При поражении нативных нешунтированных сосудов и полной проходимости шунтов подход к выбору тактики такой же, как у пациентов без КШ в анамнезе.
В последних рекомендациях по стабильной ИБС [5] показания к реваскуляризации в отсутствие поражений высокого риска не имеют принципиальных отличий. Авторы указывают на то, что целесообразность реваскуляризации для улучшения прогноза у пациентов со значимым сужением 1—2 КА без вовлечения проксимального отдела ПМЖА и без обширной зоны ишемии неясна.
Особо выделяют пациентов, перенесших клиническую смерть на фоне желудочковой тахикардии предположительно ишемического генеза и имеющих значимый стеноз КА любой локализации — им рекомендуется реваскуляризация с прогностической целью [5].
Роль выявления жизнеспособного миокарда в выборе тактики лечения. Концепция жизнеспособного миокарда (ЖМ) появилась в 80-х гг. XX века — в период широкого внедрения операций КШ. Оказалось, что после КШ примерно у 1/3 пациентов наблюдается улучшение глобальной функции ЛЖ. Такой результат был связан с улучшением сократимости ЛЖ в зоне, где до операции наблюдалась гипо- или акинезия. Так появилось представление о ЖМ у больного ИБС: состоянии, при котором наблюдается хроническое снижение сократительной активности миокарда в покое и возможно восстановление функции в результате коронарной реваскуляризации [17].
Механизмами существования ЖМ могут служить гибернация или повторяющееся станнирование [18]. В обоих случаях снижение сократимости является адаптацией к сниженному на фоне коронарного стеноза кровоснабжению. Для обнаружения ЖМ применяют те же визуализирующие тесты, что и для диагностики ишемии, однако используются другие протоколы исследований [19].
Принципы, используемые для диагностики ЖМ с помощью разных методик, различны. Стресс-ЭхоКГ с фармакологической нагрузкой позволяет выявить сократительный резерв в зоне дисфункции ЛЖ; с помощью ОФЭКТ осуществляется оценка перфузии миокарда и сохранности функциональных ультраструктур кардиомиоцитов; ПЭТ позволяет получить доказательство метаболической активности пораженного миокарда. При хронической сократительной дисфункции ЛЖ при ИБС ЖМ выявляется в зависимости от методики определения в 37—61% сегментов ЛЖ [17, 20].
При наличии как минимум среднего объема ЖМ (>3 сегментов ЛЖ) в зоне планируемой реваскуляризации пациентам с легкой или умеренной систолической дисфункцией ЛЖ (ФВ 35—50%) и значимым многососудистым поражением или поражением проксимального отдела ПМЖА вмешательство считается показанным для улучшения прогноза даже в отсутствие провоцируемой ишемии [2, 5]. Обоснованием такого подхода служат, в частности данные A. Schinkel и соавт. [20]. Обобщив результаты 24 исследований у пациентов со сниженной сократимостью ЛЖ, авторы указывают на равноценность реваскуляризации и ОМТ в отсутствие ЖМ и значительное преимущество реваскуляризации при наличии ЖМ (рис. 1).
 Между тем в отношении пациентов с резким снижением ФВ ЛЖ (<35%), т.е. фактически имеющих наиболее высокий риск, прогностическая эффективность реваскуляризации значительно менее ясна. Действительно, у этих больных наиболее высок и периоперационный риск, что нивелирует потенциальный долгосрочный положительный эффект операции [21]. В недавно опубликованном исследовании STICH [22] выживаемость в группах хирургического и медикаментозного лечения среди пациентов с ФВ ЛЖ<35% не различалась. Высокий риск развития операционных осложнений у больных с резко сниженной ФВ ЛЖ обусловливает весьма небольшую их долю в общем числе пациентов, которым выполняется КШ — около 15% от всего числа оперируемых больных ИБС [21].
Между тем в отношении пациентов с резким снижением ФВ ЛЖ (<35%), т.е. фактически имеющих наиболее высокий риск, прогностическая эффективность реваскуляризации значительно менее ясна. Действительно, у этих больных наиболее высок и периоперационный риск, что нивелирует потенциальный долгосрочный положительный эффект операции [21]. В недавно опубликованном исследовании STICH [22] выживаемость в группах хирургического и медикаментозного лечения среди пациентов с ФВ ЛЖ<35% не различалась. Высокий риск развития операционных осложнений у больных с резко сниженной ФВ ЛЖ обусловливает весьма небольшую их долю в общем числе пациентов, которым выполняется КШ — около 15% от всего числа оперируемых больных ИБС [21].
В последних рекомендациях целесообразность реваскуляризации с основной или единственной целью улучшения прогноза у пациентов с тяжелой систолической дисфункцией ЛЖ (ФВ<35%) определяется как сомнительная, независимо от наличия ЖМ [5].
Выбор методики реваскуляризации
В основных исследованиях, в которых показано преимущество реваскуляризации над консервативным лечением, в качестве методики реваскуляризации использовалось КШ. Вместе с тем наряду с активным развитием интервенционного лечения ИБС возник естественный вопрос о том, может ли чрескожное коронарное вмешательство (ЧКВ) быть альтернативой КШ, особенно с точки зрения влияния на прогноз.
Выбор методики реваскуляризации, целью которой является облегчение симптомов. По результатам многочисленных исследований, КШ и ЧКВ обеспечивают сопоставимый эффект в плане облегчения ишемических симптомов. ЧКВ дает несколько менее полный антиишемический эффект и чаще сопровождается необходимостью в повторной реваскуляризации [23], что в значительной мере компенсируется меньшим риском, связанным с самой процедурой. КШ обычно предпочтительнее проводить в следующих обстоятельствах:
- высокий балл по SYNTAX (>22) при низком операционном риске;
- невозможность использования двухкомпонентной антитромбоцитарной терапии;
- сахарный диабет (СД).
У пациента, имеющего анамнез КШ и поражение нативного нешунтированного сосуда или венозного шунта, наоборот, предпочтительнее ЧКВ [5].
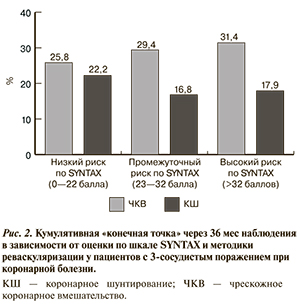
Выбор методики реваскуляризации, целью которой является улучшение прогноза. Возможность улучшить прогноз тяжелобольного ИБС, не прибегая к операции, конечно, очень привлекательна. Исследования по сравнению результатов КШ и ЧКВ в плане кардиального прогноза дали разнородные результаты для разных категорий пациентов, и все они пока не окончательны (табл. 5). Есть вероятность, что ЧКВ может не уступать КШ в отношении прогноза у ряда пациентов с поражением ствола ЛКА (в отсутствие сопутствующего множественного поражения коронарного русла, SYNTAX <33 баллов). Аналогичным образом результаты ЧКВ могут быть сопоставимы с результатами КШ при изолированном проксимальном стенозе ПМЖА [24—26]. В исследовании SYNTAX, в котором пациенты с 3-сосудистой коронарной болезнью были рандомизированы в группы ЧКВ и КШ, кумулятивная «конечная точка» при 3-летнем наблюдении не различалась при оценке по шкале SYNTAX <23 баллов; при оценке по шкале SYNTAX 23—32 балла исходы в группе ЧКВ были несколько хуже, чем в группе КШ; при оценке >32 баллов результаты КШ значительно превосходило ЧКВ (рис. 2) [27].
Следовательно, 3-сосудистое поражение с оценкой по шкале SYNTAX <22 баллов можно отнести к ситуациям, когда ЧКВ прогностически равноценна КШ (см. табл. 5). В то же время убедительных данных о влиянии ЧКВ на прогноз у больных с низкой ФВ ЛЖ в настоящее время нет, поэтому в этой категории пациентов методикой выбора остается КШ [28]. Это же, как правило, относится к пациентам с СД.
Обнадеживающие результаты сравнения ЧКВ и КШ в отношении влияния на прогноз дали основания предположить, что ЧКВ в ее современном виде у некоторых категорий больных стабильной ИБС может продемонстрировать превосходство над ОМТ. Так ли это на самом деле?
ОМТ или ЧКВ для улучшения прогноза? Исследование COURAGE. В последние 5 лет, говоря о выборе тактики лечения при стабильной ИБС, обязательно упоминают исследование COURAGE [29, 30], которое до недавнего времени оставалось единственным рандомизированным сравнением ОМТ и ЧКВ в длительном наблюдении у пациентов этой категории. Большинству кардиологов известны основные выводы, сделанные на основании результатов этого исследования: по сравнению с ОМТ ЧКВ при стабильной ИБС не уменьшает риск смерти, развития острого ИМ (ОИМ) или иных тяжелых сердечно-сосудистых осложнений. В то же время в исследование COURAGE не включались пациенты с характеристиками наиболее высокого риска (IV функциональный класс стенокардии; резко положительный стресс-тест; ФВ ЛЖ<30%; коронарная анатомия, исключающая ЧКВ). Средний уровень нагрузки при стресс-тесте составлял более 7 МЕТ, что, как правило, соответствует низкому коронарному риску. Поражение трех сосудов или проксимального отдела ПМЖА наблюдалось только у 1/3 пациентов. При этом число пациентов с СД было необычно большим — 32% в группе ЧКВ, а 97% стентирований осуществлялось стентами без лекарственного покрытия. Оба последних обстоятельства могут быть ответственны за увеличение числа осложнений в группе ЧКВ.
Учитывая эти данные, некорректно констатировать отсутствие эффекта ЧКВ по сравнению с ОМТ применительно ко всем пациентам со стабильной ИБС. Однако такой вывод, очевидно правомочен в отношении пациентов, не имеющих характеристик высокого риска и в случаях ЧКВ с использованием металлических стентов.
Исследования FAME и FAME 2. В исследовании FAME [31] при рандомизации учитывали показатель фракционного резерва кровотока (ФРК) — отношение давления дистальнее стеноза к давлению в аорте, измеренному в условиях гиперемии. ФРК представляет собой индекс физиологической значимости стеноза КА. ФРК≤0,80 выявляет стеноз, ответственный за ишемию, с 90% точностью [32, 33].
Направленные на ЧКВ 1005 пациентов с многососудистым поражением были разделены на 2 группы. В 1-й группе проводилось стентирование всех поражений, значимых по ангиографическим критериям (стеноз ≥50%); во 2-й стентировали только те поражения, в которых стеноз был значимым и по ангиографическим критериям, и по величине ФРК. Следует отметить, что из 1387 стенозов, в которых измерялся ФРК, 513 (37%) оказались физиологически незначимыми (ФРК>0,80). Двухлетнее наблюдение показало, что уменьшение числа стентирований (фактически за счет отмены «ненужных») не оказало негативного влияния на смертность и, напротив, привело к уменьшению числа ИМ. Из этого можно сделать вывод, что проведение ЧКВ оправдано только на физиологически значимых стенозах.

Результаты FAME легли в основу исследования FAME 2, в котором вновь была сделана попытка выявить прогностическое преимущество ЧКВ над ОМТ [34].
ФРК был измерен у 1220 пациентов со стабильной ИБС, после чего больные с ФРК≤0,80 (n=888) были рандомизированы в группы ОМТ и ЧКВ (использовались стенты с лекарственным покрытием). Пациенты с ФРК>0,80 вошли в группу наблюдения и получали ОМТ. Через 1 год наблюдения различий по смертности и частоте развития ОИМ между тремя группами выявлено не было, а случаев нестабильной стенокардии, требующей реваскуляризации, было достоверно больше в группе пациентов с ОМТ по сравнению с двумя другими группами. Из этого можно заключить, что если при стабильной ИБС значимость стеноза доказана (ФРК), его реваскуляризация с помощью ЧКВ уменьшает частоту некоторых кардиальных осложнений, не влияя на общую смертность.
В свете этих данных становятся ясны часто цитируемые результаты R. Hachamovitch и соавт. [16] (рис. 3), которые продемонстрировали преимущество реваскуляризации над ОМТ при наличии провоцируемой ишемии, превышавшей 10% площади ЛЖ. Однако поскольку в группу реваскуляризации были объединены пациенты, перенесшие ЧКВ и КШ, этот результат был, вероятно, достигнут за счет влияния КШ. Прогностическое преимущество ЧКВ над ОМТ при стабильной ИБС при их прямом сравнении убедительно не подтверждено.
В связи с этим основным методом реваскуляризации для улучшения прогноза при стабильной ИБС остается КШ (табл. 6) [5]. Исключение составляют: 1) пациенты c поражением ствола ЛКА при балле SYNTAX <22 и высоком риске смерти при операции (балл риска по шкале STS≥5% [35]); 2) пациенты, перенесшие клиническую смерть на фоне желудочковой тахикардии ишемического генеза.
Заключение
Выбор между реваскуляризацией и консервативной тактикой у пациента со стабильной формой ишемической болезни сердца нередко вызывает затруднения у клиницистов, особенно, когда необходимость реваскуляризации не диктуется тяжелыми ишемическими симптомами.
В этом случае целесообразность реваскуляризации определяется ее способностью улучшить прогноз пациента.
Прогностические преимущества реваскуляризации наиболее доказаны в отношении пациентов, имеющих анатомические и функциональные характеристики высокого риска, причем анализ действующих рекомендаций показывает ключевую роль функционального теста. Именно стресс-тест высокого риска выделяет пациентов, в первую очередь нуждающихся в реваскуляризации, среди лиц с тяжелым поражением коронарных артерий, а также позволяет выбрать кандидатов для инвазивного лечения среди больных без неблагоприятных вариантов коронарных поражений. У больных со сниженной сократимостью левого желудочка нагрузочные тесты с визуализацией миокарда позволяют дифференцировать жизнеспособный миокард и необратимое повреждение в зоне дисфункции. Наличие достаточного объема жизнеспособного миокарда даже в отсутствие других параметров высокого риска определяет преимущество реваскуляризации над медикаментозной терапией.
Сопоставление прогностической эффективности чрескожного коронарного вмешательства и коронарного шунтирования у некоторых категорий больных стабильной формой ишемической болезни сердца дало обнадеживающие результаты. Тем не менее, несмотря на большую привлекательность возможной замены операции интервенционным лечением, улучшение выживаемости при использовании чрескожного коронарного вмешательства в прямом сравнении с оптимальной медикаментозной терапией убедительно не подтверждено. Выполнение чрескожного коронарного вмешательства для улучшения прогноза при стабильной форме ишемической болезни сердца пока ограничено весьма узким кругом показаний и основным ее предназначением остается облегчение симптомов ишемии.



