Как известно, желудочковые нарушения ритма высоких градаций являются основной причиной внезапной смерти (ВСС) у больных ишемической болезнью сердца (ИБС) [1]. Профилактика ВСС — сложная проблема, поскольку медикаментозное лечение зачастую не дает ожидаемого эффекта.
Более того, как было показано в исследованиях CAST I и CAST II, применение высокоэффективных антиаритмическиx препаратов 1С группы у больных ИБС сопровождается увеличением числа случаев ВСС [2, 3]. Широкое применение имплантируемых кардиовертеров-дефибрилляторов (ИКД) для
профилактики ВС, с одной стороны, ограничено в силу причин экономического характера, с другой стороны, не исключает применения антиаритмических препаратов [4, 5]. У больных с пароксизмами неустойчивой желудочковой тахикардии без левожелудочковой дисфункции вопрос об установке ИКД
не ставится, хотя эти нарушения ритма могут рассматриваться как потенциально жизнеопасные [6,7].
В настоящее время в России преобладает консервативный подход к лечению желудочковых аритмий (ЖА), при этом показатели смертности остаются недопустимо высокими, в связи с чем оправдано внедрение высокотехнологичных методов лечения, а также поиск более эффективных безопасных антиаритмических средств, способных снизить выраженность ЖА у пациентов с ИБС.
Одним из новых направлений в лечении аритмий является upstream-терапия, направленная на модификацию условий аритмогенеза, в частности, применение омега-3 полиненасыщенных жирных кислот (ω-3 ПНЖК 90%). Многочисленные проспективные исследования показали обратную корреляцию между количеством употребляемой рыбы (содержащей большое количество ω-3 ПНЖК) и смертностью у пациентов с ИБС [8—12]. Между тем, в рыбе, кроме ω-3 ПНЖК содержится определенное количество ω-6 ПНЖК и насыщенных жирных кислот, препятствующих полному проявлению позитивных эффектов ω-3 ПНЖК, что привлекает внимание к препаратам, представляющим собой высокоочищенный концентрат ω-3 ПНЖК.
Свидетельства влияния ω-3 ПНЖК на патогенез аритмий получены на экспериментальных моделях [13,14], в лабораторных исследованиях in vitro [15,16] и в исследованиях у человека [17,18]. Экспериментальные данные, полученные на модели ишемии-реперфузии миокарда in vivo, позволили
обнаружить способность ω-3 ПНЖК не только снижать частоту возникновения и выраженность ишемических и реперфузионных тахиаритмий, но и ограничивать размер зоны инфаркта [19], что указывает на перспективность их применения у больных ИБС.
К настоящему времени проведены крупные исследования, свидетельствующие о том, что потребление ω-3 ПНЖК приводит к снижению сердечно-сосудистого риска. В одном из первых подобных исследований DART [20] было показано, что применение ω-3 ПНЖК снижает смертность больных,
перенесших инфаркт миокарда (ИМ), на 29% по сравнению с группой плацебо. Результаты, полученные в исследовании DART, согласуются с данными исследования GISSI-Prevenzione [21], которое показало, что прием больными, перенесшими ИМ, высокоочищенного концентрата ω-3 ПНЖК (омакор)
снижал риск смерти от всех причин на 20%, от сердечно-сосудистых заболеваний — на 30%, от ИБС — на 35% и внезапной смерти — на 45%. Однако следует отметить, что в этих исследованиях не проводилось суточное мониторирование ЭКГ, поэтому невозможно оценить ни выраженность ЖА у этих пациентов, ни прямое влияние рецептурного лекарственного препарата 90% ω-3 ПНЖК (омакора) на ЖА высоких градаций. Можно лишь предполагать, что снижение частоты ВС связано с влиянием на жизнеугрожающие аритмии. Результаты исследования GISSI-HF [22] показали снижение смертности у больных с сердечной недостаточностью на 9% при приеме рецептурного лекарственного препарата 90% ω-3 ПНЖК, причем эффективность была выше у пациентов с фракцией выброса менее 40%. Было отмечено снижение частоты госпитализаций по поводу ЖА на 28%, а снижение общей
смертности ассоциировалось с меньшим числом летальных исходов вследствие предполагаемой аритмии.
Между тем, на сегодняшний день явно недостаточно данных, в которых бы оценивалась способность ω-3 ПНЖК влиять на ЖА высоких градаций у пациентов с хронической ИБС, не переносивших ИМ и не имеющих проявлений сердечной недостаточности. К сожалению, многие исследователи и авторы мета-анализов работ, касающихся применения ω-3 ПНЖК, делают выводы об их эффективности, основываясь на результатах, полученных при использовании как лекарственных препаратов, так и биодобавок, а то и просто диетических рекомендаций [23]. Некоторые исследования были проведены с применением неоправданно низких доз [24] либо тех жирных кислот, эффективность которых еще
не исследована [24].
Целью нашей работы стала оценка влияния этиловых эфиров эйкозапентаеновой и докозагексаеновой ПНЖК на ЖА высоких градаций у пациентов со стабильной ИБС, не имеющих значительной сократительной дисфункции левого желудочка, преимущественно, у больных без ИМ в анамнезе.
Материал и методы
В исследовании участвовали 43 больных (27 мужчин и 16 женщин, средний возраст 66,2±8,3 года) с верифицированной ИБС, у которых при проведении холтеровского мониторирования ЭКГ обнаружены желудочковые нарушения ритма V градации по классификации М. Ryan в модификации W. McKennа.
Критериями исключения были любые проявления нестабильности заболевания в течение предшествующих 3 мес, хроническая сердечная недостаточность III—IV класса, снижение
фракции выброса менее 45%, тяжелые декомпенсированные сопутствующие заболевания, изменения в характере терапии в течение предшествующего месяца, невозможность оставаться на стандартной терапии основного заболевания, не изменяя ее в течение всего исследования, вероятность несоблюдения расписания визитов по любой причине.
Диагноз ИБС подтвержден либо наличием перенесенного инфаркта миокарда, либо данными коронарографии, либо положительными результатами стресс-тестов, выполненных в любые сроки до включения в исследование. У всех больных клинически установлен диагноз стабильной стенокардии,
в том числе II функционального класса у 32, III — у 11 пациентов. 14 (32,5%) пациентов в сроки от 1,5 до 6 лет до включения в исследование перенесли инфаркт миокарда. Операцию аортокоронарного шунтирования перенесли 2 пациента, транслюминальную баллонную ангиопластику со стентированием — 3. Гипертоническая болезнь выявлена у 26 (60,5%) обследованных, в том числе I степени — у 5, II степени — у 15, III степени — у 6 включенных в исследование. Клиническая
характеристика пациентов представлена в табл. 1.
Все пациенты получали стандартную основную терапию, которая была неизменной как минимум в течение месяца до включения и в течение всего периода исследования; 90,7% больных получали дезагреганты, 76,7% — статины, 74,4% — блокаторы ренин-ангиотензиновой системы, 65,1% — пролонгированные нитраты, 18,6% — антагонисты кальция, 53,3% — β-адреноблокаторы, в том числе 11,6% — соталол, 11,6% — амиодарон. Таким образом, препараты, обладающие антиаритмической активностью в отношении желудочковых нарушений ритма, получали 28 (64,9%) пациентов. Учитывая, что у включенных в исследование аритмии не вызывали нарушений гемодинамики, не были связаны с расстройствами электролитного баланса или побочными эффектами лекарственных препаратов, мы сочли возможным не изменять ранее назначенной терапии.
Таблица 1. Клиническая характеристика пациентов и проводимая терапия.
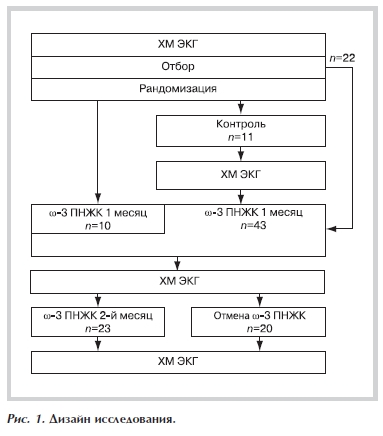
Дизайн исследования (рис. 1). После подписания информированного согласия на первом, рандомизированном этапе 10 больных в дополнение к основной терапии получали 1 г рецептурного лекарственного препарата 90% ω-3 ПНЖК, за 11 осуществлялось динамическое наблюдение без изменения основной терапии. Выявив очевидные преимущества терапии исследуемым препаратом по результатам повторного мониторирования ЭКГ, мы сочли целесообразным всех больных контрольной группы и вновь отобранных пациентов включить в группу активного лечения. Всего терапию рецептурным лекарственным препаратом 90% ω-3 ПНЖК в течение месяца получили 43 пациента. В дальнейшем вновь проводилась рандомизация, по результатам которой 23 пациента продолжили прием рецептурного лекарственного препарата 90% ω-3 ПНЖК в течение еще одного месяца, а 20 пациентам препарат был отменен. Через месяц суточное мониторирование ЭКГ выполнено всем пациентам из группы активного лечения и 18 из контрольной группы. Двое из 20 пациентов от выполнения повторного мониторирования отказались, при этом их состояние оставалось стабильным. После завершения исследования всем было рекомендовано продолжить или возобновить прием
рецептурного лекарственного препарата 90% ω-3 ПНЖК. Холтеровское мониторирование проводилось с использованием аппаратно-программного комплекса CARDIODAY HOLTER GE Healthcare (USA). Длительность исследования в среднем составляла 24+1,2 ч.
Полученные результаты обрабатывались с помощью статистической программы SPSS v15.0 for Windows. Использовали корреляционный и регрессионный анализ, парный критерий Вилкоксона для оценки достоверности различий изменений в группе и U тест Манна—Уитни для оценки достоверности
различия между группами. При p<0,05 различия считали достоверными.
Результаты
По данным исходного холтеровского мониторирования ЭКГ у всех пациентов на фоне синусового ритма регистрировались частые желудочковые экстрасистолы, парные экстрасистолы и от 1 до 6 пароксизмов неустойчивой желудочковой тахикардии, включающих от 3 до 9 комплексов в цикле. Желудочковая
эктопическая активность во всех случаях регистрировалась преимущественно в дневное время, у 17 (37,2%) больных определялась связь аритмий с выполнением физической нагрузки. Между тем ни у одного из включенных в исследование прямой связи аритмии с клиническими или электрокардиографическими признаками ишемии миокарда не выявлялось. Ишемическая депрессия сегмента ST выявлена только у 8 человек, степень смещения лишь в одном случае достигала 1,4 мм, у остальных не превышала 1,2 мм; при этом продолжительность эпизодов ишемии была не более 80 с, максимальная суммарная продолжительность ишемии составляла 440 с. Таким образом, ни у кого из включенных в исследование пациентов не имелось показаний к экстренной реваскуляризации миокарда, равно как и показаний к установке ИКД [6].
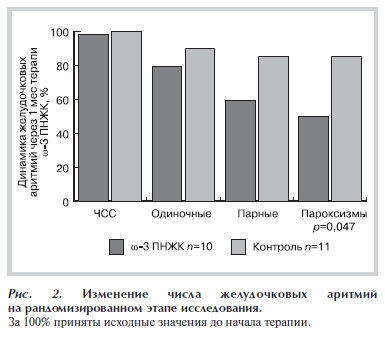
Как следует из рис. 2, представляющего результаты первой, рандомизированной фазы исследования, добавление к основному лечению рецептурного лекарственного препарата 90% ω-3 ПНЖК привело к достоверному уменьшению желудочковой эктопической активности по сравнению с группой контроля.
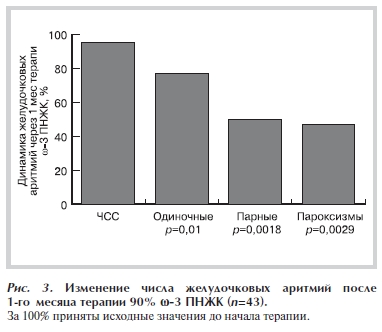
В группе, включающей всех 43 пациентов, которые получали исследуемый препарат в течение одного месяца (табл. 2), выявлено снижение среднесуточного значения ЧСС на 2,4%, уменьшение количества одиночных экстрасистол на 20,1% (p=0,01), парных экстрасистол на 47% (р=0,0018), числа пароксизмов желудочковой тахикардии на 49% (p=0,0029; рис. 3). У 18 (41,9 %) человек при повторном мониторировании не зафиксировано пароксизмов желудочковой тахикардии, из них 8 (18,6%) из V градации перешли в IV, 9 (20,9%) – в IIIБ и 1 (2,3%) – в IIIА градацию аритмии. Продолжение приема препарата в течение второго месяца сопровождалось дополнительным уменьшением числа одиночных экстрасистол на 17,5%, парных экстрасистол на 33,4%, а числа пароксизмов ЖТ на 29,6%. В группе прекративших прием рецептурного лекарственного препарата 90% ω-3 ПНЖК число одиночных эктопических комплексов по сравнению с первым месяцем
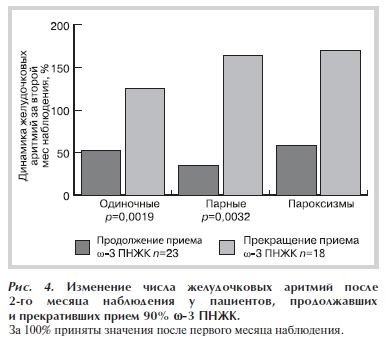
увеличилось на 8,7%, парных на 26,2%, пароксизмов ЖТ на 66,7%, но при этом число аритмий не достигло исходных значений (рис. 4).
Корреляционный анализ не выявил связи эффективности препарата с клинико-функциональными параметрами, факторами риска и наличием ИМ в анамнезе, а также с характером основной терапии ни в одной из сформированных групп (максимальное значение коэффициента корреляции не превышало 0,18).
У больных, у которых 30-дневная терапия рецептурным лекарственным препаратом 90% ω-3 ПНЖК сопровождалась исчезновением пароксизмов желудочковой тахикардии, исходное число пароксизмов было достоверно меньшим, чем в группе пациентов, у которых пароксизмы сохранялись: 1,44±0,78 и 3,16±2,57 соответственно (р=0,003).
Следует отметить, что препарат переносился хорошо, ни одного случая ухудшения состояния не отмечено ни во время его приема, ни после отмены.
Обсуждение
Участие системы эйкозаноидов, к которым относятся ω-3 ПНЖК, в аритмогенезе в настоящее время убедительно доказано [13-18]. Содержание ω-3 ПНЖК в мембранах кардиомиоцитов отражает индекс ω-3, который представляет собой отношение ω-3 ПНЖК к другим жирным кислотам [25]. В клинических исследованиях установлено, что при приеме рецептурного лекарственного препарата 90% ω-3 ПНЖК
в дозе 1 г/сут в течение 22 дней индекс ω-3 достигает более 8% , что ассоциируется с достижением оптимального уровня мембраностабилизирующего эффекта [26]. Таким образом, временной промежуток 4 нед достаточен для реализации антиаритмического потенциала ω-3 ПНЖК. Этим и обусловлены выбранные нами сроки приема этого препарата.
Таблица 2. Характеристика желудочковых нарушений ритма у пациентов, получавших терапию 90% ω-3 ПНЖК в течение 1 мес.
Влияние ω-3 ПНЖК на желудочковые аритмии высоких градаций изучено в основном у пациентов со сниженной сократительной функцией миокарда и клиническими проявлениями сердечной недостаточности. Доля больных ИБС в этих исследованиях составляла 73—76%; в остальном это были пациенты с аритмиями неишемического генеза. Эффективность оценивалась по срокам срабатывания ИКД [27–29]. Таким образом, включались только пациенты с очень высокой степенью риска ВСС. По результатам 2 исследований сделан вывод об отсутствии убедительных преимуществ от добавления к терапии ω-3 ПНЖК [27–28]. Следует заметить, что в обоих случаях был использован рыбий жир.
Между тем, установлено, что жирные кислоты в составе рыбьего жира в значительной мере подвергаются окислению и приобретают агрессивные свойства в отношении клеточных мембран. Кроме того, в самом рыбьем жире содержатся источники активных форм кислорода и токсичные вещества. По-видимому, это не может не отражаться на результатах его клинического применения. Исследования высокоочищенных высококонцентрированных эйкозапентаеновой и докозагексаеновой ПНЖК в виде этиловых эфиров показали их большую устойчивость к окислению и значительно
меньшее содержание альдегидов [30]. Возможно, именно это объясняет положительное влияние ω-3 ПНЖК на аритмии в исследовании A. Leaf и соавт. [29], в котором применялись именно этиловые эфиры этих кислот.
Свое исследование мы проводили на пациентах с ИБС, имеющих сохранную ФВ и ЖА высоких градаций. Прием рецептурного лекарственного препарата 90% ω-3 ПНЖК в дозе 1 г/сут вызывал достоверное уменьшение их выраженности . Особенный интерес представляет снижение класса
аритмий у 41,9% пациентов, связанное с исчезновением пароксизмов желудочковой тахикардии, что следует рассматривать как снижение уровня жизнеопасности нарушений ритма сердца. Однако надо иметь в виду, что пароксизмы исчезли лишь у тех пациентов, у которых, как правило, было 1—2 пароксизма за период суточного мониторирования. И следует учитывать, что это были больные, не имеющие грубых органических осложнений ишемической болезни сердца. Возможно, у пациентов с более выраженными аритмиями и большей степенью структурно-функциональных нарушений сердца в развитии желудочковых тахиаритмий могут иметь значение другие патофизиологические механизмы, менее зависимые от соотношения различных типов жирных кислот в мембранах кардиомиоцитов. Между тем, есть все основания предполагать пользу от применения ПНЖК 90% при желудочковых аритмиях, связанных с ИБС независимо от механизмов аритмогенеза (рис. 3, 4).
Мы сочли этически возможным и безопасным для пациентов реализацию данного протокола исследования в данной группе больных ИБС, так как систематическое профилактическое назначение антиаритмических препаратов даже у лиц с признаками сократительной левожелудочковой дисфункции и асимптомными непродолжительными желудочковыми тахикардиями не рекомендуется, так как это не оказывает благоприятного влияния на показатели смертности [31].
Выявленные желудочковые нарушения ритма высоких градаций у пациентов со стабильной ИБС, тем не менее, не могут быть проигнорированы. При сохраненной сократительной функции левого желудочка , в отсутствие выраженных гемодинамических нарушений, обусловленных аритмией (синкопе, пресинкопе, стенокардия, гипотензия, нарастание проявлений сердечной недостаточности), вопрос об установке ИКД этим больным не рассматривается. Несомненно, что прежде всего нам
необходимо было исключить возможные корригируемые причины аритмии, в частности, электролитные нарушения, а также ее непосредственную связь с ишемией миокарда (дестабилизация течения ИБС). В последнем случае, следовало бы обсуждать возможность коронарного интервенционного или хирургического лечении и/или усиления антиишемической терапии, прежде всего, увеличения
дозы β-адреноблокаторов, что не всегда осуществимо по техническим причинам и/или из-за наличия противопоказаний, а также не всегда оказывается эффективным. Не следует забывать и о возможной проаритмии в случае, когда больной уже получает антиаритмические препараты (в нашем исследовании 23,2% пациентов получали препараты 3-го класса). Мы также не можем исключить и наличие возможного сочетанного антиаритмического эффекта от назначения рецептурного лекарственного препарата 90% ω-3 ПНЖК и антиаритмиков 3-го класса в этих клинических случаях. Однако, полученные в настоящей работе данные убедительно свидетельствуют о целесообразности
применения ω-3 ПНЖК у больных со стабильной ИБС и желудочковыми аритмиями. Следует иметь в виду, что результаты получены при использовании рецептурного лекарственного препарата 90% ω-3 ПНЖК (омакор) и вряд ли должны распространяться на другие формы ω-3 ПНЖК. По-видимому, препарат следует принимать неопределенно долго, так как его способность снижать выраженность
аритмии постепенно возрастает, а после отмены эффект заметно уменьшается.
Ограничения исследования. Недостатком нашей работы является отсутствие плацебо-контроля, что вызвано невозможностью приобретения капсул, имеющих внешний вид исследуемой лекарственной формы и нейтральное содержимое, не содержащее каких-либо жирных кислот, т. к. последние не могут рассматриваться в качестве индифферентных в отношении аритмогенеза, пока обратное не будет убедительно доказано. Все предлагаемые желатиновые капсулы для плацебо содержат жировые субстанции.
Работа выполнена при поддержке Министерства образования и науки РФ в рамках ФЦП «Научные и научно-педагогические кадры инновационной России на 2009—2013 гг.» (Гос. контракт П607 от 18.05.2010).



