Около 1/3 больных ишемической болезнью сердца (ИБС) умирают внезапно, но наиболее часто внезапная сердечная смерть (ВСС) регистрируется в течение первого года после развития инфаркта миокарда (ИМ) [1]. Проблема профилактики ВСС, особенно у больных, перенесших Q-ИМ, — одна из наиболее актуальных в кардиологии. По данным амбулаторного холтеровского мониторирования (ХМ) ЭКГ в момент наступления ВСС последняя, как правило, обусловлена фибрилляцией желудочков и трансформирующимися в нее желудочковыми аритмиями (примерно 80%) и реже — брадиаритмиями, переходящими в асистолию сердца [2]. Известно, что назначение β-адреноблокаторов, антитромбоцитарных препаратов, статинов, ингибиторов ангиотензинпревращающего фермента значительно улучшает долгосрочный прогноз больных с острым коронарным синдромом [3]. Однако при сопутствующих желудочковых тахиаритмиях вероятность осложнений аритмического генеза уменьшает возможность выживания больных. Применение имплантируемых кардиовертеров-дефибрилляторов увеличивает выживаемость, хотя высокая стоимость ограничивает их внедрение в широкую врачебную практику. Новые подходы в плане лечебно-профилактических мероприятий привели к использованию ω-3 ПНЖК. Влияние их на патогенез аритмий изучено на экспериментальных моделях, в лабораторных исследованиях in vitro и в исследованиях у человека [4]. Полученные экспериментальные данные свидетельствуют о способности ω-3 ПНЖК не только снижать частоту возникновения и выраженность ишемических и реперфузионных аритмий, но и ограничивать размер зоны инфаркта [5]. В исследовании DART продемонстрировано, что применение ω-3 ПНЖК снижает смертность больных, перенесших ИМ, на 29% по сравнению с группой плацебо [6]. Такие же данные получены и в исследовании GISSI-Prevenzione, которое показало, что назначение больным, перенесшим ИМ, высокоочищенного концентрата ω-3 ПНЖК (омакор) способствовало снижению риска сердечно-сосудистой смерти на 30%, внезапной смерти — на 45% [7, 8]. В приведенных исследованиях предполагалось, что снижение частоты ВСС связано с воздействием ω-3 ПНЖК на угрожающие жизни аритмии. В последующих исследовательских работах предпринимаются попытки оценить механизм антиаритмического действия ω-3 ПНЖК. В немногочисленных публикациях сообщается о влиянии ω-3 ПНЖК на динамику желудочковых экстрасистол высоких градаций у пациентов со стабильной стенокардией [9], а также у больных после перенесенного ИМ [5]. Единственная работа посвящена изучению динамики новых предикторов ВСС — турбулентности ритма сердца (ТРС) и микровольтной альтернации зубца Т на фоне терапии ω-3 ПНЖК у больных со стабильной формой ИБС [10]. В литературе мы не нашли сведений о влиянии ω-3 ПНЖК у больных ИМ на негомогенность реполяризации миокарда, замедленную фрагментированную желудочковую активность, эквивалентом которой являются поздние потенциалы желудочков (ППЖ).
Цель работы — оценка влияния ω-3 ПНЖК на динамику неинвазивных предикторов ВСС (желудочковые аритмии, длительность и вариабельность интервала QT, ППЖ, микровольтной альтернации зубца Т и ТРС) у больных Q-ИМ с желудочковыми нарушениями ритма (ЖНР).
Материал и методы
В исследовании участвовали 140 больных (мужчины, средний возраст 52,5±1,3 года) с верифицированным первичным диагнозом Q-ИМ, которым по тем или иным причинам не была проведена тромболитическая терапия и у которых при ХМ ЭКГ зарегистрированы ЖНР I—V градации (по В. Lown). Критериями исключения являлись несинусовый ритм, имплантированный кардиостимулятор, хроническая сердечная недостаточность IV класса, тяжелые сопутствующие заболевания в стадии декомпенсации, прием препаратов, содержащих ω-3 ПНЖК, в течение 6 мес, предшествующих включению в исследование, вероятность несоблюдения расписания визитов по любой причине, а также отказ от подписания информированного согласия на участие в исследовании.
В начале исследования все пациенты были рандомизированы (метод конвертов) на 2 группы по 70 человек: основную (А) и контрольную (В). Группы были сопоставимыми по основным демографическим и клиническим характеристикам (табл. 1). По степени тяжести аритмического синдрома больные основной и контрольной групп были разделены еще на 2 группы: А1—А2 и В1—В2. В группы А1 (n=39) и В1 (n=38) объединены пациенты с ЖНР I—III градации, в группы А2 (n=31) и В2 (n=32) — больные с ЖНР IV—V градации и пациенты с пароксизмальной желудочковой тахикардией (ЖТ). Все больные получали стандартную терапию ИМ (антитромботические препараты, β-адреноблокаторы, статины, нитраты, ингибиторы ангиотензинпревращающего фермента, амиодарон — по показаниям). Учитывая, что состояние больных в группах А2 и В2 было исходно тяжелее в плане ЖНР, им в 100% случаев были назначены препараты с антиаритмической активностью (амиодарон и β-адреноблокаторы; см. табл. 1). В основных группах А1 и А2 дополнительно к стандартной терапии назначался лекарственный препарат ω-3 ПНЖК (омакор, Abbott Healthcare Products) в дозе 1 г/сут, содержащий 46% этилового эфира эйкозапентаеновой кислоты, 38% этилового эфира докозагексаеновой кислоты и 4 мг α-токоферола. Терапия ω-3 ПНЖК продолжалась в течение 6 мес.
Таблица 1. Клиническая характеристика обследованных пациентов
Примечание. Данные представлены в виде абсолютного числа больных (%) или в виде МЃ}m. АГ — артериальная гипертензия; ИМТ — индекс массы тела; ИМ — инфаркт миокарда; ИБС — ишемическая болезнь сердца; ФК — функциональный класс, ХСН — хроническая сердечная недостаточность; АПФ — ангиотензинпревращающий фермент. Различия между основными клиническими показателями в группах статистически незначимы (р>0,05).
Всем включенным в исследование больным на 10—14-й день ИМ и через 6 мес проводили стандартное клиническое обследование, включающее дополнительно суточное ХМ ЭКГ (кардиорегистраторы «Кардиотехника-04—8М», ЗАО «ИНКАРТ», Санкт-Петербург). Корригированный интервал QТ (QТс) измеряли в течение всего времени мониторирования, вычисляли продолжительность регистрации удлиненного QТс >450 мс в абсолютных цифрах и в процентном соотношении, вариабельность QТс (varQTс) определяли как разницу между QТс max и QТс min за сутки.
Для выявления ППЖ автоматически выбирали более 100 участков ЭКГ (интервал 10 мин), на которых вычисляли минимальные, максимальные и средние значения продолжительности фильтрованного комплекса QRS на векторкардиограмме (TotQRS,мс), длительность участка от конца комплекса QRS на векторкардиограмме (точки S) до первой точки внутрь комплекса, превышающей 40 мкВ (LAS40, мс) и среднеквадратичную амплитуду последних 40 мс комплекса QRS (RMS40, мкВ). Критериями патологической ЭКГ высокого разрешения считали TotQRS >114 мс, RMS40 <20 мкВ, LAS40 >38 мс. Наличие, по крайней мере, двух из перечисленных критериев позволяло диагностировать ППЖ.
Анализ микровольтной альтернации Т-волны проводили автоматически в течение суток. Величину амплитуды альтернации вычисляли как корень из разницы между значением усредненного энергетического спектра и средним значением спектрального шума.
Для оценки ТРС автоматически определяли два показателя ТРС: начало турбулентности —(turbulence onset — ТO) и наклон турбулентности — (turbulence slope — TS). Значения ТО <0 и TS > 2,5 мс/RR считали нормальными, а ТО >0 и TS <2,5 мс/RR — патологическими.
Статистическую обработку данных осуществляли с помощью программ Biostat и Statistica for Windows 7,0. Все данные представляли в виде средних арифметических значений и средней ошибки (М±m). Для установления достоверности различий в группах сравнения использовались t критерий Стьюдента и критерий согласия Пирсона (χ2). Для первичного сравнения данных между группами использовали однофакторный дисперсионный анализ (ANOVA) с применением множественных сравнений в случае выявления достоверных различий. Парную взаимосвязь между непрерывными и независимыми признаками определяли путем использования регрессионных моделей с определением для значимых предикторов отношения шансов (ОШ) с 95% доверительным интервалом (ДИ). Различия считали достоверными при р<0,05.
Результаты
Мужчины, включенные в исследование, были трудоспособного возраста (52,7±1,5 года) с первичным Q-ИМ, ожирением I степени, сопутствующей артериальной гипертензией (29,3%), умеренно сниженной фракцией выброса (44,2±1,1%; см. табл. 1). По исходным данным ХМ ЭКГ пациенты основных и контрольных групп были сопоставимы. Во всех группах желудочковая эктопическая активность определялась, как правило, в дневное время. У больных Q-ИМ с ЖНР I—III градации (группы А1 и В1) желудочковая экстрасистолия сопровождалась признаками ишемических изменений на ЭКГ у 14 (35,9%) пациентов основной и у 16 (42,1%) контрольной группы продолжительность ишемии была 19,7±1,2 и 21,3±1,1 мин соответственно. В то же время среди пациентов со значительными ЖНР (группы А2 и В2) ишемическая депрессия сегмента ST регистрировалась соответственно у 20 (64,5%) и 20 (62,5%), продолжительность ишемии составляла 25,9±1,2 и 24,2±1,3 мин.
На фоне терапии ω-3 ПНЖК в основных группах (А1 и А2) отмечалось достоверное уменьшение ЖЭ. Так, число одиночных ЖЭ в группе А1 уменьшилось на 66,3% (р<0,001), в группе А2 на — 75,9% (р<0,001; рис. 1). В контрольных группах (В1 и В2) подобных достоверных сдвигов не отмечено. Выраженные позитивные изменения касались больных с ЖНР IV—V градации после применения ω-3 ПНЖК (табл. 2). Так, через 6 мес терапии отмечалось достоверное уменьшение парных ЖЭ на 72,1% (р<0,001), эпизодов неустойчивой ЖТ (ЖТн) на — 77,9% (р<0,001; рис. 2, 3). Уменьшилась суммарная продолжительность ишемии в основных группах: у больных с ЖНР I—III градации (А1) на 19,8% (до 15,8±1,1 мин; р<0,05), у больных с ЖНР IV—V градации (А2) на 18,1% (до 21,2±1,3 мин; р<0,01).
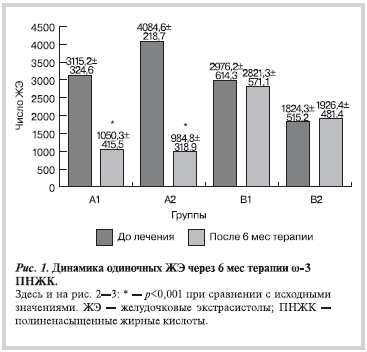
Рисунок 1.
Таблица 2. Динамика ЖНР высоких градаций в процессе терапии
Примечание. Δ, % — разность по сравнению с исходными данными. ЖЭ — желудочковая экстрасистолия; ЖТ—желудочковая тахикардия (ЖТу — устойчивая, ЖТн — неустойчивая). Здесь и в табл. 3—4: * — р<0,05; ** — р<0,01; *** — р<0,001; # — χ2<0,05; ## — χ2<0,01; ## — χ2<0,001 — достоверность различий по сравнению с исходными показателями.
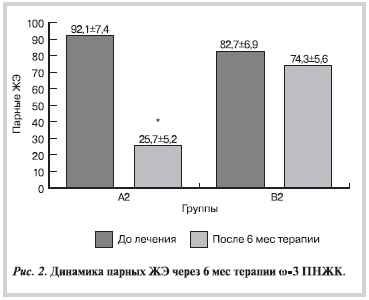
Рисунок 2.
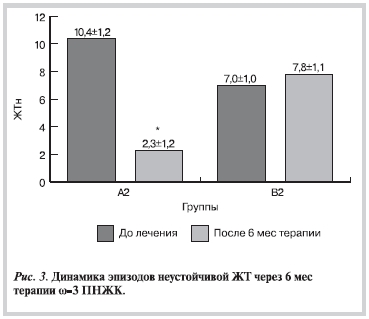
Рисунок 3.
Исходно у больных Q-ИМ отмечались удлинение интервала QTс и снижение вариабельности QTс (табл. 3). Наиболее выраженные изменения негомогенности реполяризации касались больных с ЖНР высоких градаций. На фоне терапии ω-3 ПНЖК отмечалось укорочение интервала QТс у больных группы А1 на 21,3% (р<0,01), в группе А2— на 33,2% (р<0,001) и достоверное повышение varQTc (в группе А1 на 25,1%; р<0,05; в группе А2— на 40,0%; р<0,01). Соответственно уменьшилось число лиц с QTc>450 мс: у больных с ЖНР I—III градации — на 20,5% (χ2=3,9; р<0,05), с ЖНР IV—V градации — на 22,5% (χ2=4,6; р<0,05). В контрольной группе динамика интервала QT в течение 6 мес наблюдения оказалась недостоверной.
Таблица 3. Динамика интервала QT и ППЖ
Примечание. ППЖ — поздних потенциалов желудочков.
Подобные результаты получены и при анализе ППЖ (см. табл. 3). Исходно у пациентов с ЖНР высоких градаций (группы А2 и В2) ППЖ регистрировались чаще чем у больных с ЖНР низких градаций (группы А1 и В1): ОШ=2,31 при 95% ДИ от 1,14 до 4,68; р=0,02. Через 6 мес терапии препаратом омакор отмечена достоверная положительная динамика TotQRS (р<0,01) в группах А1 и А2, а также RMS40 (для А1 р<0,05; для А2 р<0,001). В целом число больных с замедленной фрагментированной активностью уменьшилось: с ЖНР I—III градации (группа А1) на 23,1% (χ2=5,3; р<0,05), с ЖНР IV—V градации (группа А2) — на 38,7% (χ2=9,3; р<0,01). В контрольной группе у пациентов с ЖНР как низких, так и высоких градаций выявлено недостоверное уменьшение числа случаев регистрации ППЖ.
Анализ ТРС выявил значительные нарушения колебаний продолжительности синусового ритма в зависимости от высоты градации желудочковой аритмии (табл. 4). Так, исходно у больных с ЖНР IV—V градации патологическая ТРС (patТРС) зарегистрирована в основной (А2) и контрольной группе (В2) — соответственно у 14 (45,2%) и 15 (46,9%). Через 6 мес после регулярного приема ω-3 ПНЖК patТРС выявлялась реже в основной группе на 29,1% (χ2=4,9; р<0,05), в контрольной группе — на 6,3% (χ2<1). Таким образом, доля пациентов с patТРС после 6 мес стандартной терапии ИМ оказалась существенно выше (А2/В2: ОШ=3,56 при 95% ДИ от 1,08 до 11,68; р=0,03). В группах А1 и А2, получавших ω-3 ПНЖК, менялись показатели ТРС: начало турбулентности (р<0,001) и наклон турбулентности (р<0,001). Позитивная, но не достоверная динамика ТО и TS наблюдалась в группе контроля.
Таблица 4. Динамика ТРС и микровольтной альтернации зубца Т
Тест на микровольтную альтернацию зубца Т указывал на наличие патологических изменений у всех больных Q-ИМ как в основной, так и в контрольной группе (см. табл. 4). Однако, чем тяжелее были выражены ЖНР, тем выше были значения микровольтной альтернации зубца Т, тем чаще они обнаруживались у больных (А1/А2: ОШ=2,75 при 95% ДИ от 0,98 до 7,67; р=0,05; В1/В2: ОШ=2,47 при 95% ДИ от 0,91 до 6,73; р=0,07). Через 6 мес в группе ω-3 ПНЖК выявлены достоверное снижение микровольтной альтернации зубца Т (в группе А1— на 26,3%; р<0,05; в группе А2— на 30,8%; р<0,01) и уменьшение числа больных с микровольтной альтернацией зубца Т (в группе А1 на 18%; р<0,01, в группе А2 — на 29%; р<0,01). В контрольных группах (В1 и В2) эти различия оказались недостоверными.
Обсуждение
В настоящее время получено большое число данных доказательной медицины о кардиопротективных и антиаритмических свойствах 90% ω-3 ПНЖК [6—8]. Согласно результатам экспериментальных исследований антиаритмические эффекты ω-3 ПНЖК объясняются их возможным влиянием на токи ионов натрия, калия и кальция, приводящие к изменению функции ионных каналов [4, 5, 9, 11], а также воздействием на структурно-функциональные свойства мембран кардиомиоцитов [12—15]. В ряде предыдущих клинических исследований оценивалось положительное влияние ω-3 ПНЖК на желудочковые нарушения ритма высоких градаций у больных со стабильной формой ИБС [9], у больных после ИМ сроком до 12 мес [5]. В недавно опубликованной работе [10] проводилась оценка динамики неинвазивных предикторов ВСС на фоне терапии препаратом ω-3 ПНЖК (омакор) у больных с верифицированной стабильной ИБС (больные с ИМ и без ИМ в анамнезе) и ЖНР. Авторы оценили положительное влияние ω-3 ПНЖК на число ЖЭ (одиночных, парных), число пароксизмов ЖТ, а также на показатели турбулентности и вариабельности ритма сердца.
В наше исследование включены больные (мужского пола) на 10—14-й день Q-ИМ с умеренным снижением фракции выброса ЛЖ. Таким образом, по контингенту избранных больных, срокам и тяжести ИМ, наличию зубца Q, систолической дисфункции наше исследование отличалось от предыдущих. Кроме того, мы сочли возможным выделить группы больных с ЖНР I—III и IV—V градации (включающих также пароксизмальную ЖТ). Поскольку в cхему лечения больных Q-ИМ с опасными для жизни желудочковыми аритмиями, согласно международным стандартам, должен быть включен амиодарон [16], мы оценивали возможную дополнительную антиаритмическую эффективность ω-3 ПНЖК на фоне мощного противоаритмического средства. Полученные нами данные свидетельствовали об уменьшении желудочковой эктопии при добавлении ω-3 ПНЖК к базисному лечению больных ИМ. Антиаритмический эффект рецептурного препарата ω-3 ПНЖК (омакор) проявлялся у больных как с одиночными ЖНР (I—III градации), так и с ЖНР IV—V градации, что не противоречит данным других авторов. Известно, что при острой ишемии наблюдается удлинение интервала QT [17]. Более того, синдром удлиненного QT считается предшественником пароксизмальных ЖТ [18—20]. В нашем исследовании исходно регистрировалось не только удлинение QTc (особенно у больных с ЖНР высоких градаций), но и снижение varQTc. Интерпретация изменений varQTc у больных с желудочковой аритмией в литературе нам не встретилась. Однако, учитывая достоверную положительную динамику укорочение QTc (интервала, особенно значимое у больных с ЖНР высоких градаций) и повышение varQTc через 6 мес терапии с применением ω-3 ПНЖК, считаем, что последний параметр нуждается в дополнительном детальном изучении.
Работ, оценивающих влияние ω-3 ПНЖК на ППЖ, ТРС и микровольтной альтернации зубца Т при недавнем ИМ, мы не нашли. Тем не менее наши данные в отношении ТРС согласуются с результатами исследования Е.М. Гавва и соавт. [10], указывающим на благоприятное влияние ω-3 ПНЖК на показатели патологической ТРС у больных со стабильной формой ИБС. При этом мы не отметили достоверного увеличения микровольтной альтернации зубца Т под влиянием омакора. Хотя, безусловно, нужно принять во внимание, что мы подробно не изучали множество отдельных показателей микровольтной альтернации зубца Т, как в аналогичной работе [10].
В литературе появились публикации о высокочастотных низкоамплитудных сигналах — ППЖ, как предикторах ВСС у больных, перенесших Q-ИМ [21—23]. В нашей работе исходно ППЖ регистрировались у больных как при ЖНР низких, так и, особенно, высоких градаций. В доступной литературе влияние ω-3 ПНЖК на показатели фрагментированной желудочковой активности не описано. В нашем исследовании показано, что ω-3 ПНЖК у больных с опасными для жизни желудочковыми аритмиями через 6 мес терапии улучшали абсолютные значения показателей ППЖ (TotQRS и RMS40), тем самым уменьшая электрическую нестабильность клеток в зоне инфаркта и на участках ишемизированного миокарда.
Выводы
1. Использование препарата ω-3 полиненасыщенных жирных кислот — омакора в течение 6 мес у больных Q-инфарктом миокарда с желудочковыми нарушениями ритма низких и высоких градаций усиливает эффект базисной антиаритмической терапии, проявляющийся в уменьшении числа одиночных желудочковых экстрасистолий. У больных с опасными для жизни желудочковыми аритмиями после назначения ω-3 полиненасыщенных жирных кислот уменьшается число парных желудочковых экстрасистолий, пробежек желудочковой тахикардии; одновременно уменьшается время суммарной продолжительности ишемии миокарда.
2. Длительный прием ω-3 полиненасыщенных жирных кислот (омакор) оказывает существенное влияние на неинвазивные предикторы внезапной сердечной смерти у больных с желудочковой аритмией: уменьшается негомогенность реполяризации миокарда и патологическая турбулентность ритма сердца, улучшаются показатели фрагментированной желудочковой активности, снижается амплитуда микровольтной альтернации зубца Т.
3. В качестве одного из основных компонентов влияния ω-3 полиненасыщенных жирных кислот на предикторы внезапной сердечной смерти у больных, перенесших инфаркт миокарда, можно рассматривать их способность снижать риск угрожающих жизни аритмий.



