Аритмии, являясь достаточно ярким, нередко опасным и сложным для лечения проявлением болезни, привлекают к себе внимание сами по себе, методы их диагностики и лечения бурно развиваются. На этом фоне вопросы этиологии часто отходят на второй план. Понятие «идиопатические аритмии» (ИА) на протяжении не менее 50 лет упоминается в литературе (в том числе lone atrial fibrallation [1]) и означает аритмии у больных без структурных изменений сердца. Более строгое определение подразумевает, что были исчерпаны все возможности выявления причины; но и в этом случае говорят об аритмии неясной этиологии, первичной электрической болезни сердца.
Частота развития ИА колеблется от 3 до 45% для мерцательной аритмии (МА) [2, 3] и от 5 до 30% для желудочковых нарушений ритма [4, 5]. Отсутствие очевидной причины аритмии не означает благоприятного течения и прогноза: у больных моложе 50 лет с постоянной формой МА возрастает риск развития эмболий и смерти [6]; частая и полиморфная желудочковая экстрасистолия (ЖЭ) и желудочковая тахикардия (ЖТ) могут повышать риск внезапной смерти [7, 8]. Неустановленная причина аритмии снижает эффективность радиочастотной аблации (РЧА) [9]; при медикаментозном лечении отсутствие эффекта либо необходимость пожизненного приема эффективного антиаритмического препарата также заставляют искать возможность этиотропного лечения.
 Попытки выяснения этиологии ИА, особенно с применением биопсии миокарда малочисленны, результаты их противоречивы: в единичных работах при МА миокардит выявляли в 66% биоптатов предсердий и в 22—25% биоптатов желудочков [10, 11], при ЖЭ/ЖТ частота обнаружения признаков миокардита или кардиомиопатии (КМП) колебалась от 0 до 80% [12—14]. Попытки обсуждать вопрос воспалительной этиологии ИА только на основании повышения уровня С-реактивного белка (СРБ) и цитокинов в крови не обоснованы. Клиническая диагностика генетических причин ИА не менее сложна. Соответственно остаются неясными и возможности этиотропного и патогенетического лечения ИА.
Попытки выяснения этиологии ИА, особенно с применением биопсии миокарда малочисленны, результаты их противоречивы: в единичных работах при МА миокардит выявляли в 66% биоптатов предсердий и в 22—25% биоптатов желудочков [10, 11], при ЖЭ/ЖТ частота обнаружения признаков миокардита или кардиомиопатии (КМП) колебалась от 0 до 80% [12—14]. Попытки обсуждать вопрос воспалительной этиологии ИА только на основании повышения уровня С-реактивного белка (СРБ) и цитокинов в крови не обоснованы. Клиническая диагностика генетических причин ИА не менее сложна. Соответственно остаются неясными и возможности этиотропного и патогенетического лечения ИА.
Цель исследования: установить нозологическую природу ИА с помощью биопсии миокарда и оценить эффект этиотропного и патогенетического лечения.
Материал и методы
В исследование включены 19 больных в возрасте 24—60 лет (средний возраст 42,6±11,3 года, 9 женщин) с различными аритмиями (табл. 1), без дилатация левого желудочка, гипертрофии >14 мм, снижения его сократимости, инфаркта миокарда, инфекционного эндокардита, операций на открытом сердце в анамнезе, пороков сердца, гипертрофической или рестриктивной КМП, диффузных болезней соединительной ткани и системных васкулитов, тиреотоксического и гипертонического сердца.
Артериальная гипертония и ожирение у отдельных больных не рассматривались в качестве ведущей причины аритмии.
Помимо стандартного обследования (в том числе определения уровня гормонов щитовидной железы), дополнительно проведены следующие исследования:
- определение IgG к вирусам герпетической группы, Коксаки В и полимеразная цепная реакция (ПЦР) крови на геном вирусов герпеса человека 1-го, 2 и 6-го типов, Эпштейна—Барр, Varicellae-zoster virus (3-й тип вируса герпеса человека, цитомегаловируса (лаборатория «ДНКтехнология», центр молекулярной диагностики НИИ эпидемиологии);
- определение антикардиальных антител (АТ) в 3 лабораториях: «МедБиоСпектр» (IgM и IgG к суммарному миокардиальному антигену; в норме 1:100); «Иммункулус» (естественные аутоантитела класса IgG к цитоплазматическому белку кардиомиоцитов – КМЦ, CoS05—40 и белку мембран CoM015—15; NO-синтетазе; β1-адренорецепторам; в норме от -30 до +20); лаборатории иммуногистохимии ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова (АТ к антигенам эндотелия, КМЦ, гладкой мускулатуры, волокон проводящей системы сердца; в норме 1:40), а также специфический антинуклеарный фактор (АНФ) с антигеном сердца быка (в норме отсутствует); использовали чистые антитела против IgG человека, меченные изотиоционатом флюоресциина, а также люминесцирующие сыворотки против IgG человека; учет проводили с помощью люминесцентных микроскопов Leica (Laborlux и DM4000В) при увеличении 400, 600;
- эндомиокардиальная биопсия (ЭМБ) правого желудочка доступом через бедренную вену биопсийными щипцами Cordis Standard 5.5 F104 Femoral c забором 5 участков. Проводили ПЦР-диагностику перечисленных вирусов (у 8 больных также парвовируса В19), морфологическое исследование с окраской гематоксилином и эозином, по Ван Гизону, ШИК-реактивом, в отдельных случаях электронную микроскопию.
Кроме того, по показаниям выполнены ДНК-диагностика и консультация генетика (n=4), тредмил-тест (n=5), чреспищеводное (n=5) и внутрисердечное (n=3) электрофизиологическое исследование, сцинтиграфия миокарда с 99mТс-МИБИ (n=10), магнитно-резонансная (МРТ, n=3) и мультиспиральная компьютерная (МСКТ, n=3) томография сердца, коронарография (n=6), биопсия кожи (n=1).
Статистическую обработку материала осуществляли с помощью программы SPSS 11.5 for Windows. Проведение исследования одобрено Межвузовским комитетом по этике.
Ограничения исследования
ЭМБ проводилась у ограниченного числа пациентов с аритмиями в научно-клиническом учреждении, имеющем большой опыт выполнения интервенционных вмешательств на сердце, и не может быть рекомендована для рутинной клинической практики. В проведенном научном исследовании были сознательно расширены предложенные зарубежными коллегами показания к проведению биопсии, которые суммированы в 2007 г. в форме научного обоснования (A Scientific Statement from the AHA, the ACC and the ESC) и имеют низкий уровень доказательности (преимущественно С). Известны публикации авторов данного документа (A.Frustaci и др.), которые свидетельствуют о том, что биопсия у пациентов с аритмиями (как желудочковыми, так и наджелудочковыми) может быть высокоинформативным исследованием, определяющим тактику лечения, что и подтвердила данная работа. Каких-либо российских документов, утвержденных ВНОК и регламентирующих проведение ЭМБ, не существует.
Другим ограничением работы был целенаправленный отбор пациентов. Показанием к проведению биопсии у больных с резистентными к лечению аритмиями, в большинстве случаев комбинированными, явились высокая (по данным комплексного неинвазивного обследования) вероятность миокардита и необходимость его верификации для определения тактики лечения. При миокардите ЭМБ является не только «золотым стандартом» верификации диагноза, но и необходимым основанием для назначения достаточно агрессивной базисной терапии. Данные положения нашли отражение в тексте информированного согласия пациентов, утвержденного Межвузовским комитетом по этике при ассоциации медицинских и фармацевтических вузов (заседание от 13.03.2008 г.). Исследование показало высокую информативность отдельных неинвазивных маркеров латентного миокардита у пациентов с «идиопатическими» аритмиями, что позволяет в широкой клинической практике обходиться без ЭМБ у этих больных.
Результаты
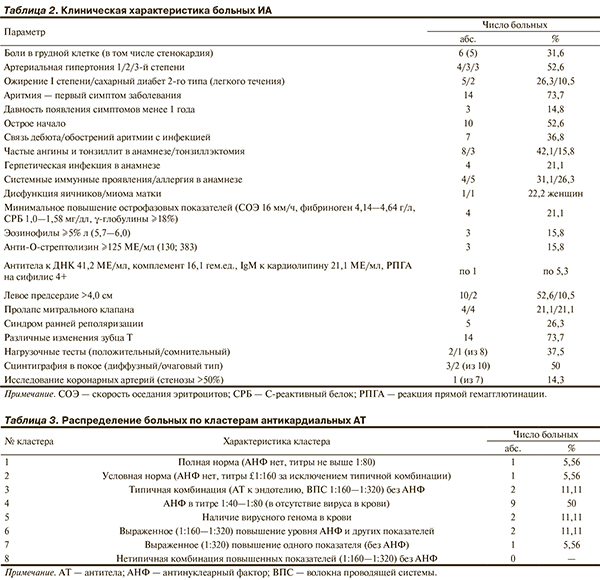
Данные клинического и лабораторно-инструментального обследования, имевшие дифференциально-диагностическое значение, представлены в табл. 2.
Аритмия была первым симптомом заболевания почти у 3/4 больных, однако компоненты типичной для миокардита анамнестической триады (острое начало, связь с инфекцией, давность симптомов менее года) отмечены в гораздо меньшем проценте случаев. В анамнезе у 1/3 больных имелись системные иммунные проявления (бронхиальная астма, аутоиммунный тиреоидит, эпизод геморрагического васкулита) или аллергия, у 22% женщин — миома матки или дисфункция яичников.
Средняя давность аритмического анамнеза составила 72 (30; 144) мес, средний возраст, в котором началась аритмия, — 34,8±10,4 года, для МА 36,2±10,8 года. Пациенты принимали в среднем 5 антиаритмических препаратов (ААП, от 1 до 8), в том числе амиодарон – 14 больных. На момент включения в исследование 1 больной был с имплантированным постоянным кардиостимулятором по поводу атриовентрикулярной (АВ) блокады, у 3 в анамнезе имелась РЧА (2 по поводу АВ-узловой тахикардии, 1 по поводу устойчивой ЖТ); у 3 (15,8%) отмечались синкопальные состояния.
Острофазовые и неспецифические иммунные показатели выявлены у единичных больных (см. табл. 2). Наиболее частыми, по данным инструментального обследования, оказались изменения зубца Т на ЭКГ, изолированное увеличение левого предсердия, диффузное неравномерное или очаговое нарушение перфузии (по данным сцинтиграфии в покое). Из 7 пациентов, которым выполнено исследование коронарных артерий, лишь у 1 (с МА и ЖЭ) выявлен 70% стеноз правой коронарной артерии в отсутствие стенокардии и ишемии. Отсроченное накопление контрастного препарата отмечено у 1 из 3 больных при МСКТ и ни разу при МРТ, жировые включения в миокарде — у 1 пациентки из 3 при МРТ.
У 2 больных в крови выявлена ДНК вирусов Эпштейна— Барр (в процессе лечения) и герпеса человека 6-го типа. Титры IgG к герпетическим вирусам были повышены в 2—3 раза у 70—80% больных, к вирусам Коксаки В — в 2 раза у 50%. Титр IgG к миокардиальному антигену был повышен в среднем в 3—4 раза. Отмечено 3—4-кратное повышение титра АТ к антигенам эндотелия и волокон проводящей системы, 2—3-кратное — к более глубоко расположенным антигенам КМЦ, но не к антигенам гладкой мускулатуры, что доказывает избирательность аутоиммунных реакций. У 2/3 больных выявлен специфический АНФ (в отсутствие стандартного). Различные комбинации повышенных АТ (кластеры) встречались с разной частотой (табл. 3). Уровень естественных АТ имел лишь тенденцию к небольшому повышению. Повышение титра антикардиальных АТ было важным аргументом в пользу проведения ЭМБ.
Непосредственные результаты биопсии представлены в табл. 4: ни в одном случае не было получено нормальной гистологической картины.
Сочетания морфологических признаков позволили поставить нозологический диагноз всем больным (табл. 5):
1. Инфекционо-иммунный миокардит (лимфогистиоцитарная инфильтрация, в том числе периваскулярная) выявлен у 11 (58%) больных, при наличии признаков гибели КМЦ расценен как активный у 8 (рис. 1, см. цветную вклейку), в том числе у больного с гемодинамически значимым коронарным атеросклерозом (рис. 1 а, см. цветную вклейку). У 1 больного выявлен геном парвовируса В19. Весьма своеобразной находкой у 12 больных с аритмиями (почти исключительно при наличии признаков миокардита) были скопления адипозоцитов под эндокардом, где в норме жировая ткань отсутствует (рис. 1 и, см. цветную вклейку); остатки ядер свидетельствуют о возможном вторичном происхождении адипозоцитов (рис. 1 к, см. цветную вклейку). Липоматоз расценен нами как специфичный маркер и субстрат аритмий. Склероз и утолщение эндокарда, мелкоочаговый склероз интерстициальной ткани отражали давность воспалительного процесса.
У 2 пациенток морфологический диагноз был сформулирован как люпус-миокардит (по аналогии с аутоиммунным люпус-гепатитом): его отличали признаки иммунного цитолиза (периполезис и эмпериполезис; рис. 1 б, см. цветную вклейку), васкулит с развитием периваскулярного луковичного склероза (рис. 2 г, см. цветную вклейку); выявлен также митоз КМЦ (рис. 1 в, см. цветную вклейку), который свидетельствует о высокой напряженности регенеративных процессов. Иммунный цитолиз (с обнажением ядерных антигенов, с которыми могут вступать во взаимодействие внутриклеточные лимфоциты) служит морфологической иллюстрацией к процессу выработки антиядерных АТ: уровень специфического АНФ (1:320 и 1:160), титр других антикардиальных АТ был у этих больных максимально высоким (1:160—1:320), включая АТ к антигенам КМЦ (1:160). У этих больных имелись тиреоидит и аллергия в анамнезе, повышение титра АТ к ДНК, IgM к кардиолипину.
2. Хронический вирусно-иммунный миокардит (парвовирус В19) миоэндокардит с отчетливым преобладанием инфильтрации в эндокарде, но без эозинофилов и нейтрофилов (что позволяло исключить бактериальный и леффлеровский эндокардит; рис. 1 е, см. цветную вклейку) диагностирован у 1 больной. Необычно низкий титр АТ к антигенам эндотелия (1:40) отражает, вероятно, массивный выход АТ из крови в эндотелий (в том числе в составе иммунных комплексов [15]). Позднее у нее развился вирус-негативный гепатит с умеренно выраженным синдромом цитолиза, не исключалась его аутоиммунная природа. Аритмии отличались большим разнообразием (МА, трепетание предсердий, НЖЭ, ЖЭ, пробежки ЖТ) и резистентностью ко всем ААП. У второго парвовирус-позитивного пациента с миокардитом признаки поражения эндокарда были минимальными, отмечена лишь своеобразная ангиопатия с обтурацией микрососудов нитями фибрина (рис. 2 е, см. цветную вклейку).
Вовлечение интрамиокардиальных сосудов в патологический процесс отмечено у 78,9%: по 7 больных имели признаки продуктивного васкулита (рис. 2 а—в, см. цветную вклейку) и склероз сосудов с сужением просвета (рис. 2 г, д, см. цветную вклейку). Ни в одном из случаев васкулит не носил характер некротизирующего, у 3 больных он оказался ведущим морфологическим проявлением.
3. Системный васкулит с поражением сердца у 2 пациентов: отмечены миокардит без некроза с преобладанием продуктивного васкулита, ишемической дистрофией КМЦ с очагами миолиза в одном случае (рис. 2 з, см. цветную вклейку). У пациента с более активным процессом системный характер васкулита подтвержден при биопсии неизмененного участка кожи (выявлен лейкокластический васкулит, рис. 2 к, см. цветную вклейку) в отсутствие клинических признаков системности, ANCA (антител к цитоплазме нейтрофилов). Небольшая транзиторная эозинофилия (6%), примесь эозинофилов в инфильтратах (рис. 2 и, см. цветную вклейку), признаки эндокардита (рис. 2 ж, см. цветную вклейку) и единичные тромбы в микрососудах позволили расценить васкулит как гиперсенситивный, а миоэндокардит как леффлероподобный. Ежедневные пароксизмы МА отличались резистентностью ко всем ААП и сочетались с политопной экстрасистолией.
У пациентки с картиной менее активного васкулита и миокардита в анамнезе имелись атопическая бронхиальная астма, эпизод геморрагической сыпи, поллиноз, эпизод эозинофилии до 20%, а также типичные приступы стенокардии при неизмененных коронарных артериях и пароксизмальная МА. Периоды обострений сменялись длительной и нередко спонтанной ремиссией, на момент проведения биопсии уровень эозинофилов, ANCA был нормальным, что не позволило ставить диагноз «большого» васкулита (в частности, синдрома Черджа—Строс).
4. Миокардиальный васкулит (с минимальными признаками миокардита) у одного пациента носил изолированный характер (рис. 2 б, см. цветную вклейку). Выявлены также утолщение и склероз эндокарда (возможно, следствие эндокардита). Единственным проявлением болезни была преходящая блокада ЛНПГ, которая ставила под вопрос профессиональное будущее пациента (космонавт-испытатель). На возможность васкулита указывали признаки стресс-индуцированной ишемии при сцинтиграфии в отсутствие коронарного атеросклероза. Невысокий титр АТ к эндотелию (1:80; фиксация АТ в эндотелии сосудов и эндокарда) сочетался со специфическим АНФ (1:80).
5. Генетическая КМП неуточненного характера диагностирована у 2 больных на основании выявления хаотичного расположения КМЦ (рис. 3 а—в, см. цветную вклейку). У одного из них (с геномом вируса герпеса человека 6-го типа в крови и миокарде) отмечены также мелкие включения в ядрах КМЦ и мелкоочаговый кардиосклероз (рис. 3 г, д, см. цветную вклейку), что могло быть следствием миокардита. Клинически на возможную генетическую природу заболевания указывали развитие МА в 16 лет и умеренная умственная отсталость; не исключаются минимальные признаки миопатии. В то же время пароксизмы МА рецидивировали на фоне ангин и острых респираторных вирусных инфекций. Отмечено повышение титра АТ к антигенам эндотелия и проводящей системы до 1:320, IgG к миокардиальной ткани до 1:300.
У второй больной (с преходящей блокадой ЛНПГ и НЖТ в анамнезе) обращало на себя внимание наличие жировой ткани в миокарде, но отсутствовали фиброзно-жировое замещение миокарда, а также желудочковые аритмии.
6. Болезнь Фабри диагностирована у пациента 32 лет с перисиститрующей МА, АВ-блокадой и минимальной гипертрофией левого желудочка: выявлены центрально расположенные очаги миолиза в КМЦ, накопление PASположительной субстанции в КМЦ (рис. 3 ж, см. цветную вклейку). Болезнь накопления предполагалась наряду с миокардитом, «сердцем спортсмена» и синдромом мезенхимальной дисплазии. Пациент был консультирован генетиком, обратившим внимание на грубые черты лица, ангиокератомы в области поясницы, акропарестезии, несколько обморожений и ампутацию фаланги в анамнезе, гипогидроз, паховую грыжу, а также случай смерти от почечной недостаточности родственника 40 лет. С учетом данных биопсии высказано предположение о болезни Фабри, которая подтверждена результатами биохимического (активность α-галактозидазы 5,1 нМ/мг/ч при норме 48,6—150,3 нМ/мг/ч) и генетическим [мутация Glu283Lys (Q283E) в гене X-Gal] исследований. Повышение титра АТ к антигенам гладкой мускулатуры 1:160 может отражать вовлеченность в патологический процесс мелких сосудов с накоплением глоботриаосилцерамида.
7. Морфологические признаки аритмогенной дисплазии правого желудочка (АДПЖ) выявлены у больной с частой ЖЭ и РЧА по поводу устойчивой правожелудочковой тахикардии в анамнезе и жировыми включениями в миокарде, по данным магнитно-резонансной томографии: адипозоциты в субэндокардиальных отделах (до 50% площади), разделяющие миокард на дольки фиброзные септы с нарушением архитектоники миокарда и площадью фиброза до 25%; склероз и утолщение эндокарда сочетались с отсутствием признаков миокардита (рис. 3 е, см. цветную вклейку). В анамнезе имелись дисфункция яичников, эпизод субфебрилитета, расцененный как миокардит, положительный эффект от лечения нестероидными противовоспалительными препаратами; неглубокие отрицательные зубцы Т в отведениях V1—V4 являются большим критерием АДПЖ, однако их лабильность позволяла предполагать также миокардит. Нормальный уровень антикардиальных АТ соответствовал данным ЭМБ.
Таким образом, по результатам ЭМБ, у 78,9% больных был диагностирован тот или иной вариант иммуновоспалительного заболевания сердца и у 21,1% – тот или иной вариант генетической КМП (см. табл. 5); их соотношение составило примерно 4:1.
На момент окончания исследования у 3 пациентов с миокардитом получены результаты электронной микроскопии (рис. 2 л, м, см. цветную вклейку): выявлены миолиз с участием лизосом, микротельца в КМЦ, сморщивание митохондрий, склеивание крист, отсутствие матрикса, набухание эндотелия, утолщение базальных мембран микрососудов, преципитаты на поверхности эндотелия, усиление пиноцитоза. Митохондрии у этих больных являются, по-видимому, ключевым звеном патогенеза и потенциальной мишенью для медикаментозного воздействия.
Сопоставление результатов неинвазивного и морфологического исследования показало, что наибольшей диагностической значимостью обладал уровень антикардиальных АТ (табл. 6). Отмечены не только корреляция диагноза с кластером АТ (r=0,50; p<0,05) и уровнем специфического АНФ (r=0,65; p<0,01), но и четкая связь иммунной и морфологической активности миокардита: люпус-миокардиту соответствовал 6-й кластер, активному миокардиту – 4-й кластер, при генетической КМП выявлены 1-й и 2-й кластеры. У больных без вирусного генома специфичность АНФ составила 100%. В то же время отсутствие АНФ не исключало миокардита, но делало менее вероятным его высокую активность.
Все остальные признаки обладали высокой специфичностью, но не чувствительностью. В диагностике генетической природы аритмий оказались наиболее важны возраст моложе 40 лет (чувствительность 75%, прогностическая ценность отрицательного результата 88,9%), изолированный характер аритмии (75 и 90,9% соответственно), отягощенный семейный анамнез и возможные генетические маркеры (специфичность и прогностическая ценность положительного результата 100%), синдром ранней реполяризации (специфичность 78,6%, прогностическая ценность отрицательного результата 84,6%).
Медикаментозное лечение включало подбор максимально эффективного ААП, антикоагулянты (n=9) и базисную терапию миокардита. Наибольшим эффектом обладали ААП IC класса и их комбинации: 6 пациентов получали этацизин, 3 — аллапинин (в том числе 2 в комбинации с соталолом), больная АДПЖ — пропафенон; у 4 больных максимальный эффект получен от терапии амиодароном. Монотерапия β-адреноблокатором была назначена 3 пациентом с устойчивой к лечению МА.
Противовирусная терапия (ацикловир внутривенно 750 мг/сут и/или внутрь 1,6—2,0 г/сут в течение 10—21 дня) назначалась 10 больным при наличии вирусов в крови/миокарде либо высоких титров противогерпетических АТ. Достигнута элиминация из крови вируса Эпштейна—Барр, но не вируса герпеса человека 6-го типа. Парвовирус-позитивным пациентам проведены внутривенные вливания иммуноглобулина (габриглобин 10—12,5 г). Амоксиклав, азитромицин, фторхинолоны получали 7 больных респираторными инфекциями в связи с высевом патогенных микробов с миндалин.
В качестве начальной терапии миокардита, в том числе до получения результатов биопсии, 12 пациентам был назначен мелоксикам 15 мг/сут (2—4 нед). Все больные с верифицированном миокардитом получали аминохинолины — плаквенил 200 мг/сут, в среднем 15,0 (7,0; 24,0) мес: исходно, в сочетании с глюкокортикостероидами (ГКС), по мере снижения дозы и отмены последних. При этом монотерапия плаквенилом проводилась лишь одному пациенту.
Терапия ГКС была назначена 14 больным (преднизолон 2 и метилпреднизолон остальным): в дозе 20—30 мг/сут(в пересчете на преднизолон) — 10 и 40 мг/сут — 3; преднизолон 60 мг/сут назначен одному больному с учетом тиреотоксикоза, индуцированного амиодароном. Средняя доза ГКС составила 31,1±12,5 мг/сут, поддерживающая — 6,2±2,2 мг/сут, длительность терапии 18,0 (4,0; 25,5) мес. Комбинацию метилпреднизолона с азатиоприном 150 мг/сут получали 2 больных с люпус-миокардитом и системным васкулитом; последнему проведена также пульс-терапия метилпреднизолоном 1000 мг,всего 3 введения.
Средняя длительность наблюдения за пациентами составила 4 года, или 48,0 (31,0; 62,0) мес. Оценивали непосредственную эффективность базисной терапии, а также антиаритмический эффект комплексного лечения. Уровень всех АТ, за исключением АТ к антигенам КМЦ и гладкой мускулатуры, снизился достоверно через полгода (рис. 4, см. цветную вклейку); через год и два от начала лечения эффект сохранялся, но ослабевал (по мере уменьшения доз и отмены препаратов). У 4 женщин причиной досрочного снижения дозы ГКС были побочные эффекты: периферическая миопатия – у 2 и выраженная потливость и чувство жара – у 2.
Учащение интеркуррентных инфекций отмечено лишь при лечении азатиоприном. «Банальные» инфекции стали причиной обострений у 10 пациентов, индуцированный амиодароном тиреотоксикоз — у 3, снижение дозы или отмена препаратов — у 9. Среднее число обострений на пациента за время наблюдения составило 3; как правило, для их купирования требовалось временное увеличение дозы ГКС на 1/3—1/2 от исходной.
У 16 пациентов с МА исходно отмечалась ее резистентность к ААП: более чем у 60% пароксизмы МА возникали ежедневно либо МА носила устойчивый характер (см. рис. 4, см. цветную вклейку). Все возможности коррекции антиаритмического лечения были исчерпаны. В результате добавления базисной терапии у 14 больных миокардитом удалось достоверно снизить среднюю частоту пароксизмов МА (с 8 до 3 баллов; см. рис. 4, см. цветную вклейку): более чем у 40% больных МА возникала не чаще раза в месяц.
После стойкого подавления активности воспалительного процесса 4 больным была успешно выполнена РЧА устьев легочных вен с полной отменой ААП. У 2 пациентов сохраняется постоянная МА. У остальных больных удовлетворительный антиаритмический эффект (пароксизмы МА отсутствуют либо возникают не чаще раза в несколько месяцев) достигнут в результате медикаментознойтерапии.
Больной с АДПЖ имплантирован кардиовертер-дефибриллятор, пациенту с болезнью Фабри — кардиостимулятор; вопрос с проведением фермент-заместительной терапии у него пока не решен.
Обсуждение
Несмотря на преимущественно наджелудочковый характер аритмий (МА у 16 больных, лишь у 3 в сочетании с ЖЭ), ЭМБ правого желудочка оказалась информативной в 100%, включая 2 пациентов с изолированной блокадой ЛНПГ. В литературе имеются лишь две работы с применением биопсии при резистентной «идиопатической» МА, выполненные группой итальянских авторов у 26 больных [10, 11]. Они хорошо известны благодаря своей уникальности, но не получили выхода в клиническую практику. В биоптатах предсердий признаки миокардита выявлены ими в 66%, но в желудочках лишь в 22% в первой и в 25% во второй работе (у больных с активным миокардитом в предсердиях).
Данные о бóльшей информативности биопсии предсердий при эктопической предсердной тахикардии у детей подтверждает Д.Ф. Егоров, выявлявший миокардит в 54% случаев [12]. Настоящее исследование показало высокую частоту миокардита в биоптатах желудочка (78,9%), в том числе активного – в 60% (у A. Frustaci — лишь у 1/3). Причину этого мы видим в отборе на ЭМБ пациентов с высоким уровнем антикардиальных АТ. При существенно большей давности аритмического анамнеза у наших пациентов закономерно более частое обнаружение фиброза (73,7 по сравнению с 57,2%). У 4 больных биопсия позволила нам исключить миокардит в пользу генетических КМП, в том числе АДПЖ: частота ошибок в диагностике АДПЖ у таких пациентов достигает 50% [16]. У 2 больных выявлен феномен хаотичного расположения КМЦ, что и в отсутствие признаков гипертрофической КМП четко указывает на генетическую природу болезни (возможны мутации в гене миозина [17]).
В литературе нет сведений об отмеченной нами высокой частоте субэндокардиального липоматоза (63,2%) и продуктивного васкулита (36,8%) при ИА. Оба признака тесно коррелировали с наличием воспалительной инфильтрации (r=0,88; p<0,001 и r=0,58; p<0,05). Имеются лишь единичные упоминания о васкулите как причине угрожающих жизни аритмий [18]; «идиопатической» ЖЭ [19]. Возможно, жировая ткань формируется на месте погибших КМЦ из стволовых клеток, наличие которых в миокарде доказано, в том числе при миокардите [20, 21]. Следует отметить, что при АДПЖ уже доказана индукция превращения стволовых клеток в адипоциты [22]. Об активации стволовых клеток может свидетельствовать и выявленный при люпус-миокардите митоз: миокард относится к тканям с очень низким уровнем регенерации (в норме около 0,05% клеток), однако при патологии интенсивность этого процесса возрастает в 10—70 раз [23].
Столь яркий эндокардит, как мы наблюдали у одной из больных, при ИА ни разу не был описан, хотя возможность вирусного поражения клапанов давно подтверждена [24]. Известен также иммунный эндокардит (Либмана—Сакса, в рамках системных васкулитов [25]). Характер патологии у ряда наших пациентов, безусловно, вызывает ассоциации с системными болезнями, однако «не дотягивает» до них, что может быть обусловлено генетически детерминированными особенностями реагирования. Первично хроническое течение заболевания отмечено у 57,1% больных (в том числе с люпус-нефритом и эндокардитом).
Принципиально важным представляется доказанная нами высокая значимость антикардиальных АТ в диагностике миокардита. Ранее получены данные о повышении уровня АТ при «идиопатических» нарушениях ритма и проводимости [26—31], однако оставалась неясной причина выработки самих АТ. В единственной работе 2012 г. доказаны не только достоверно бóльшая по сравнению с контролем (15,7%) частота обнаружения АТ у больных с желудочковыми (64,2%) и с наджелудочковыми аритмиями (44%), но и высокая частота миокардита (81%) у этих больных [32]. Прогностическая ценность положительного результата (т.е. обнаружения АТ к β1-рецепторам) составила 90% в отношении миокардита. В единичных работах доказана корреляция титра АТ к эндотелию с выраженностью гуморальной реакции отторжения трансплантированного сердца [33].
Отечественные авторы наряду с выявленными достоверно бóльшими титрами антикардиальных АТ у больных по сравнению со здоровыми донорами не получили различий между пациентами с ишемической болезнью сердца, миокардитом и КМП [34, 35]. Изучена роль абзимов — каталитических антител к ДНК, способных вызывать гидролиз и раскручивание двуспиральной ДНК и тем самым оказывать прямое цитотоксическое действие. Показали не просто 2-кратное повышение их уровня у больных иммунным миокардитом [36], но корреляцию титра с тяжестью течения и фазой миокардита [37]. Отсутствие повышенного уровня абзимов не исключало диагноза миокардита, что отмечено и в нашей работе, но означало меньшую его активность. При этом чувствительность острофазовых показателей, в том числе СРБ, оказалась очень низкой – у большинства наших пациентов с миокардитом эти показатели оставались в пределах нормы. Согласно поставленному диагнозу миокардита, базисная терапия была назначена всем больным. Клинический эффект от нее был получен у пациентов, у которых к началу исследования были исчерпаны все возможности антиаритмической терапии. Формально таким больным показана РЧА, однако нераспознанный миокардит существенно снижает ее эффективность: так, у пациентов с диагностированным только во время РЧА с ЭМБ миокардитом, несмотря на достижение раннего эффекта, в 50% случаев потребовалось выполнение повторной процедуры РЧА, 77% нуждались в приеме ААП [9]. В то же время у 4 наших пациентов, имевших все формальные показания к РЧА, удалось добиться удовлетворительного антиаритмического эффекта без хирургического вмешательства.
Вопрос о дозах ГКС при лечении миокардита, тем более его аритмического варианта, не изучен. У единичных пациентов с ИА аритмиями и верифицированным миокардитом применялась в основном агрессивная терапия [10, 11, 14, 38]. В невысоких дозах КГС проявляют не столько иммуносупрессивные, сколько противовоспалительные свойства. Тем не менее при применении метилпреднизолона в дозе 16 мг/сут у 104 больных с «идиопатической» МА и повышенным уровнем СРБ на фоне постоянной терапии пропафеноном по сравнению с контрольной группой достоверно реже отмечались рецидивы МА (9,6 и 50%) и переход в постоянную форму (2 и 29%) при среднем сроке наблюдения около 2 лет. [39]. Природа МА в этом исследовании осталась неустановленной.
В нашем исследовании показано, что клинический эффект может быть достигнут при использовании различных режимов базисной терапии миокардита (от монотерапии плаквенилом до сочетания пульс-терапии метипредом с азатиоприном), причем выраженность этого эффекта зависела не только от активности болезни, но и от ее давности и наличия необратимых структурных изменений в миокарде (фиброза, липоматоза).
Заключение
С помощью эндомиокардиальной биопсии нозологический диагноз поставлен всем больным с «идиопатической» аритмией (преимущественно мерцательной аритмией, а также желудочковой экстрасистолией и блокадой левой ножки пучка Гиса). Отмечено преобладание иммуновоспалительных заболеваний (78,9%) над генетическими (21,1%), в одном случае нельзя исключить их сочетание. Наибольшей диагностической значимостью из неинвазивных маркеров обладал уровень антител к различным антигенам сердца, включая специфический антинуклеарный фактор. Отсутствие связи дебюта аритмии с инфекцией, острого начала заболевания, а также наличие коронарного атеросклероза и артериальной гипертонии не исключали миокардита; более чем у 50% больных отмечено его первично хроническое течение. Противовирусная и иммуно-супрессивная терапия, назначенная с учетом активности миокардита, позволяет повысить антиаритмическую эффективность лечения у больных, резистентных к антиаритмическим препаратам, либо оптимально подготовить их к проведению радиочастотной аблации.