Несмотря на накопленный опыт применения базисных препаратов в лечении хронической сердечной недостаточности (ХСН), она является основной причиной инвалидизации и смертности в экономически развитых странах. Среди пациентов с ХСН I–IV функциональных классов (ФК) средняя годовая смертность составляет 6%, при этом у больных с клинически выраженной ХСН она достигает 12% (даже в условиях лечения в специализированном стационаре), т.е. за год в РФ умирает до 612 000 больных ХСН [1].
Основными причинами развития ХСН в РФ являются артериальная гипертензия (88%) и ишемическая болезнь сердца (ИБС; 59%). Однако по данным эпидемиологических исследований 11,9% случаев развития ХСН опосредованы сахарным диабетом (СД) 2 типа [2]. Наличие большого числа факторов риска, сопутствующих СД 2 типа, становится, с одной стороны, базисом для формирования СН, с другой, определяет значительно более плохой прогноз жизни, тяжесть ХСН. При сочетании ХСН ишемического генеза и СД 2 типа базисное лечение ХСН, направленное, прежде всего, на нейрогормональную «разгрузку», первичную и вторичную профилактику поражений органов-мишеней может быть недостаточно эффективным в связи с клинико-патогенетическими особенностями развития ХСН при СД 2 типа. Сложившаяся ситуация требует поиска новых подходов к лечению этой категории пациентов. Однако до настоящего времени не существует единого мнения о терапевтической тактике ведения больных ХСН ишемической этиологии и СД 2 типа с применением цитопротекторов для коррекции нарушений энергетического метаболизма кардиомиоцитов, профилактики прогрессирования поражений органов-мишеней. Поэтому оценка эффективности лекарственных препаратов, которые могли бы активно включаться во внутриклеточные метаболические процессы, бороться с негативными последствиями таких патогенетически неблагоприятных с позиции формирования тяжести как ХСН, так и СД синдромов окислительного стресса (ОС), хронического системного воспаления (ХСВ), инсулинорезистентности (ИР), глюкозо- и липотоксичности, кардиальной симпатической дисрегуляции представляется перспективной и оправданной. Кроме того, не разработан подход к дифференцированному назначению цитопротекторов с учетом особенностей механизма их действия и влияния не только на структурно-функциональное состояние сердца, но и другие органы-мишени – почки, печень.
Широкое применение в кардиологической практике врачей РФ получили цитопротекторы 2-этил-6-метил-3-оксипиридина сукцинат (ЭМОПС) и 3-(2,2,2-триметилгидразиний) пропионата дигидрат (мельдоний), в основе действия которых лежит способность оптимизировать внутриклеточный митохондриальный энергетический обмен и уменьшать потребность клетки в кислороде путем переключения энергообмена с окисления жирных кислот на преимущественную утилизацию глюкозы (более выгодный с точки зрения экономии кислорода вариант метаболизма) за счет стимуляции сукцинатдегидрогеназного пути метаболизма глюкозы и элементов цитохромной цепи (ЭМОПС), блокады поступления жирных кислот в митохондрии (мельдоний). При этом данные цитопротекторы обладают не только антигипоксическими, но и антиоксидантными свойствами, что может позволить уменьшить негативное воздействие ОС и весьма целесообразно в лечении больных с сопутствующими нарушениями углеводного обмена [3]. Поэтому представляется актуальной оценка влияния мельдония и ЭПОМС в составе комбинированной терапии ХСН на структурно- функциональное состояние сердца, почек, печени, проявления синдромов кардиальной симпатической дисрегуляции, липотоксичности, ИР, ОС, ХСВ у пациентов с ХСН ишемической этиологии с нарушениями углеводного обмена и выработка алгоритма их дифференцированного назначения.
Материалы и методы
Проведено проспективное рандомизированное исследование по оценке влияния миокардиальных цитопротекторов с различным механизмом действия – мельдония и ЭМОПС на структурно-функциональные параметры сердца, функциональное состояние почек и печени, показатели синдромов липо-, глюкозотоксичности, ИР, ОС, ХСВ и кардиальной симпатической дисрегуляции у больных ХСН и СД 2 типа при их использовании в составе 16-недельной комбинированной терапии.

В исследование были включены 120 пациентов с ХСН в раннем постинфарктном периоде, страдающих СД 2 типа. В отобранной когорте пациентов методом простой рандомизации было проведено разделение на группы, получающие препараты базисной терапии ХСН (n=60), а также комбинацию базисной терапии ХСН с цитопротекторами (n=60). Больные, принимающие цитопротекторы, дополнительно рандомизировались в отношении комбинации базисной терапии с цитопротектором ЭМОПС или мельдоний. В зависимости от результатов рандомизации были сформированы группы пациентов.
1-я группа была представлена пациентами с ХСН и СД 2 типа (средний возраст 60,9±6,7 года), которым в дополнение к базисной терапии ХСН назначался ЭМОПС в дозе 0,4 г/сут перорально. 2-я группа (контрольная) была представлена пациентами с ХСН и СД 2 типа, которые получали только базисную терапию ХСН (средний возраст 60,3±8,1 года). 3-я группа состояла из пациентов с ХСН и СД 2 типа (средний возраст 62,23±1,4 года), которые в дополнение к базисной терапии ХСН получали мельдоний в дозе 1,0 г/сут. 4-я группа (сравнения) была представлена пациентами с ХСН и СД 2 типа, которые получали только базисную терапию ХСН (средний возраст 62,8±7,8 года). Пациенты всех исследуемых групп были сопоставимы по возрасту, полу, тяжести заболевания, основным клиническим и гемодинамическим параметрам, а также используемым дозам базисной терапии ХСН. Характеристика исходных групп представлена в табл. 1.
Всем пациентам проводилась оценка ФК ХСН, структурно-функционального состояния сердца, исследование вариабельности ритма сердца, изучение функционального состояния почек и печени, показателей углеводного и липидного обмена, ИР и маркеров ХСВ, ОС [4–6].
Статистическая обработка результатов исследования проводилась при помощи пакета прикладных программ для обработки медицинской и биологической информации Statistica 7.0 (StatSoft,Inc., США). Нормальность распределений показателей оценивали по критерию Шапиро–Уилка. Сравнение независимых выборок проводили с привлечением критерия Краскела–Уоллеса. В качестве критического значения при проверке нулевой гипотезы приняли α=0,05. В случае связанных выборок – использовали критерий Вилкоксона. В случае дихотомических показателей статистическая значимость различий долей оценивалась с привлечением точного метода Фишера.
Результаты и обсуждение
При оценке эффективности обоих цитопротекторов в составе 16-недельной комбинированной терапии ХСН у пациентов с СД 2 типа были отмечены выраженный антиангинальный эффект препаратов, повышение толерантности к физическим нагрузкам и улучшение качества жизни пациентов по результатам Миннесотского и Сиетлского опросников. Дополнительное назначение мельдония в группе больных ХСН и СД 2 типа привело к уменьшение среднего балла по результатам Миннесотского опросника на 20%. Прием ЭМОПС сопровождался уменьшением среднего балла по результатам Миннесотского опросника на 23,2%. По данным Сиетлского опросника при приеме цитопротекторов наблюдалось достоверное (по критерию знаков) уменьшение количества приступов стенокардии в неделю и потребности в нитроглицерине по сравнению с группой базисной терапии. Отмеченные положительные эффекты определяются тем, что, несмотря на различия в локализации фармакологического эффекта [3, 11], препараты из группы миокардиальных цитопротекторов, к которым относятся мельдоний (подавление транспорта и окисления длинноцепочечных жирных кислот в митохондрии) и ЭМОПС (прямая стимуляция окисления глюкозы и улучшение транспорта энергетического субстрата в митохондрии), уменьшают потребность ишемизированного миокарда в кислороде.
По данным теста 6-минутной ходьбы, пройденная дистанция статистически значимо увеличилась как при приеме мельдония (∆ 26,5 против 18,0% в группе сравнения; p<0,05) и ЭМОПС (∆ 31,7 против 24,7% в группе контроля; р<0,05) по завершении исследования.
Как в основных, так и в контрольных группах пациентов отмечено улучшение клинического состояния, статистически более значимое при использовании цитопротективной терапии в составе комбинированной терапии ХСН. В группе пациентов с ХСН и СД 2 типа отмечено статистически значимое снижение ФК тяжести ХСН, более выраженное как в группе приема мельдония (∆ -19 против -14% в группе контроля), так и ЭМОПС (∆ -18,5 против -11,2% в группе контроля). Аналогичная тенденция прослеживалась и в отношении динамики среднего балла по шкале оценки клинического состояния при ХСН.
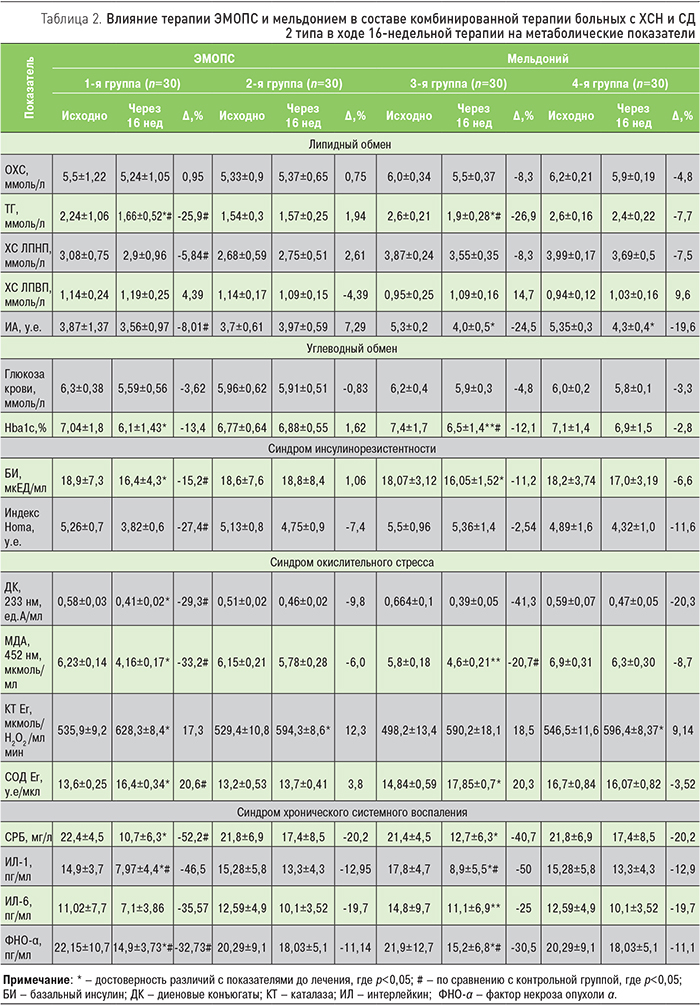
При включении цитопротекторов в комбинированную терапию ХСН пациентам с СД 2 типа отмечено положительное их влияние на показатели геометрии ЛЖ по окончании 16-недельной терапии. Дополнительный прием мельдония в составе базисной терапии ХСН и СД 2 типа привел к уменьшению суммарного количества больных с концентрической и эксцентрической гипертрофией левого желудочка (ЛЖ) на 10,7% (p<0,1). Количество больных с нормальной геометрией ЛЖ достоверно увеличилось с 3,1 до 6,2% (p<0,05); кроме того, через 16 нед терапии наметилась тенденция к увеличению числа пациентов с концентрическим ремоделированием ЛЖ (p<0,1) в сравнении с исходными данными. Различие по конечным результатам с группой сравнения не достигло статистической значимости. Использование ЭМОПС привело к уменьшению суммарного количества больных с концентрической и эксцентрической гипертрофией ЛЖ на 8,9% (p<0,05). Количество больных с нормальной геометрией ЛЖ достоверно увеличилось с 4,1 до 7,2% (p<0,05), через 16 нед терапии наметилась тенденция к увеличению числа пациентов с концентрическим ремоделированием ЛЖ (p<0,1) в сравнении с исходными данными. Различие по конечным результатам с группой сравнения не достигло статистической значимости. Одним из механизмов, опосредующих более значимое влияние мельдония на процессы ремоделирования ЛЖ, может быть связан со статистически значимым снижением уровня триглицеридов (ТГ) после 16-недельной терапии с его использованием, что сопровождалось появлением достоверной корреляции уровня ТГ крови и индекса массы миокарда ЛЖ (r=0,72, p<0,05). Кроме того, оба кардиоцитопротектора обладают свойствами антиоксиданта: при использовании мельдония уровень малонового диальдегида (МДА) достоверно снизился на 23,8%, активность антиоксидантного фермента супероксиддисмутазы (СОД) увеличилась на 6,1%. При использовании ЭМОПС отмечено его более выраженное антиоксидантное действие – положительное влияние не только на уровень МДА (∆ -33,2%), но и первичных продуктов перекисного окисления липидов – диеновых конъюгатов (∆ -29,3%), наряду с более выраженным увеличением активности СОД (∆ 20,6%; табл. 2).
Прием цитопротекторов в составе комбинированной терапии ХСН у больных СД 2 типа демонстрировал положительное влияние препаратов на показатели диастолической функции. Достоверных различий в изучаемых параметрах с группами сравнения по завершении исследования не выявлено, однако более благоприятная динамика отмечалась при приеме мельдония: отмечено увеличение процента больных c I и II стадией диастолической дисфункции (ДД) до 60 и 40 против 53,3 и 46,7% соответственно в группе базисной терапии. В группе больных ХСН и СД 2 типа, дополнительно принимавших ЭМОПС, также отмечено увеличение доли I стадии ДД за счет снижения количества больных со II и III стадиями (частота выявления ДД II стадии снизилась на 20,1 против 8,3% в группе контроля, р>0,05, а доля ДД III стадии, определяемой при первичном обследовании у 26,7% больных основной группы, по окончании 16-недельной терапии уменьшилась до 20%, р>0,05). Отмеченное положительное влияние цитопротекторов при их использовании в составе комбинированной терапии ХСН у больных СД может быть опосредовано положительным влиянием на процессы аэробного гликолиза и нормализацией окисления митохондриальных субстратов – свободных жирных кислот (СЖК) и глюкозы, нарушение утилизации которых рассматривается как основная причина развития ДД у пациентов с ХСН. Экспериментальные исследования доказали способность мельдония и ЭМОПС стимулировать активность мембранных ферментов – фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы, а также увеличивать синтез АТФ и креатинфосфата [7].
Медикаментозная коррекция ХСН у больных СД 2 типа при включении цитопротекторов в состав комбинированной терапии ХСН сопровождалась положительным влиянием на функциональное состояние почек и ассоциировалось с нормализующим влиянием на их фильтрационную функцию. Включение мельдония в схему лечения ХСН сопровождалось через 16 нед лечения увеличением скорости клубочковой фильтрации (СКФ) на 18,6%, в то время как в группе базисной терапии ХСН СКФ практически не изменилась. Различие в двух сравниваемых группах было статистически значимым (p<0,05). Увеличение среднего значения СКФ на фоне дополнительного приема мельдония у пациентов с СД 2 типа наблюдалось за счет роста клиренса креатинина у больных с исходно сниженной СКФ (<60 мл/мин/1,73 м2), в результате чего их количество в этой группе уменьшилось на 27,3%.
К концу периода наблюдения в двух группах больных ХСН и СД 2 типа снизилось количество больных с истощенным функциональным почечным резервом (ФПР), но достоверно лишь в той, где дополнительно назначался мельдоний, – на 36 против 18,6% в группе базисной терапии (p<0,05). 16-недельная терапия ХСН с включением ЭМОПС у пациентов с СД 2 типа также характеризовалось положительным влиянием на состояние внутриклубочковой гемодинамики, что сопровождалось уменьшением количества больных с истощенным ФПР на 39,1 против 16,7% в группе базисной терапии (p<0,05).
Применение как мельдония, так и ЭМОПС в составе терапии пациентов с ХСН и СД 2 типа сопровождалось выраженным антипротеинурическим эффектом: для мельдония ∆ -24% против -10% в группе контроля (р<0,05) и ∆ -40,2 против -27,2% в группе базисной терапии (р<0,05) для ЭМОПС. Отмеченный более выраженный антипротеинурический эффект ЭМОПС у больных ХСН и СД 2 типа может быть опосредован реализацией антиоксидантого эффекта препарата, связанным с присутствием 3-оксипиридина в его составе и патогенетически более целенаправленным действием, что определяется ролью ОС в формировании нефропатии у больных СД.
В ходе исследования проводилась оценка влияния мельдония и ЭМОПС на показатели функционального статуса печени, а также индекс стеатоза печени (ИСП), рассчитанного по Lee Jeong-Hoon и соавт. (2010) [8]. Полученные результаты свидетельствуют об отсутствии статистически значимого влияния мельдония на показатели функционального состояния печени и ИСП при его использовании в течение 16-недельной терапии у пациентов с ХСН и СД 2 типа, тогда как ЭМОПС проявлял у этой категории больных выраженные гепатопротекторные свойства. Отмечено его статистически значимое влияния на показатели ферментов цитолиза (достоверное снижение активности АЛТ и АСТ в группе пациентов, дополнительно принимающих ЭМОПС: ∆ -39,06 и ∆ -26,93% соответственно против -4,1 и 0,98% в группе базисной терапии; p<0,05) и холестаза (активность щелочной фосфатазы снизилась на 22,27%, а γ-глутамилтранспептидазы – на 41,86% (р<0,05). ИСП в группе пациентов с ХСН и СД 2 типа достоверно снизился на 9,43%, тогда как в группе базисной терапии он возрос на 2,5%. Отмеченные положительные эффекты ЭМОПС на показатели функционального состояния печени объясняются присутствием в составе препарата сукцината, что, по данным экспериментальных исследований, определяет его антиоксидантное, антигипоксическое, мембраностабилизирующее действие при хронических поражениях печени различного генеза [9], а также способностью производных 3-оксипиридина ингибировать свободнорадикальные процессы в микросомах печени, что способствует гепатопротекции. Показано, что сукцинат способен поддерживать при гипоксии активность сукцинатоксидазного звена, что в химическом отношении является очень важным, т.к. FAD-зависимое звено цикла Кребса угнетается при гипоксии и ишемии значительно позднее по сравнению с NAD-зависимыми оксидазами и может достаточно длительно поддерживать энергопродукцию в клетке при условии наличия в митохондриях субстрата окисления в данном звене - сукцината (янтарной кислоты). В качестве антигипоксанта ЭМОПС стимулирует прямое окисление глюкозы по пентозо-фосфатному шунту, активируя сукцинатдегидроденазный путь окисления, переключая клеточный метаболизм с преимущественного окисления жирных кислот на окисление глюкозы.
Включение как мельдония, так и ЭМОПС в состав базисной терапии ХСН у больных СД 2 типа сопровождалось благоприятными изменениями показателей вариабельности сердечного ритма, что выражалось достоверным снижением доли пациентов с гиперсимпатикотоническим типом вегетативной реактивности с 76,6 до 63,3% и устранением пациентов с ее асимпатикотоническим типом.
Включение цитопротекторов в состав комбинированной терапии ХСН и СД 2 типа сопровождалось дополнительными патогенетически благоприятным влиянием на показатели синдромов липо- и глюкозотоксичности, ИР, ОС и ХСВ (табл. 2). В нашем исследовании выявлено благоприятное влияние цитопротекторов на состояние липидного обмена. Отмечено достоверное снижение уровня ТГ крови у пациентов, принимавших дополнительно к базисной терапии мельдоний и ЭМОПС: на 26,9 (р<0,05) и 25,9% (р<0,05) соответственно. Обращает на себя внимание, что спектр гиполипидемического действия ЭМОПС был более широк: отмечено статистически значимое снижение содержания холестерина липопротеидов низкой плотности (на 5,84%), что сопровождалось достоверным снижением индекса атерогенности (на 8,01%). Полученные нами результаты оказались весьма интересны, т.к. они свидетельствуют о возможности дополнительной коррекции нарушений липидного обмена при использовании цитопротекторов у пациентов с ХСН и СД 2 типа. Благоприятное воздействие мельдония на обмен липидов может быть связан с улучшением микроциркуляции жирового депо и активацией процессов липолиза вследствие индукции синтеза NO-эндотелиального фактора релаксации [10]. Кроме того, реализация положительных цитопротекторных эффектов мельдония осуществляется за счет ингибирования синтеза карнитина – переносчика жирных кислот через митохондриальные мембраны, где происходит их β-окисление, что в условиях гипоксии способствует снижению транспорта длинноцепочечных жирных кислот в митохондрии, вследствие чего СЖК, являющиеся субстратом для синтеза ТГ в условиях нормоксии, не используются в качестве источника энергии, а продолжают циркулировать в крови. В отличие от мельдония, как было отмечено выше, ЭМОПС стимулирует прямое окисление глюкозы по пентозо-фосфатному шунту, активируя сукцинатдегидроденазный путь окисления и переключая клеточный метаболизм с преимущественного окисления жирных кислот на окисление глюкозы. При улучшении оксигенации ЭМОПС не препятствует окислению СЖК, что является отличительной особенностью этого препарата. Таким образом, на фоне его применения сохраняется утилизация СЖК клетками, что также закономерно приводит к снижению концентрации ТГ в сыворотке крови. Кроме того, липидснижающий эффект ЭМОПС может быть опосредован более выраженным снижением свободнорадикального окислением липопротеидов низкой плотности и нормализацией функционального состояния гепатоцитов.
Оценка влияния цитопротекторов в составе комбинированной терапии больных ХСН и СД 2 типа на показатели синдрома ХСВ показала, что их влияние на уровень С-реактивного белка (СРБ) было сопоставимым (снижение на 40,7 и 52,2% соответственно). Обращает на себя внимание, что снижение содержания СРБ у больных, принимающих в составе комбинированной терапии ЭМОПС, сопровождалось снижением гликемии натощак (r=0,5; р<0,05), а также степени выраженности ИР по данным содержания базального инсулина и индексу HOMA (r=0,46; р<0,05 и r=0,54; р<0,05 соответственно). В то же время, по мере снижения уровня СРБ у пациентов, принимающих мельдоний, отмечалось улучшение функционального состояния почек, что проявлялось достоверной корреляционной связью СРБ и СКФ (r=0,32, р<0,05), СРБ и микроальбуминурии (r=0,53, р<0,05).
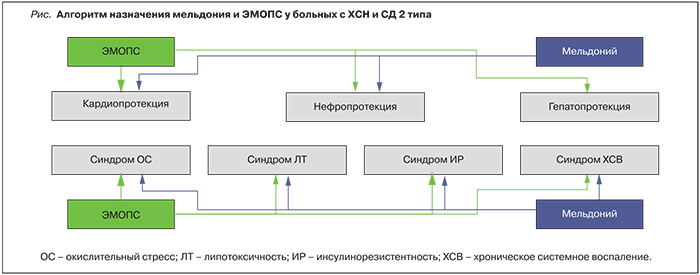
В группе пациентов, принимающих мельдоний, отмечено статистически значимое снижение содержания ИЛ-1β (∆ -50%), ФНО-α (∆ -30,5%), наблюдалась тенденция к уменьшению содержания ИЛ-6. Прием ЭМОПС сопровождался достоверным снижением только ФНО-α (∆ -32,73%). Таким образом, включение мельдония в терапию ХСН у больных с СД 2 типа сопровождалось более выраженным влиянием на проявление системного воспаления. На основании сравнительного анализа эффективности мельдония и ЭМОПС в группах больных ХСН и СД 2 типа выработан алгоритм назначения препаратов (рисунок).
Таким образом, назначение мельдония и ЭМОПС пациентами с сочетанием ХСН и СД 2 типа должно носить дифференцированный характер. ЭМОПС, наряду со значимым гепатопротективным влиянием, проявляет более выраженные метаболические эффекты в отношении углеводного и липидного обмена, синдрома ИР, тогда как мельдоний, при сопоставимом с ЭМОПС кардио- и нефропротективном воздействии, эффективнее подавляет процессы ХСВ.



