Гипердинамический тип кровообращения у больных с циррозом печени (ЦП) был описан Kowalski и соавт. [1] более 50 лет назад. Однако длительное время ЦП не рассматривали как причину кардиальной дисфункции. Описание ряда клинических случаев с летальным исходом вследствие сердечной недостаточности (СН), развившейся вскоре после трансплантации печени или наложения сосудистых шунтов, послужило предпосылкой к детальному изучению патологии сердца при ЦП. Последующие исследования выявили наличие скрытой кардиальной дисфункции у больных с ЦП, независимо от этиологии заболевания. Такая кардиальная дисфункция при отсутствии другой кардиальной патологии получила название цирротической кардиомиопатии (ЦКМ) [2, 3].
ЦКМ характеризуется:
- увеличенным сердечным выбросом в покое;
- сниженным периферическим сосудистым сопротивлением;
- сниженной сократительной способностью миокарда: систолической дисфункцией (СД) в условиях физиологического, физического или фармакологического стресса;
- увеличением толщины левого желудочка (ЛЖ), ассоциированным с диастолической дисфункцией (ДД);
- электрофизиологическими аномалиями [2].
В основе патогенеза СД при ЦКМ лежат нарушение текучести мембран кардиомиоцитов и бета-адренергической передачи, а также активация эндоканнабиноидной системы, оказывающей ингибирующее влияние на сократительную способность миокарда. Сократительную способность кардиомиоцита уменьшают также наблюдаемые при ЦП повышенные уровни эндогенных оксида азота (NO) и монооксида углерода (СО).
Для клинициста важно предвидеть развитие СН (как проявления ЦКМ) после объемных хирургических вмешательств, кровотечений, оперативных пособий: портосистемного шунтирования, в т.ч. трансъягулярного интрапеченочного портосистемного шунтирования (Transjugularis Intrahepatic Portosystemic Shunt, TIPS), трансплантации печени; при развитии инфекционных осложнений [2, 4]. Как в эксперименте, так и в клинических испытаниях показано, что стрессовое воздействие (физическое, фармакологическое) при СД проявляется недостаточным наращиванием сердечного выброса по сравнению со здоровыми добровольцами.
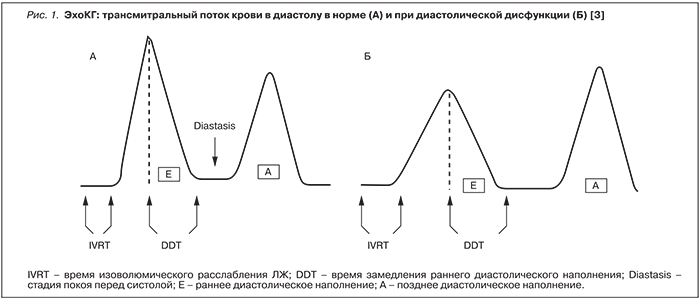
В свою очередь, ДД предположительно развивается вследствие задержки натрия, увеличения объема циркулирующей крови и активации различных нейрогуморальных систем, в т.ч. ренин-ангиотензиновой [2]. ДД миокарда характеризуется аномальным расслаблением во время диастолы, поскольку растяжимость сердечной мышцы снижена вследствие гипертрофии кардиомиоцитов или повышенного отложения интерстициального коллагена. Возросшее сопротивление току крови, заполняющему желудочек, приводит к замедлению заполнения ЛЖ кровью в диастолу. При эхокардиографии (ЭхоКГ) выявляют уменьшение трансмитрального кровотока в раннюю диастолу (величина Е). Компенсаторно увеличивается кровоток в позднюю диастолу, что обусловлено сокращением предсердий (величина А). Таким образом, в отличие от нормы (рис. 1а) у больных с ЦП соотношение величин Е/А уменьшено (рис. 1б) [2, 4].
Электрофизиологические нарушения при ЦП возникают в связи с изменениями клеточных мембран, дефектами на уровне бета-адренорецепторов и пострецепторном пути, дисфункцией ионных каналов. Удлинение QT интервала, предрасполагающее к желудочковым аритмиям и внезапной сердечной смерти, наблюдается примерно у половины больных при ЦП. Увеличенный QT интервал удается нормализовать с помощью бета-блокаторов. Нормализация ЭКГ наблюдается также после трансплантации печени [3, 4]. В патогенезе как СД, так и ДД также играют роль некоторые цитокины (фактор некроза опухолей) и ядерный фактор NF-kВ [2]. Диагностика ЦКМ осуществляется не только с помощью ЭКГ и ЭхоКГ, но и исследованиями различных сывороточных маркеров хронической сердечной недостаточности (ХСН), например, таких как мозговой натрийуретический пептид и N-терминальный фрагмент предшественника мозгового натрий-уретического пептида (NT-proBNP). Имеются сообщения о том, что уровень мозгового натрий-уретического пептида является независимым предиктором среднесрочной (в течение 6 мес) выживаемости при декомпенсированном ЦП и, возможно, может использоваться для стратификации риска у больных с декомпенсированным ЦП [5]. NT-proBNP является надежным неинвазивным маркером ранней дисфункции миокарда на фоне объемной перегрузки камер сердца при прогрессировании портальной гипертензии у больных ЦП.
Наиболее хорошо изученными являются кардиомиопатии при алкогольной болезни печени и болезнях накопления (как наследственных, так и приобретенных).
Кардиомиопатия при алкогольной болезни печени
Известно, что у больных с алкогольной болезнью поражение печени часто сочетается c кардиальной патологией (табл. 1) [6]. Одной из наиболее частых патологий, которую можно рассматривать как внепеченочное проявление, является кардиомиопатия. По частоте кардиальная патология у алкоголиков стоит на третьем месте после алкогольных заболеваний печени и поджелудочной железы и часто с ними сочетается.
Прямое токсическое воздействие этанола и его основного метаболита ацетальдегида на миокард в сочетании с характерными для хронической алкогольной интоксикации изменениями нервной регуляции и микроциркуляции лежат в основе патогенеза алкогольной кардиомиопатии (АКМ). Ацетальдегид повреждает сократительную функцию миокарда, нарушает сопряжение между возбуждением и торможением, активирует перекисное окисление липидов и вызывает развитие оксидативного стресса. Выделяют несколько стадий алкогольного поражения сердца.
 На первой стадии основной жалобой является кардиалгия, т.е. боль в прекардиальной области преимущественно неангинозного характера, развивающаяся в первые дни после алкогольного эксцесса. При ЭхоКГ выявляют начальные признаки гипертрофии желудочков сердца. На ЭКГ изменения предсердного комплекса чаще всего аналогичны наблюдаемым при перегрузке левого или правого предсердия (появление расширенных расщепленных зубцов Р или высоких Р типа Р-pulmonale). Характерны также изменения конечной части желудочкового комплекса, сегмента ST и зубца Т в виде депрессии сегмента ST ниже изолинии, появления патологического высокого, двухфазного, изоэлектрического или отрицательного зубца Т. Описанные ЭКГ-изменения, как правило, имеют преходящий характер. На первой стадии необходимо проводить дифференциальную диагностику с ишемической болезнью сердца, при которой могут наблюдаться аналогичные электрокардиографические изменения. Особенностью АКМ является ассоциация с вегетативными расстройствами (чувство нехватки воздуха, неудовлетворенность вдохом, сердцебиение, похолодание конечностей, гиперемия лица, гипергидроз, тремор рук), анамнестические данные о недавнем употреблении алкоголя, отсутствие клиники коронарной болезни с приступами стенокардии. На фоне воздержания от алкоголя на ЭКГ отмечается быстрая положительная динамика.
На первой стадии основной жалобой является кардиалгия, т.е. боль в прекардиальной области преимущественно неангинозного характера, развивающаяся в первые дни после алкогольного эксцесса. При ЭхоКГ выявляют начальные признаки гипертрофии желудочков сердца. На ЭКГ изменения предсердного комплекса чаще всего аналогичны наблюдаемым при перегрузке левого или правого предсердия (появление расширенных расщепленных зубцов Р или высоких Р типа Р-pulmonale). Характерны также изменения конечной части желудочкового комплекса, сегмента ST и зубца Т в виде депрессии сегмента ST ниже изолинии, появления патологического высокого, двухфазного, изоэлектрического или отрицательного зубца Т. Описанные ЭКГ-изменения, как правило, имеют преходящий характер. На первой стадии необходимо проводить дифференциальную диагностику с ишемической болезнью сердца, при которой могут наблюдаться аналогичные электрокардиографические изменения. Особенностью АКМ является ассоциация с вегетативными расстройствами (чувство нехватки воздуха, неудовлетворенность вдохом, сердцебиение, похолодание конечностей, гиперемия лица, гипергидроз, тремор рук), анамнестические данные о недавнем употреблении алкоголя, отсутствие клиники коронарной болезни с приступами стенокардии. На фоне воздержания от алкоголя на ЭКГ отмечается быстрая положительная динамика.
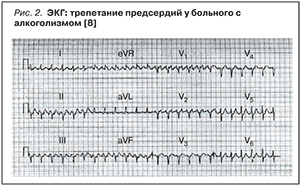
Вторая стадия АКМ характеризуется пароксизмами фибрилляции предсердий (рис. 2) [7], возникающими после алкогольных эксцессов, при этом отсутствуют выраженные признаки СН. В патогенезе пароксизмальных нарушений ритма при АКМ, помимо токсического воздействия этанола и его метаболитов на миокард, имеет значение и симпатико-тоническое действие алкоголя.
Третья стадия АКМ характеризуется начальными признаками ХСН, что клинически проявляется снижением толерантности к физической нагрузке. Больные жалуются на одышку при физической нагрузке, сердцебиение, повышенную утомляемость, ощущение перебоев в работе сердца. При ЭхоКГ выявляют уменьшение ударного объема, повышение конечного диастолического давления в ЛЖ. На ЭКГ регистрируют синусовую тахикардию, признаки диффузного поражения миокарда, иногда постоянную форму фибрилляции предсердий.
На четвертой (терминальной) стадии АКМ имеется развернутая клиническая картина ХСН с наличием одышки при незначительной физической нагрузке и/или в покое, приступов удушья, стойкой тахикардии или постоянной формы фибрилляции предсердий, отеков, иногда асцита и/или гидроторакса. При ЭхоКГ выявляют дилатацию полостей сердца, признаки СД [8, 9].
В экспериментальном исследовании показано токсическое действие алкоголя на миокард животных (белые крысы), которые получали слабоалкогольный напиток (САН) коктейль «Черный русский» по 0,5 л ежедневно в течение 90 дней. На фоне употребления САН изменилось поведение животных: усилилось общение между ними в первые сутки, уменьшилась реакция на внешние раздражители, сформировалась активная реакция на поилку с САН, снизилась потребность в воде и пище. При аутопсии через 90 дней выявлено отсутствие жировой клетчатки и усиление сосудистого рисунка в перикарде. Артерии имели прерывистое наполнение кровью, под перикардом правого желудочка была выявлена запустевшая артерия, на верхушке сердца обнаружена зона подэпикардиального кровоизлияния. Микроскопически наблюдали гипертрофию и некроз отдельных мышечных волокон, периваскулярный кардиосклероз [10].
В одном из исследований у 25 больных с алкогольным ЦП классов А (n=4), В (n=12), С (n=9) по Чайлд–Пью и нарушением диастолического расслабления ЛЖ (т.е. наличием ДД) при сохранной систолической функции выявлено значительное повышение NT-proBNP в диапазоне от 35 до 142 фмоль/мл (в среднем 89,6 фмоль/л, при норме 4,8 фмоль/мл) [11], что подтверждает диагностическую значимость этого лабораторного маркера.
Поражение сердца при гемохроматозе
Развитие гемохроматоза может быть обусловлено как врожденным нарушением обмена железа, связанного с повышенной его абсорбцией в тонкой кишке (первичный гемохроматоз), так и избыточным поступлением железа при гемотрансфузиях, ряде патологических состояний или ятрогенном гемохроматозе – неоправданном бесконтрольном применении препаратов железа (вторичный гемохроматоз). Отложения железа в любом органе вызывают реакцию ткани в виде фиброза. Наряду с поражением печени, поджелудочной железы, кожи, нервной и эндокринной систем для гемохроматоза характерно поражение миокарда [12,13].
Отложения железа в сердце при первичном гемохроматозе имеются в 90–100% случаев, однако поражение сердца может быть бессимптомным и обнаруживается, как правило, при проведении углубленных исследований или провокационных проб. Клиническая симптоматика выявляется примерно у трети больных. Дисфункция миокарда обычно проявляется хронической застойной недостаточностью. Больные могут предъявлять жалобы на боли в груди (чаще неишемического характера), сердцебиение, слабость, одышку при физической нагрузке, боли в правом подреберье, периферические отеки, иногда обмороки. При аускультации отмечается глухость сердечных тонов, ритм предсердного или желудочкового «галопа», выслушиваются шумы регургитации. Артериальное давление чаще нормальное или сниженное. Рентгенологическое исследование выявляет увеличение размеров сердца за счет дилатации его полостей. На ЭКГ у больных наследственным гемохроматозом (НГХ) регистрируется уменьшение вольтажа зубца T, иногда он является изоэлектричным или отрицательным. Могут регистрироваться инфарктоподобные изменения, удлиненный интервал QT. В 30–40% случаев на ЭКГ выявляются разнообразные нарушения сердечного ритма.
При аутопсии сердце больных НГХ имеет коричневато-кирпичную окраску, полости часто дилатированы, миокард выглядит дряблым, стенки полостей могут быть утолщенными. Возможно наличие видимых глазом отложений железа, больше в субэндокардиальных слоях миокарда, более выраженных в желудочках, чем в предсердиях. В кардиомиоцитах и строме миокарда обнаруживают скопления железосодержащего пигмента, которые выявляют при окрашивании по Перлсу, часть кардиомиоцитов с наиболее выраженным накоплением пигмента находится в состоянии выраженной дистрофии на фоне диффузного миофиброза.
 Современное эхокардиографическое исследование позволяет визуализировать изменения структуры и функции, характеризующие тип поражения сердца при НГХ.
Современное эхокардиографическое исследование позволяет визуализировать изменения структуры и функции, характеризующие тип поражения сердца при НГХ.
Тип первый (пограничный). Это наиболее часто встречающийся тип поражения сердца, характерный для относительно молодых пациентов с равномерным распределением избытков железа. При исследовании полости сердца не расширены, стенки ЛЖ нормальной толщины или незначительно равномерно утолщены, возможно утолщение межжелудочковой перегородки. Фракция выброса может быть несколько снижена за счет диффузной гипокинезии миокарда. Допплеровское исследование выявляет невыраженное нарушение диастолической функции. При эффективной терапии возможен регресс патологических признаков.
Второй тип (дилятационный). Этот тип поражения сердца отмечается у лиц со значительным избытком железа (поздно диагностированные, нелеченые или неэффективно леченые больные, чаще мужского пола). Для больных характерны различные нарушения ритма и проводимости. При ЭхоКГ все полости сердца расширены, стенки нормальной толщины. Фракция выброса значительно снижена из-за выраженной диффузной гипокинезии миокарда, выявляется ДД. В результате лечения при этом типе нормализации размеров полостей сердца не происходит, однако, возможно улучшение систолической и диастолической функции сердца, уменьшение эпизодов сердечных аритмий.
Третий тип (рестриктивный). Полости сердца не расширены или незначительно расширен ЛЖ, стенки его утолщены. Масса миокарда увеличена, систолическая функция снижена. Допплеровское исследование выявляет выраженную ДД рестриктивного типа. Патогенетическая терапия может улучшить систолическую функцию ЛЖ [12, 13].
Поражение сердца при амилоидозе
Практическому врачу необходимо помнить, что увеличение размеров сердца, ХСН, разнообразные аритмии у лиц старше 50 лет могут быть связаны с амилоидозом сердца. Амилоидоз – системное заболевание, характеризующееся отложением в тканях амилоида (сложный белково-полисахаридный комплекс). В зависимости от типа белка выделяют несколько типов амилоидоза, однако общим для всех видов является внеклеточное отложение труднорастворимых фибриллярных белков с характерными тинкториальными свойствами. Амилоидоз приводит к атрофии, склерозу и недостаточности функций различных органов. Как правило, прогноз заболевания зависит от его причины и степени вовлечения почек.
Амилоидоз сердца возникает как проявление первичного амилоидоза, реже связан с миеломной болезнью и характеризуется нарушением белкового обмена и отложением амилоида в миокарде. Амилоидоз сердца выявляется на секции примерно у 2% пожилых лиц, но причиной смерти является сравнительно редко. Прогрессирование заболевания сопровождается атрофией сократительного миокарда, редко – поражением перикарда и клапанов. При поражении клапанов может развиться картина клапанного порока. Для верификации диагноза важно обнаружить характерное для амилоидоза поражение других органов – макроглоссию, инфильтрацию основания языка, мышц, гортани, иногда – легких с развитием гипертонии малого круга. Необходимо гистологическое подтверждение отложений амилоида. Если какой-либо пораженный орган доступен биопсии, то необходимо морфологическое подтверждение диагноза [12].
Хронические заболевания печени вирусной этиологии и поражение миокарда
Имеются мнения о возможной причинно-следственной связи между идиопатической дилатационной кардиомиопатией и хронической С-вирусной инфекцией [14, 15]. В одной из работ [14] были проанализированы результаты шести клинических исследований, проведенных по правилам качественной клинической практики (Good Clinical Practice, GCP). При этом только в двух исследованиях, выполненных одними и теми же авторами, показана корреляция между наличием хронического гепатита С и идиопатической дилатационной кардиомиопатией. В то же время в пилотном исследовании J. Braz и соавт. не выявлено увеличения процента больных хроническим гепатитом С, имеющих идиопатическую дилатационную кардиомиопатию. Имеются также сообщения о сочетанном поражении печени и сердца при цитомегаловирусной инфекции с одновременным развитием цитомегаловирусного гепатита и миоперикардита [16].
Современные методы диагностики фиброза миокарда с использованием сывороточных маркеров
Для определения степени фиброзирования миокарда используют так называемую объемную фракцию интерстициального коллагена (ОФИК), которая в норме не превышает 2%. «Золотым стандартом» для определения ОФИК является субэндокардиальная биопсия миокарда. Однако проведение такого исследования сопряжено с определенными рисками. Кроме того, чтобы исследование было репрезентативным, необходим забор образцов из 4–5 разных участков миокарда. J. Shirani и соавт. [17], сопоставив результаты прижизненной эндомиокардиальной биопсии и параметры ЭКГ и ЭхоКГ, предложили расчетную формулу для ОФИК:
![]()
где, общий QRS – суммарный вольтаж в 12 стандартных отведениях ЭКГ, ММЛЖ — масса миокарда ЛЖ (рассчитывается по формуле: MMЛЖ = 0,832 × [1,04((КДР+МЖП+ЗС)3 - (КДР)3] + 0,6, где МЖП – толщина межжелудочковой перегородки в диастолу; ЗС – толщина задней стенки ЛЖ в диастолу; КДР – конечный диастолический размер ЛЖ, определяемые при ЭхоКГ [18].)
Весьма перспективным является изучение возможностей диагностики фиброза миокарда с помощью сывороточных маркеров. Метод представляет несомненный интерес ввиду неинвазивности, простоты определения и возможности мониторирования фиброзирования миокарда в динамике. Основанием для применения метода являются знания о том, что при артериальной гипертензии (АГ) развивается гипертрофия миокарда ЛЖ и повышение жесткости миокарда за счет фиброзирования с развитием ДД.
В ряде экспериментальных и клинических исследований у больных с АГ выявлено достоверное по сравнению со здоровыми добровольцами повышение маркеров коллагенообразования: карбокситерминального пропептида проколлагена І типа, карбокситерминального телопептида коллагена І типа, тканевого ингибитора матриксной металлопротеиназы 1 типа, матриксной металлопротеиназы 1 типа, а также трансформирующего фактора роста β1. В табл. 2 представлены сывороточные маркеры фиброза, наиболее часто используемые для мониторирования фиброза миокарда (при АГ) и печени [19].

Представляется актуальным и перспективным изучение чувствительности и специфичности сывороточных маркеров фиброза при хронических заболеваниях печени, сопровождающихся поражением миокарда, а также изучение их взаимосвязи для подтверждения возможных общих патогенетических механизмов фиброобразования.
Подходы к лечению хронической сердечной недостаточности при хронических заболеваниях печени
Хотя при СН, развивающейся вследствие ЦКМ, используют общие принципы лечения ХСН (ингибиторы ангиотензин-превращающего фермента, бета-блокаторы, диуретики, сердечные гликозиды), вопрос о патогенетическом лечении ЦКМ до сих пор остается нерешенным. Необходимо определить, нуждаются ли больные с доклинической дисфункцией миокарда в медикаментозном лечении. В ряде исследований показано, что бета-блокаторы уменьшают исходно увеличенный QT-интервал [20, 21], а длительное лечение антагонистами альдостерона может помочь уменьшить гипертрофию миокарда [22].
Очевидно, необходимы дальнейшие исследования патогенетических механизмов развития фиброза миокарда при хронических заболеваниях печени, что будет способствовать разработке эффективных методов лечения.


