ВВЕДЕНИЕ
Как известно, первые попытки применения методов искусственного интеллекта в области медицины были предприняты более 700 лет назад испанским ученым и богословом Раймундом Луллием. Им была создана первая в мире экспертная система в виде механического устройства, позволяющая ставить диагнозы некоторых заболеваний и давать рекомендации по их лечению.
В середине прошлого столетия благодаря основополагающим работам У. Мак-Каллока, У. Питтса, Ф. Розенблатта появилась новая стратегия создания интеллектуальных систем – нейросетевые технологии. Новая стратегия отличалась тем, что знания заносились в создаваемую интеллектуальную систему не самим разработчиком, а приобретались автоматически в процессе обучения на примерах поведения моделируемой предметной области. В результате открылась возможность занесения в интеллектуальную систему знаний, которые разработчикам системы неизвестны. Последнее обстоятельство оказалось особенно важным для такой научной области, как медицина, в которой много белых пятен, а известные знания плохо поддаются формализации.
В настоящее время наблюдается лавинообразный рост публикаций, посвященных применению нейронных сетей (НС) в медицине. Их основное преимущество заключается в том, что НС извлекают знания непосредственно из жизненного опыта, который богаче теоретического, поэтому нейросетевые диагнозы нередко оказываются более точными, чем поставленные врачом.
Публикуются солидные обзоры [1–4], посвященные перечислению успехов, анализу возможностей и перспектив применения НС в медицине. Хорошие результаты показали модели искусственных НС для диагностики сахарного диабета (СД) [5, 6], психических расстройств [7], рака предстательной железы [8], рака поджелудочной железы [9], рака легких [10], рака молочной железы [2, 3], лейкемии [11], гепатита В [12], инсульта [13], заболеваний почек [14, 15], болезней Паркинсона [16] и Хантингтона [17], для распознавания патологий в кровеносных сосудах [18], диагностики заболеваний сердечно-сосудистой системы [14, 19–23].
Во многих из этих работ, например [22] нейросетевые диагностические системы, рекомендуются для поддержки клинических решений врача, в [10] – в качестве инструмента доклинической диагностики. В [15] отмечается, что нейросетевые системы позволяют сократить время, необходимое для диагностики, в [12] указывается, что применение НС позволяет оптимизировать диагностический процесс и избегать ошибочных диагнозов. В [1] также говорится о том, что НС помогают избегать ошибочных диагнозов, однако утверждается, что они должны рассматриваться только как инструмент для облегчения окончательного решения, за которое отвечает врач. В [9] отмечаются преимущества нейросетевой диагностики по сравнению с ручной диагностикой. В [13] предлагается с помощью НС создавать мобильные приложение, мониторирующие состояние организма пациента, в частности, диагностировать инсульты, происходящие во время сна.
Следует отметить, что во многих упомянутых публикациях, помимо термина «диагностика», иногда используется термин «прогноз», понимаемый, однако, только в узком смысле этого слова – как «исход заболевания» (тот же диагноз), а не процесс, развивающийся во времени. Так, в работе [24] сообщается о применении НС для прогнозирования риска возникновения остеопороза, в работе [25] – для прогнозирования выживаемости при трансплантации печени. Авторы работы [4] призывают исследователей применять методы искусственного интеллекта не только для диагностики, но и для оптимизации курсов лечения пациентов, не объясняя, однако, как это нужно делать, и не приводя примеров такой оптимизации. В работе [22] сообщается о разработке НС, прогнозирующей острый инфаркт миокарда в течение двух недель у пациентов с болью в груди, у которых на ЭКГ признаки инфаркта отсутствуют. В статье [26] сообщается о прогнозировании возможности развития у пациентов в будущем таких патологий, как депрессия, метаболический синдром, инфаркта миокарда, в том числе с зубцом Q, остеопороз. При этом не уточняются сроки наступления «будущего» и как на это «будущее» можно влиять.
По-видимому, впервые возможности НС для прогнозирования развития заболеваний во времени на количественном уровне, а также для подбора оптимальных курсов лечений и образа жизни пациентов, снижающих риски заболеваний, были показаны в ранних публикациях авторов настоящей статьи [27, 28]. Представляемые ниже результаты являются продолжением этих исследований.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Как следует из приведенного анализа литературных источников, НС уже достаточно широко применяются для диагностики различного рода заболеваний. Однако наш собственный опыт применения нейросетевых технологий в промышленности, экономике, политологии, социологии, экологии, психологии, криминалистике, педагогике и других областях [29, 30] (www.PermAi.ru), а также богатейший опыт других исследователей в других научных сферах убедительно показывает, что возможности НС гораздо шире. Дело в том, что после обучения и тестирования НС становится математической моделью изучаемого объекта, в случае медицины – математической моделью (ММ) человека с его физиологическими особенностями и заболеваниями. Это значит, что над ММ изучаемого объекта (человек) можно ставить виртуальные компьютерные эксперименты точно так же, как это делается во многих других дисциплинах. В пределах математической погрешности ММ ведет себя так же, как вел бы себя сам моделируемый объект, т.е. человек. Поэтому НС, как и классические ММ, можно использовать для исследования закономерностей моделируемых объектов. Например, изменяя какой-либо один или несколько входных параметров (возраст, вес, привычки и др.), можно наблюдать за поведением выходных параметров – степенью развития заболеваний человека.
В технических дисциплинах этот метод исследования ММ называется «метод замораживания», поскольку все остальные входные параметры, характеризующие изучаемый объект, в процессе компьютерного эксперимента остаются неизменными. Вообще, метод математического моделирования в его классическом виде уже давно и плодотворно применяется во многих научных отраслях. Например, все мы знаем, что такое ядерная зима – это глобальное похолодание, вызванное серией ядерных взрывов, в результате чего все живое на Земле погибнет. Есть мнение, что именно перспектива ядерной зимы удерживает политиков от развязывания новой мировой войны.
А ведь ядерную зиму никто и никогда не видел!
Ядерная зима – это всего лишь результат виртуальных экспериментов [31], выполненных математиками на ММ. Это результат так называемого сценарного прогнозирования – прогноз того, что будет, если поменять какой-либо один или нескольких входных параметров ММ. Получается, что земная цивилизация до сих пор существует благодаря этим сценарным прогнозам.
Сегодня ни один достаточно сложный технический объект не создается без того, чтобы над его ММ не выполнили виртуальные компьютерные эксперименты. Именно благодаря таким экспериментам ученые и инженеры точно знают, сколько прослужит создаваемый ими объект, какие у него появятся неисправности, как он поведет себя в сложных изменяющихся условиях и что надо делать, чтобы избежать неприятностей.
Ни одному физику не придет в голову ставить эксперименты на атомной бомбе, ядерном реакторе, космическом аппарате, подводной лодке. Эти эксперименты он будет выполнять на ММ, в крайнем случае на физических моделях, т.е. на уменьшенных и упрощенных копиях натурного объекта. Кстати, метод экспериментирования на физических моделях (метод физического моделирования) широко применялся в XIX в. Начиная же с конца XX в. метод физического моделирования почти полностью был вытеснен более прогрессивным методом математического компьютерного моделирования. (В медицине аналогом метода физического моделирования является проверка действия лекарственных препаратов на животных.)
Врачи же вместо того, чтобы виртуально, на ММ пациента, посмотреть, к чему приведет назначаемый ими курс лечения, ставят эксперименты непосредственно на натурном объекте, т.е. на человеке. Они назначают пациенту лекарственные препараты, наблюдают его в течение определенного времени и, если это не поможет, назначают другие препараты. Но представители технических дисциплин применяли метод натурного экспериментирования еще до начала XIX в., и теперь его использование является редким анахронизмом. Поэтому мы вправе говорить о том, что методологическая база медицинской науки отстала от технических дисциплин более чем на сто лет.
Можно попытаться объяснить это отставание тем, что метод математического моделирования в его классическом виде, т.е. основанный на решении краевых задач математической физики, долгое время был недоступен для применения в области медицинских наук ввиду исключительной сложности самого объекта моделирования – человека. Однако новые нейросетевые технологии позволяют преодолеть этот барьер, не прибегая к решению краевых задач. Они позволяют строить нейросетевые ММ пациентов, основываясь на одних только статистических данных, и выполнять над моделями компьютерные эксперименты: виртуально менять образ жизни больного, пробовать различные курсы лечения, подбирать лекарственные препараты, наблюдая на экране компьютера, к чему это приведет в ближайшей и в отдаленной перспективе, т.е. выполнять сценарное прогнозирование.
Следует, однако, заметить, что сценарное прогнозирование методом замораживания входных параметров имеет определенные проблемы. Дело в том, что в действительности, особенно это относится к медицине, входные параметры моделируемого объекта имеют между собой сложные корреляционные взаимозависимости, и при изменении одного из входных параметров другие параметры тоже должны быть изменены согласно этим зависимостям. Например, с возрастом появляются новые симптомы, изменения на электрокардиограмме, эхокардиограмме, в биохимических анализах и т.д. Но такие зависимости, как правило, заранее неизвестны.
В связи с этим в работах [27, 28] авторами настоящей статьи был предложен способ идеологического объединения возможностей двух технологий искусственного интеллекта: НС и экспертных систем. Был предложен оригинальный алгоритм, позволяющий корректировать результаты нейросетевых сценарных прогнозов развития ишемической болезни сердца (ИБС) с помощью знаний, заложенных в шкалу SCORE.
Недостаток предложенного в [27, 28] алгоритма состоит в том, что в общем случае он не может быть применен к другим нозологическим единицам, так как шкала SCORE разработана и верифицирована только для ИБС.
Другой вариант решения указанной проблемы видится в применении метода скользящих окон [29], однако применение этого метода связано с большими трудозатратами и тоже имеет ряд недостатков.
В настоящей работе предлагается новый вариант создания нейросетевых ММ, предназначенных для сценарного прогнозирования более широкого круга заболеваний. Суть этого варианта состоит в том, что мы стремимся использовать по возможности малое количество некоррелированных между собой входных параметров, оставляя многие другие входные параметры за кадром. Например, при разработке нейросетевой системы диагностики и прогнозирования развития сердечно-сосудистых заболеваний мы принципиально отказываемся от использования таких важных для постановки диагнозов данных, как результаты биохимического анализа, электрокардиографии, коронарографии, а также многих специфических методов верификации заболеваний. Вместо этого мы вводим максимально возможное количество параметров, характеризующих организм пациента: пол, возраст, цвет глаз, цвет волос, группу крови, наличие поперечной складки на мочке уха, место и время рождения, генетические параметры, наследственность и др. Мы информируем НС о том, в какой среде живет пациент, как он питается, какой образ жизни ведет, о наличии у него братьев и сестер, его профессии, наличии вредных привычек, занятиях физкультурой и спортом, сообщаем сведения о ранее перенесенных заболеваниях, о наличии заболеваний у кровных родственников, а также сообщаем минимальное количество жалоб пациента. Иногда при умелом подборе входных параметров этих данных оказывается достаточно, чтобы обучить НС ставить диагнозы некоторых заболеваний с приемлемой степенью точности.
Еще раз обратим внимание, что в такие ММ в качестве входных параметров не входят данные многих специальных видов обследования, таких как эхо-, кардио-, коронарография, магниторезонансные и рентгенографические исследования и т.д. Не входят также многие жалобы пациента, имеющие высокую корреляцию с выставляемым диагнозом. Поэтому в последующих вычислительных экспериментах при применении метода замораживания на эти оставшиеся за кадром данные не накладывается ограничений, т.е. они не замораживаются. Таким образом, мы преодолеваем проблему метода замораживания – не нарушаем взаимозависимости между входными параметрами, влияющими на постановку диагноза пациента, и НС становятся пригодными для выполнения виртуальных компьютерных экспериментов сценарного прогнозирования.
Недостатком предлагаемого метода создания моделей является то, что им могут успешно пользоваться только исследователи, имеющие достаточный опыт нейросетевого моделирования и очень хорошо разбирающиеся в моделируемой предметной области. Причем даже в этом случае успех применения метода не всегда гарантирован и зависит от особенностей моделируемой предметной области.
С учетом вышесказанного нами была создана нейросетевая диагностико-прогностическая система, состоящая из комплекса НС, каждая из которых соответствовала различным нозологическим формам сердечно-сосудистых заболеваний и содержала 27 входных нейрона для ввода параметров, характеризующих общие сведения о пациенте, историю и образ его жизни, а также минимальное количество жалоб пациента. Для обучения нейронных сетей было использовано множество данных о 1000 пациентах Отделения неотложной кардиологии Городской клинической больницы № 4 г. Перми.
Генерация НС, их обучение, оптимизация и тестовые испытания осуществлялись в нейропакете [32] для каждой нозологической единицы по методике [29, 30]. Наилучшими оказались НС персептронного типа с одним скрытым слоем, содержащим от одного до четырех сигмоидных нейронов.
После обучения НС были объединены пользовательским интерфейсом в единую нейросетевую диагностико-прогностическую систему. Пользовательский интерфейс выполнен так, что результаты работы системы представляются графически в виде восьми столбцов, высота каждого из которых отражает степень развития соответствующей нозологической формы сердечно-сосудистого заболевания, как показано на рис. 1–10.
Проверка диагностико-прогностических свойств системы осуществлялась на тестовом множестве из 250 данных о пациентах, не вошедших в обучающее множество. Величина среднеквадратичной относительной ошибки тестирования составила для инфаркта миокарда 30% (что соответствовало чувствительности 81,4% и специфичности 90,0%), для стенокардии стабильной – 22 %, для стенокардии нестабильной – 18%, для ИБС – 20%, для артериальной гипертензии – 12%, для аритмии и блокад сердца – 22%, для хронической сердечной недостаточности (ХСН) – 12%, для острой сердечной недостаточности (ОСН) – 35%.
Следует отметить, что точность постановки диагнозов можно было бы повысить за счет ввода дополнительных входных параметров, например, добавить данные кардио-, эхо- коронарографических исследований, текущие общий и биохимический анализ крови и т.д., как это делалось в наших ранних работах [27, 28]. Но тогда НС стали бы не пригодны для сценарного прогнозирования, так как эти дополнительные входные параметры пришлось бы замораживать, что противоречит действительности. Например, при виртуальном увеличении возраста обязательно должны изменяются показатели биохимического анализа крови, данные эхокардиографических исследований и пр.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Виртуальные компьютерные эксперименты выполнялись на ММ трех пациентов.
Пациент 1. Мужчина в возрасте 50 лет (родился 09.05.1967), рост 177 см, вес 80 кг, 2 группа крови, резус-фактор положительный, курит, физзарядкой не занимается, есть заболевания сердца у кровных родственников, гипертонической болезни (ГБ) нет, СД нет, нарушений мозгового кровообращения не было, ранее диагноз болезней сердца не ставился, кардиохирургических вмешательств не было, имеется тромбофлебит, болей в грудной клетке нет, жалуется на одышку при физическом напряжении, приступов удушья по ночам нет, сердцебиения бывают, ощущений перебоев в работе сердца нет, отеков конечностей и лица нет, на головокружения и головные боли не жалуется.
Пациент 2. Женщина в возрасте 39 лет (родилась 20.11.1977), рост 160 см, вес 60 кг, 1 группа крови, резус -фактор положительный, курит, физзарядкой не занимается, заболеваний сердца у кровных родственников нет, ГБ нет, СД нет, нарушений мозгового кровообращения не было, ранее диагноз болезней сердца не ставился, кардиохирургических вмешательств не было, варикозной болезни или тромбофлебита нет, болей в грудной клетке нет, одышки нет, приступов удушья по ночам нет, сердцебиений нет, ощущения перебоев в работе сердца нет, имеются отеки лица, жалуется на частые головокружения и головную боль.
Пациент 3. Мужчина в возрасте 50 лет (родился 15.08.1966), рост 180 см, вес 75 кг, 4 группа крови, резус-фактор отрицательный, курит, физзарядкой не занимается, есть заболевания сердца у кровных родственников, ГБ нет, СД нет, нарушений мозгового кровообращения не было, ранее диагноз болезней сердца ставился, кардиохирургических вмешательств не было, имеется тромбофлебит, болей в грудной клетке нет, жалуется на одышку в покое, приступов удушья по ночам нет, сердцебиений нет, имеются ощущения перебоев в работе сердца, имеются отеки конечностей, жалуется на частые головокружения и головную боль.
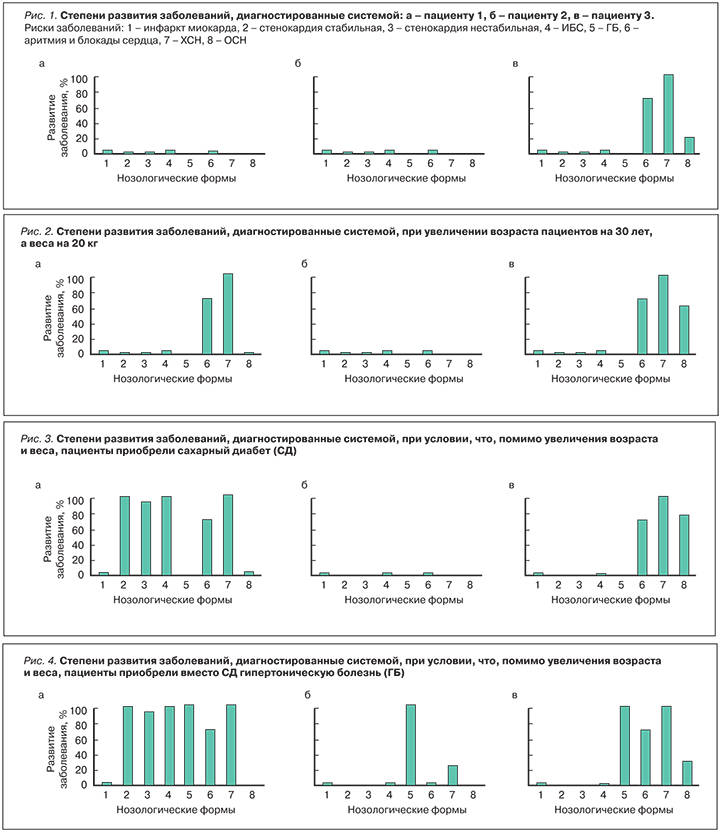
После ввода параметров пациентов нейросетевая система поставила диагнозы, представленные в графической форме на рис. 1а пациенту 1, на рис. 1б пациенту 2, на рис. 1в пациенту 3.
Как видно из рисунка, у пациентов 1 и 2 система не выявила рисков сердечно-сосудистых заболеваний, тогда как у пациента 3 она поставила диагноз: аритмии и блокады сердца – 70%, ХСН – 100%, ОСН – 20%.
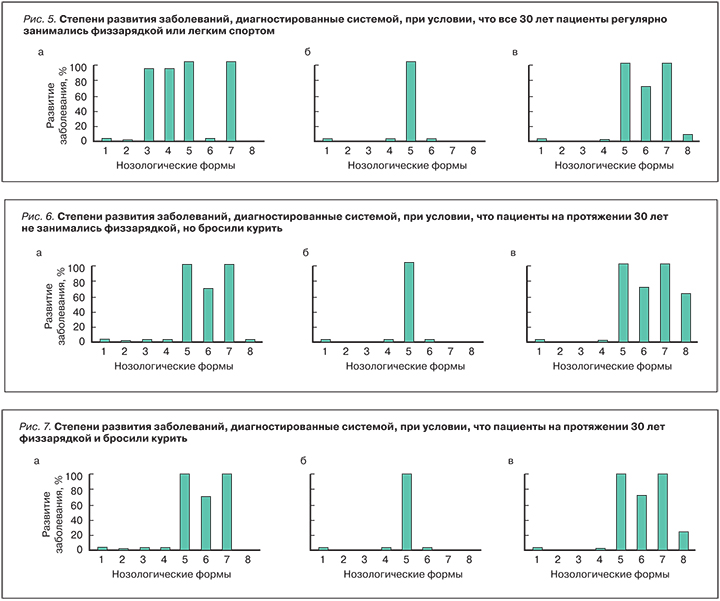
На рис. 2 в аналогичной форме приведены результаты сценарного прогнозирования развития заболеваний при условии, что возраст пациентов увеличился на 30 лет, а вес – на 20 кг. Все остальные параметры пациентов сохранены неизменными. Как видно из рисунка, у пациента 1 система прогнозировала появление риска аритмии и блокад сердца – 70% и риска ХСН – 100%. У пациента 2 риски сердечно-сосудистых заболеваний не обнаружились, а у пациента 3 система прогнозировала появление риска аритмии и блокад сердца – 70%, риска ХСН – 100% и риска ОСН – 60%.
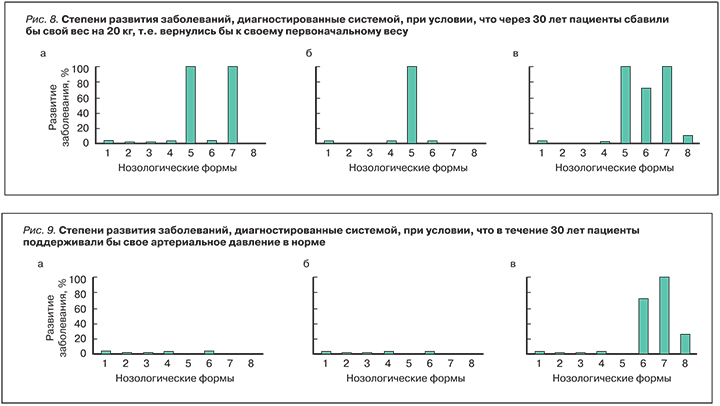
На рис. 3 приведены результаты сценарного прогнозирования развития сердечно-сосудистых заболеваний при условии, что, помимо увеличения возраста и веса, пациенты заболели СД. Как видно из рисунка, у пациента 1 заболевание СД стимулировало появление риска заболевания стабильной стенокардией на 98%, нестабильной стенокардией – на 91%, ИБС – 98%. Риски аритмии и блокады сердца, а также ХСН остались на прежнем высоком уровне – 70 и 100% соответственно. У пациента 2 СД не вызвал появления каких-либо рисков заболеваний сердечно-сосудистой системы, тогда как у пациента 3 СД привел к возрастанию риска ОСН до 75%.
На рис. 4. результаты прогнозирования отличаются тем, что у пациентов виртуально убрали диагноз СД, а вместо него добавили ГБ. Данный прогноз соответствует тому, что пациентам во время диагностики (30 лет назад) дали рекомендацию воздерживаться от сладкого, а за артериальным давлением они не следили. Как видно из рисунка, добавление ГБ вместо СД у пациента 1 картину сценарного прогнозирования не изменило, у пациента 2 добавился риск ХСН 26%, а у пациента 3 снизился риск ОСН с 75 до 30%.
На рис. 5 результаты сценарного прогнозирования отличаются тем, как если бы, помимо всего прочего, пациенты все эти годы (30 лет) регулярно занимались физзарядкой или легким спортом. Как видно из рисунка, в этом случае у пациента 1 риск стабильной стенокардии упал бы с 98 до 2%, риск нестабильной стенокардии остался бы на прежнем уровне, риск ИБС снизился бы с 98 до 91%, а риск аритмии и блокад сердца – с 70 до 4%. У пациента 2 риск ХСН снизился бы с 26% до нуля, а у пациента 3 риск ОСН снизился бы с 30 до 8%.
На рис. 6 представлены результаты сценарного прогнозирования в случае предположения, что пациенты по-прежнему не занимались физзарядкой, но бросили курить. В этом случае у пациента 1 упали бы до нуля риски обеих стенокардий и ИБС, однако риск аритмии и блокад сердца сохранился бы на уровне 70%, как на рис. 4. У пациента 2 картина сценарного прогнозирования сохранилась бы, как и на рис. 5, т.е. для него решение бросить курить или вместо этого заняться физкультурой одинаково положительно сказывается на состоянии сердечно-сосудистой системы, а именно риска ХСН в обеих вариантах поведения пациента удалось бы избежать. Для пациента 3 отказ от курения приведет к возрастанию ОСН с 8 до 63%. Такому пациенту бросать курить не рекомендуется. По-видимому, привычка курения позволяет ему нивелировать получаемые стрессы, что положительно сказывается на состоянии его сердечно-сосудистой системы, в частности, на предрасположенности к ОСН.
Результаты, представленные на рис. 7, получены при предположении, что регулярной физзарядкой пациенты все-таки занимались (притом что они бросили курить). В этом случае прогнозные диагнозы первых двух пациентов не изменились, а пациенту 3 удалось снизить риск ОСН с 63 до 22%. Напомним, что когда пациент 3 занимался физзарядкой и при этом еще и курил, то прогноз риска ОСН составил всего 8% (см. рис. 5). Отсюда следует вывод, что для минимизации риска ОСН этому пациенту полезно заниматься физзарядкой и при этом не бросать курить.
На рис. 8 представлены результаты сценарного прогнозирования в предположении, что пациенты сбавили свой вес на 20 кг, т.е. вернулись к своему первоначальному весу, который у них был 30 лет назад. В этом случае риск аритмии и блокад сердца пациента 1 с 70% упал бы до 4%, риски сердечно-сосудистых заболеваний пациента 2 остались бы прежними, а риск ОСН у пациента 3 снизился бы с 22 до 10%.
На рис. 9 представлены результаты сценарного прогнозирования при предположении, что пациенты поддерживали бы в норме артериальное давление. Как видно из рисунка, это позволило бы пациенту 1 снизить риск ХСН с 100% до нуля. Показатели здоровья пациента 2 остались бы без изменений, а пациент 3, наоборот, повысил бы риск ОСН с 10 до 25%.
ЗАКЛЮЧЕНИЕ
В статье рассмотрена возможность создания нейросетевых медицинских систем, позволяющих, помимо диагностики, выполнять долгосрочные прогнозы развития заболеваний, а также прогнозировать возникновение новых заболеваний в будущие периоды жизни пациента. Такие возможности позволяют подбирать оптимальный образ жизни пациентов, а также способы профилактики и курсы лечения заболеваний.
Приведенные в статье результаты виртуальных компьютерных экспериментов в большинстве случаев не противоречат здравому смыслу опытного врача-диагноста. Однако встречаются и исключения. Так, рекомендация о прекращении курения пациенту 3 может привести к возрастанию риска ОСН, о чем свидетельствуют данные рис. 6в. Не всегда полезно поддерживать в норме артериальное давление, так как это тоже может привести к возрастанию риска ОСН, что следует из рис. 9в.
В целом результаты компьютерного моделирования подтвердили ранее полученный методом математического моделирования вывод [27, 28] о том, что рекомендации по профилактике и лечению кардиологических больных следует давать строго индивидуально с учетом физиологических особенностей организма пациентов. Если для одних пациентов такие распространенные рекомендации, как «отказаться от курения», «ограничить употребление сладкого», «принимать препараты, снижающие артериальное давление», «регулярно заниматься физзарядкой» и т.д., действительно полезны, то другим пациентам они могут причинить вред. Выявить таких нестандартных пациентов и избежать ошибочных рекомендаций можно с помощью предлагаемой интеллектуальной системы.
Демонстрационный прототип интеллектуальной системы выложен в разделе «Проекты» на сайте Пермского отделения Научного совета РАН по методологии искусственного интеллекта www.PermAi.ru и может применяться для доклинической диагностики населения, поддержки врачебных решений, в качестве тренажера в медицинских вузах и центрах повышения квалификации и др.


