Предиабетом называют ранние нарушения углеводного обмена, характеризующиеся наличием инсулинорезистентности (ИР) и первичной или вторичной дисфункции β-клеток, не имеющие клинических проявлений, приводящие к высокому риску развития сахарного диабета 2 типа (СД2). Для предиабета характерны значения уровня глюкозы плазмы, недостаточные для постановки диагноза «сахарный диабет». К ранним нарушениям углеводного обмена относят нарушенную толерантность к глюкозе (НТГ) и нарушение гликемии натощак (НГН). Множество исследований подтверждают, что нарушенная толерантность к глюкозе является самостоятельным предиктором развития не только СД2, но и сердечно-сосудистых заболеваний (ССЗ). В исследовании DECODE были получены данные, по результатам которых у лиц с нарушенной толерантностью к глюкозе постпрандиальная гипергликемия ассоциирована с увеличением риска сердечно-сосудистой смертности почти в два раза по сравнению с лицами с нормогликемией [1]. При этом среди больных ССЗ растет число лиц с различными нарушениями углеводного обмена, в частности, в многоцентровом исследовании EuroHeart показано, что у 1/3 больных, госпитализированных с острым коронарным синдромом, выявлено НТГ, при этом СД2 зарегистрирован у 20%, а НГН – у 7% больных [2]. Таким образом, профилактические меры по выявлению и контролю ранних нарушений углеводного обмена, успех которых напрямую зависит от достижения оптимального гликемического контроля и нормализации ассоциированных нарушений, играют важную роль в предупреждении сердечно-сосудистых осложнений.
Согласно определению ВОЗ к ранним нарушениям углеводного обмена (предиабет) относится:
- НГН – нарушение углеводного обмена, проявляющееся повышением уровня глюкозы плазмы натощак (ГПН) от 6,1 до 6,9 ммоль/л;
- НТГ – нарушение углеводного обмена, при котором значения уровня глюкозы плазмы после перорального глюкозотолерантного теста (ПГТТ) варьируются от 7,8 до 11,0 ммоль/л;
- сочетание НТГ и НГН.
ЭПИДЕМИОЛОГИЯ
Согласно данным Международной диабетической ассоциации, в настоящее время в мире зарегистрировано около 425 млн больных СД2, общемировая распространенность НТГ среди лиц 20–79 лет составила 6,7% (4,5–12,1%), причем, по прогнозам, к 2040 г. эта цифра увеличится до 7,8% (5,2–14,9%) [3]. В России в Государственном регистре больных СД на 01.01.2016 зарегистрированы 4,3 млн больных СД (по обращаемости в лечебные учреждения), около 4,0 млн из них имеют СД2. По данным эпидемиологического исследования NATION (завершилось в 2015 г.), изучавшего распространенность СД2 в РФ, в РФ около 5,9 млн человек 20–79 лет больны СД2, среди которых 2,9% не выявлены и не имеют диагноза. Распространенность предиабета, по данным исследования NATION, составила 19,3% (около 20,7 млн). И СД2, и предиабет ассоциировались с увеличением массы тела и возрастом обследуемых лиц [4].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Основной причиной предиабета является относительный дефицит инсулина и выраженная периферическая ИР в тканях-мишенях. Считается, что в патогенез ранних нарушений углеводного обмена вовлечены снижение действия инсулина в печени, жировой и мышечной тканях, обусловленное ИР (снижение опосредованной инсулином утилизации глюкозы тканями) тканей, а также снижение инкретиновых эффектов, которые сопровождаются сначала компенсаторной гиперфункцией, а в последующем секреторной дисфункцией β-клеток и снижением секреторного ответа. В прогрессирующей дисфункции β-клеток поджелудочной железы, характеризующей предиабет, этиологическую роль играют множество факторов, в том числе генетическая предрасположенность, резистентность к инсулину, алиментарные факторы, ассоциированные с увеличением потребления простых углеводов и жиров, глюкозотоксичность, липотоксичность и ожирение, нарушение выработки и действия инкретинов. Секреторная дисфункция β-клеток на ранних этапах характеризуется нарушением пульсового ритма и замедлением «ранней» секреции инсулина в ответ на увеличение уровня глюкозы в крови. В результате 1-я (быстрая) фаза секреции, которая обеспечивается путем опорожнения везикул с накопленным инсулином, фактически устраняется, а 2-я (медленная) фаза секреции осуществляется постоянно в тоническом режиме в ответ на хроническую умеренную гипергликемию. В результате описанных изменений у пациентов развивается состояние гиперинсулинемии, хотя уровень гликемии на фоне ИР остается выше нормы, несмотря на избыточную секрецию инсулина.
У лиц с ранними нарушениями углеводного обмена снижается активность и количество белков-транспортеров глюкозы на уровне мышечных и жировых клеток (GLUT-4).
Имеющиеся нарушения пострецепторных механизмов передачи инсулинового сигнала сочетаются с прогрессирующим снижением выработки инсулина, в силу истощения β-клеток приводят к повышению уровня глюкозы до значений, соответствующих НТГ (7,8–11,0 ммоль/л после ПГТТ с 75 г глюкозы). Из-за прогрессирующей ИР гепатоцитов и портальной гиперинсулинемии происходит гиперпродукция глюкозы печенью, приводящая к развитию гипергликемии натощак (НГН 6,1–6,9 ммоль/л) [5].
ФАКТОРЫ РИСКА РАЗВИТИЯ НАРУШЕНИЙ УГЛЕВОДНОГО ОБМЕНА
Выделяют ряд состояний, при которых высока вероятность выявления ранних нарушений углеводного обмена. К их числу относят такие состояния, как ожирение, артериальная гипертензия (АГ), нарушение липидного обмена (гипертриглицеридемия, низкий уровень холестерина липопротеидов высокой плотности), жировая дистрофия печени, клинические проявления атеросклероза и т.д.
Проведенное в России исследование NATION показало корреляцию нарушений углеводного обмена с возрастом и индексом массы тела (ИМТ) обследованных. Частота невыявленных СД2 и других нарушений углеводного обмена существенно возрастала с 40–45-летнего возраста. Сходные данные были получены в различных этнических группах на различных континентах. Нарушения углеводного обмена коррелировали с повышением ИМТ, отягощенным наследственным анамнезом, малоподвижным образом жизни, АГ.
К факторам риска развития СД2 (у лиц европеоидной расы) относят:
- возраст > 45 лет;
- избыточную массу тела и ожирение (ИМТ > 25 кг/м2*);
- семейный анамнез СД (родители или сибсы с СД2);
- привычно низкую физическую активность;
- НГН или НТГ в анамнезе;
- гестационный СД (ГСД) или рождение крупного плода в анамнезе;
- АГ (> 140/90 мм рт.ст. или медикаментозная антигипертензивная терапия);
- холестерин липопротеидов высокой плотности (ЛПВП) < 0,9 ммоль/л и/или уровень триглицеридов (ТГ) > 2,82 ммоль/л;
- синдром поликистозных яичников;
- наличие ССЗ.
При наличии перечисленных факторов риска необходим регулярный контроль состояния углеводного обмена [6].
ДИАГНОСТИКА ПРЕДИАБЕТА
В клинической практике предиабет выявляют случайно при плановых диспансерных обследованиях населения, обращениях по поводу другого заболевания или прицельного обследования пациентов для выявления нарушений углеводного обмена, прежде всего СД2. Важнейшей особенностью предиабета является отсутствие специфической клинической симптоматики, что в основном объясняется запуском компенсаторных защитных механизмов, таких, например, как выведение избыточной глюкозы с мочой (незначительной глюкозурия) и др. В большинстве случаев пациентов беспокоят избыточная масса тела или ожирение, АГ и патология сердечно-сосудистой системы. На фоне имеющейся ИР могут отмечаться и выраженные клинические проявления неалкогольной жировой болезни печени (НАЖБП), подагрического артрита, гиперурикемия. Часто в анамнезе имеется ГСД или крупный плод.
 При осмотре у пациентов с предиабетом часто отмечается увеличение окружности талии (более 80 см у женщин и более 94 см у мужчин), распределение жировой массы преимущественно по абдоминальному типу.
При осмотре у пациентов с предиабетом часто отмечается увеличение окружности талии (более 80 см у женщин и более 94 см у мужчин), распределение жировой массы преимущественно по абдоминальному типу.
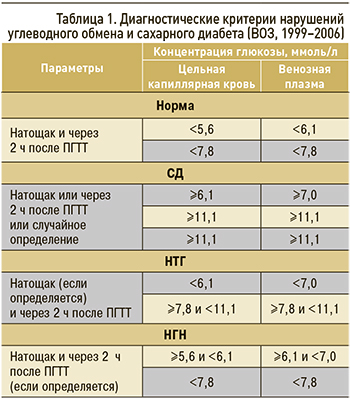
Лабораторная диагностика. Учитывая тот факт, что ранние нарушения углеводного обмена не сопровождаются клиническими проявлениями, для адекватного своевременного выявления целесообразно проведение мероприятий по скринингу нарушений углеводного обмена (табл. 1). В качестве скрининговых методов исследования рекомендуется измерение уровня ГПН или ПГТТ с 75 г глюкозы.
Диагноз «предиабет» ставят при следующих лабораторных показателях:
- уровень ГПН 6,1–6,9 ммоль/л;
- и/или диапазон глюкозы плазмы после ПГТТ 7,8–11,0 ммоль/л;
- уровень гликированного гемоглобина 5,7–6,4%.
Проведение скрининга показано каждые 3 года всем лицам старше 45 лет. Ежегодное его проведение рекомендовано людям со следующими факторами риска развития СД2: ИМТ более 25 кг/ м2 и/или окружность талии более 80 см у женщин и более 94 см у мужчин, семейный анамнез по СД2, малоподвижный образ жизни, начальные нарушения углеводного обмена по данным предыдущих исследований, ГСД или рождение крупного плода (более 4 кг) в анамнезе, уровни ЛПВП менее 0,9 ммоль/л, ТГ более 2,8 ммоль/л, синдром поликистозных яичников, НАЖБП, АГ.
ЛЕЧЕНИЕ ПРЕДИАБЕТА
Существует несколько методов коррекции ранних нарушений углеводного обмена, включая изменение образа жизни и применение антигипергликемических препаратов.
Немедикаментозное лечение – основополагающая часть ведения пациента с нарушениями углеводного обмена. Основные меры немедикаментозного лечения можно охарактеризовать как ведение здорового образа жизни: диета, направленная на снижение массы тела или поддержание нормальной массы тела; отказ от курения и избыточного потребления алкоголя, а также дозированные физические нагрузки. Первоочередная цель – стойкое уменьшение массы тела на 5–10%. На настоящий момент установлено: единственное, что действительно приводит к уменьшению массы тела, – это создание суточного дефицита энергии, т.е. преобладание расхода энергии над ее поступлением. Такой темп снижения массы тела в течение 6–12 мес ассоциирован с уменьшением риска для здоровья и осуществим для большинства больных [7, 8].
Общие принципы построения рационального питания:
- дробное питание: не менее 3 основных приемов пищи и 2 перекусов в день. Питательные продукты и напитки должны обеспечивать поступление витаминов, минералов;
- основу потребляемых жиров должны составлять поли- и мононенасыщенные жирные кислоты;
- употребление не менее 5 порций овощей и фруктов ежедневно;
- в белковом компоненте питания желательно преобладание нежирных сортов рыбы, молока, кисломолочных продуктов и творога, мяса;
- в углеводном компоненте питания желательно преобладание сложных углеводов с низким гликемическим индексом, максимальное ограничение простых (быстрых) углеводов;
- рекомендовано увеличение потребление клетчатки до 14 г волокон/1000 килокалорий в сутки или около 25 г/сут для взрослых женщин и 38 г/ сут для взрослых мужчин;
- ограничение потребления натрия до 2300 мг/ сут [7].
 Рекомендуется соблюдение умеренной гипокалорийной диеты. Не существует стандартного плана питания или шаблона еды, который работает универсально для всех людей с ожирением или предиабетом. Хотя многочисленные исследования ставили задачу определить оптимальное сочетание макронутриентов в плане питания людей с СД, систематический обзор доступных исследований обнаружил, что нет идеального сочетания макроэлементов. Их пропорции, по-видимому, могут быть индивидуальными и зависеть от метаболического статуса пациента (например, липидного профиля, функции почек) и/или пищевых предпочтений. В среднем было замечено, что люди с СД получают около 45% своих калорий из углеводов, ~36–40% калорий из жира, а остальное (~16–18%) из белка.
Рекомендуется соблюдение умеренной гипокалорийной диеты. Не существует стандартного плана питания или шаблона еды, который работает универсально для всех людей с ожирением или предиабетом. Хотя многочисленные исследования ставили задачу определить оптимальное сочетание макронутриентов в плане питания людей с СД, систематический обзор доступных исследований обнаружил, что нет идеального сочетания макроэлементов. Их пропорции, по-видимому, могут быть индивидуальными и зависеть от метаболического статуса пациента (например, липидного профиля, функции почек) и/или пищевых предпочтений. В среднем было замечено, что люди с СД получают около 45% своих калорий из углеводов, ~36–40% калорий из жира, а остальное (~16–18%) из белка.
Вторым компонентом коррекции образа жизни является увеличение физической активности. На этапе снижения массы тела они дополняют редуцированную по калорийности диету и позволяют стимулировать метаболизм, улучшать энергетический баланс, продлевать и повышать эффективность пищевых ограничений. Рекомендуется регулярная физическая активность умеренной интенсивности (быстрая ходьба, плавание, велосипед, танцы) длительностью не менее 30 мин в день, максимально часто в неделю (совокупно не менее 150 мин в неделю).
Итак, физическая активность обусловливает:
- уменьшение числа сердечно-сосудистых факторов риска;
- снижение ИР;
- уменьшение выраженности депрессии;
- уменьшение потери тощей массы во время снижения массы тела;
- снижение риска развития СД2, остеопороза, ССЗ.
Каждый из компонентов программы изменения образа жизни (и диета, и физическая активность) может влиять на различные факторы риска, в том числе и на метаболические нарушения, что в конечном счете приводит не только к улучшению показателей углеводного обмена, но и к общему снижению сердечно-сосудистого риска. К негативным сторонам программ по изменению образа жизни следует отнести отсутствие достаточной мотивации у пациентов, низкую приверженность таким методам лечения, неспособность большинства пациентов к пожизненному соблюдению здорового образа жизни, в связи с чем имеется необходимость в использовании, наряду с немедикаментозными методами профилактики СД2, фармацевтических препаратов.
 Медикаментозное лечение. К применению медикаментозных методов лечения прибегают в отсутствие адекватного эффекта немедикаментозных мер и высокой степени риска развития СД2.
Медикаментозное лечение. К применению медикаментозных методов лечения прибегают в отсутствие адекватного эффекта немедикаментозных мер и высокой степени риска развития СД2.
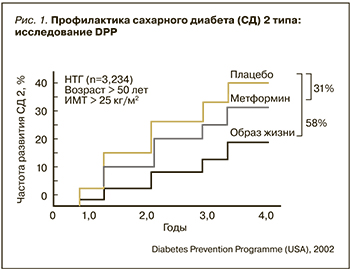
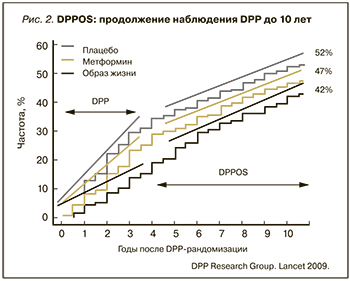
Была проведена целая серия исследовательских программ по оценке наиболее целесообразного и обоснованного пути ведения пациентов с предиабетом, в рамках которых использовали противодиабетические средства, препараты для снижения массы тела, антигипертензивные средства и др. Опираясь на высокие современные требования к медикаментозной профилактике хронических заболеваний и исходя из результатов исследований по профилактике СД2, большинство международных экспертных ассоциаций рекомендует метформин на любых стадиях предиабета DPP (Diabetes Prevention Program) и DPPOS (Diabetes Prevention Program Outcomes Study) – основные исследования, в которых исследовалась эффективность метформина для профилактики СД2. По результатам исследования DPP, риск развития СД у лиц с предиабетом в группе изменения образа жизни снижался на 58% по сравнению с группой плацебо, а в группе приема метформина – на 31% по сравнению с группой плацебо [9] (рис. 1). В исследовании DPPOS, в котором оценивались в долгосрочной перспективе вмешательства, инициированные в DPP, результаты в группе активного изменения образа жизни имели тенденцию к ухудшению при относительно стабильных результатах в группе приема метформина [10] (рис. 2).
С 2016 г. в инструкции по медицинскому применению оригинального метформина одобрено показание «профилактика СД2 у пациентов с предиабетом и дополнительными факторами риска развития СД2».
Метформин не оказывает прямого стимулирующего влияния на секрецию инсулина, а со временем ее даже уменьшает, чем и обусловлено отсутствие гипогликемических эпизодов при его применении, в том числе у здоровых лиц, предопределяя высокую безопасность. Для метформина характерна дозозависимость гипогликемизирующего эффекта, поэтому важно принимать оптимальную суточную дозировку, которая на стадиях предиабета в среднем составляет 1500–1700 мг/сут.
Большой преференцией применения метформина, в том числе на стадиях предиабета, является потенциальная кардиопротекция у пациентов высокого сердечно-сосудистого риска, которым следует считать лиц с НТГ и ГНГ. Современные международные стандарты по профилактике ССЗ интегрируют метформин и рекомендуют его раннее назначение как обоснованную стратегию для лиц с предиабетом и СД2. Это стало возможным еще и потому, что за 60 лет клинического применения метформин зарекомендовал себя как исключительно безопасный препарат с хорошей переносимостью, не вызывающий гипогликемий и обеспечивающий целый ряд таких уникальных преимуществ, как положительная динамика массы тела, показателей липидного и углеводного обменов, уровня АД, а главное, увеличение продолжительности жизни уязвимых пациентов.
Несмотря на обилие за последние годы инновационных стратегий в диабетологии, метформин остается крайне интересным и привлекательным для применения у лиц с нарушениями углеводного метаболизма разной степени выраженности по целому ряду уникальных характеристик. Необходимо учитывать все противопоказания к назначению метформина перед началом терапии (гипоксические состояния: сердечная, коронарная, дыхательная, почечная, печеночная недостаточность, злоупотребление алкоголем). В качестве начальной дозы метформина при предиабете рекомендуется применять 850 мг/сут во время ужина в течение 1-й недели терапии. Со 2-й недели терапии рекомендуется увеличить дозу препарата до 850 мг 2 раза в сутки и продолжать прием препарата по данной схеме в последующем. При возможном риске развития побочных эффектов со стороны желудочно-кишечного тракта можно начать терапию с 500 мг/сут в течение 1-й недели терапии (во время ужина) с последующим увеличением дозы до 850 мг 2 раза в сутки к концу 1-го месяца терапии. ГПН следует контролировать с частотой 1 раз в 3 мес, ПГТТ проводить 1 раз в 6 мес на фоне отмены препарата или исследование гликированного гемоглобина без отмены препарата с целью исключения СД2.
При непереносимости метформина с «обычной» фармакокинетикой или несоблюдении пациентом кратности приема препарата рекомендуется прием метформина замедленного высвобождения в дозе 750 мг – по 2 табл. во время ужина.
При хорошей переносимости также возможно рассмотрение акарбозы для контроля ранних нарушений углеводного обмена. Акарбоза – препарат группы ингибиторов α-глюкозидаз, является одним из безопасных препаратов, влияющих на постпрандиальную гликемию и ИР [8]. Результаты российского исследования АПРЕЛЬ продемонстрировали, что акарбоза позитивно воздействует на основные факторы сердечно-сосудистого риска – избыточную массу тела, постпрандиальную гипергликемию и АГ [12]. В исследовании STOP-NIDDМ продемонстрирована эффективность акарбозы в профилактике СД2 у пациентов с НТГ. По результатам данного исследования у больных, получавших акарбозу, относительный риск развития СД2 был на 36% ниже, чем в группе плацебо. Относительный риск развития новых случаев АГ на фоне активного лечения снизился на 34%, инфаркта миокарда – на 91%, а любого зафиксированного сердечно-сосудистого события – на 49% [11]. Первые две недели рекомендовано принимать акарбозу в дозе 150 мг/сут (по 50 мг 3 раза) непосредственно перед или вовремя еды, затем дозу постепенно увеличивают до 100 мг 3 раза в сутки с учетом переносимости. Противопоказаниями к применению акарбозы являются заболевания кишечника, сопровождающиеся нарушением всасывания, язвы, дивертикулы, трещины, стенозы. При приеме данного препарата могут быть выражены нежелательные явления со стороны желудочно-кишечного тракта, такие как метеоризм и диарея, что может быть причиной ограниченного его применения.
Проводились и другие исследования, оценивавшие возможности медикаментозной профилактики СД2:
- CANOE – росиглитазон + метформин. Относительный риск развития заболевания снизился на 66% [13];
- DREAM – росиглитазон. Снижение риска на 60% [14];
- XENDOS – орлистат. Уменьшение риска на 37,3% [15];
- SCALE – лираглутид. В контрольной группе развитие СД2 было отмечено у меньшего числа пациентов по сравнению с группой плацебо: 4 против 14 случаев [16].
При этом следует подчеркнуть, что для профилактики СД перечисленные препараты официально не зарегистрированы.
ЗАКЛЮЧЕНИЕ
Таким образом, модификация образа жизни остается краеугольным камнем для лиц с ожирением, предиабетом или СД2. Было показано, что фармакологическая терапия, содействующая снижению массы тела и/или снижающая ИР, эффективно замедляет или предотвращает развитие предиабета в СД2. Адекватные меры по своевременному контролю ранних нарушений углеводного обмена играют важную роль в профилактике осложнений, обусловленных нарушениями углеводного обмена, в связи с чем пациенты с предиабетом должны находиться под регулярным контролем врача-эндокринолога или терапевта.


