КЛАССИФИКАЦИЯ
Выделяют две основные формы синдрома гиперкортицизма – эндогенный и экзогенный. Экзогенный гиперкортицизм (ЭГ) обусловлен длительным применением синтетических глюкокортикостероидов (ГКС) в супрафизиологических дозах. ЭГ связан с гиперпродукцией ГКС корой надпочечников и может быть АКТГ (адренокортикотропный гормон)-зависимым или АКТГ-независимым. Отдельно различают функциональный гиперкортизолизм на фоне других заболеваний и состояний (табл. 1).
 К АКТГ-зависимому гиперкортицизму могут приводить болезнь Иценко–Кушинга (БИК) или АКТГ-эктопированный синдром. БИК – это тяжелое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией АКТГ опухолью гипофиза, которое приводит к хронической повышенной выработке кортизола корой надпочечников и развитию эндогенного гиперкортицизма [1]. АКТГ-эктопированный синдром развивается вследствие секреции кортикотропин-рилизинг-гормона (КРГ) и/или АКТГ опухолями органов эндокринной и неэндокринной системы. АКТГ-независимый гиперкортицизм обусловлен опухолью или гиперплазией надпочечников (кортикостерома, кортикобластома, макронодулярная или микронодулярная гиперплазия коры надпочечников).
К АКТГ-зависимому гиперкортицизму могут приводить болезнь Иценко–Кушинга (БИК) или АКТГ-эктопированный синдром. БИК – это тяжелое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией АКТГ опухолью гипофиза, которое приводит к хронической повышенной выработке кортизола корой надпочечников и развитию эндогенного гиперкортицизма [1]. АКТГ-эктопированный синдром развивается вследствие секреции кортикотропин-рилизинг-гормона (КРГ) и/или АКТГ опухолями органов эндокринной и неэндокринной системы. АКТГ-независимый гиперкортицизм обусловлен опухолью или гиперплазией надпочечников (кортикостерома, кортикобластома, макронодулярная или микронодулярная гиперплазия коры надпочечников).
ЭПИДЕМИОЛОГИЯ
Последние многоцентровые исследования в различных странах убедительно показали распространенность ЭГ как 1 случай на 138 человек среди лиц высокого риска (с артериальной гипертензией и сахарным диабетом 2 типа), а, по некоторым данным, встречаемость гиперкортицизма у этой же категории пациентов составляет от 3 до 9% [3–6]. Наиболее частой причиной ЭГ является БИК и составляет 80–85%, 10–20% случаев развивается из-за первичной патологии надпочечников, а 5–10% обусловлены АКТГ-эктопической секрецией [2].
ДИАГНОСТИКА
Этапами диагностики гиперкортицизма являются:
- выявление характерных клинических симптомов;
- подтверждение диагноза эндогенного гиперкортицизма;
- установление конкретной нозологической формы болезни.
Наиболее часто встречающимися клиническими признаками (более чем в 50% случаев) являются:
- центральное ожирение с отложением жировой клетчатки преимущественно в области туловища (с формированием «надключичных подушечек» и «климактерического горбика» на уровне VII шейного позвонка) и лица («лунообразное» лицо);
- похудание верхних и нижних конечностей, атрофия ягодичных мышц («скошенные» ягодицы);
- яркий румянец цианотического оттенка («матронизм»);
- выраженная мышечная слабость, быстрая утомляемость;
- артериальная гипертензия;
- широкие багрово-фиолетовые стрии (преимущественно на животе, плечах и бедрах);
- отеки нижних конечностей;
- акне и/или гнойничковые поражения кожи;
- подкожные кровоизлияния;
- тонкая («мраморная») кожа, плохая заживляемость ран;
- гирсутизм у женщин;
- нарушения половой функции как у женщин (олиго-, опсо-, аменорея, бесплодие), так и мужчин (эректильная дисфункция, снижение либидо и потенции).
В 5–50% случаев могут встречаться головная боль, избыточная потливость, облысение, сахарный диабет, коагулопатии, отеки, психиатрические симптомы (депрессия, галлюцинации, бред), нефролитиаз, остеопороз (малотравматичные переломы), потемнение кожных покровов в области кожных складок и в местах трения, хронические инфекционные заболевания мягких тканей и/или органов, ишемическая болезнь сердца и цереброваскулярная болезнь [7–9].
Лабораторный скрининг на выявление гиперкортицизма должен быть проведен среди следующих групп населения:
- всех пациентов с характерными изменениями внешности и/или другими множественными клиническими проявлениями гиперкортицизма;
- молодых людей с необычными для их возраста заболеваниями (остеопороз с низкотравматичными переломами, сахарный диабет и ожирение, артериальная гипертензия, аменорея у женщин и снижение полового влечения у мужчин, быстрая прибавка массы тела в сочетании с выраженной общей и мышечной слабостью);
- детей, у которых отмечается задержка роста в сочетании с увеличением массы тела;
- пациентов любого возраста с плохо контролируемым сахарным диабетом и/или артериальной гипертензией в сочетании с ожирением или быстрой прибавкой массы тела;
- пациентов с переломами тел позвонков (особенно множественными переломами в возрасте до 65 лет);
- пациентов со случайно выявленным новообразованием надпочечника [8, 10].
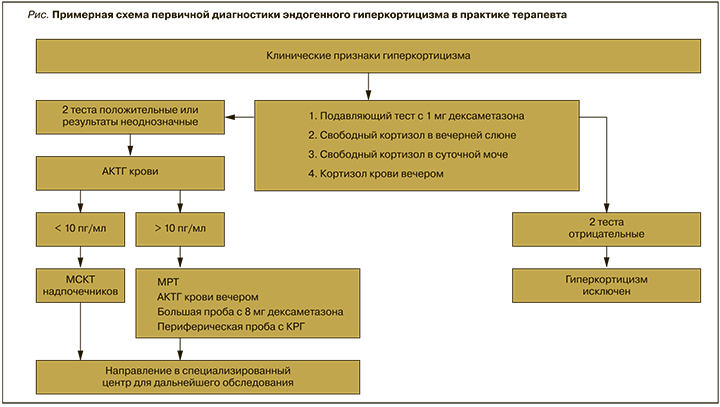
Только после исключения приема ГКС подтверждение ЭГ может включать следующие тесты:
- определение уровня свободного кортизола в образце слюны, собранной пациентом в 23 ч;
- подавляющий тест с дексаметазоном (или малая проба) – исследование кортизола в сыворотке крови утром после приема 1 мг дексаметазона в 23 ч;
- определение уровня свободного кортизола в суточной моче;
- определение кортизола в крови вечером [2].
Каждый метод первичной диагностики имеет свои особенности сбора биологического материала и ограничения (табл. 2).

В связи с высокой вариабельностью физиологической секреции кортизола и ограничениями всех существующих тестов рекомендуется использовать как минимум два теста для подтверждения или исключения ЭГ. При выборе диагностических тестов учитываются возможности их проведения в имеющихся амбулаторных условиях, их диагностическая информативность, простота выполнения для пациента и стоимость. Отечественные клинические рекомендации предлагают отдавать преимущество двум тестам: подавляющий тест с 1 мг дексаметазона и определение свободного кортизола в слюне вечером. Два вышеуказанных положительных теста с высокой вероятностью свидетельствуют о наличии ЭГ, но не исключают ложноположительного результата, поэтому рекомендуется проведение дополнительного лабораторного и инструментального обследования в специализированных центрах. Если оба теста отрицательны, диагноз может быть исключен.
Дифференциальная диагностика АКТГ-зависимого и АКТГ-независимого ЭГ проводится с помощью определения уровня АКТГ крови в утреннее время. При подавлении утреннего уровня АКТГ ниже 10 пг/мл (показатель менее 5 пг/мл имеет бóльшую точность) устанавливается АКТГ-независимый ЭГ, и последующая визуализация надпочечников проводится методом мультиспиральной компьютерной томографии (МСКТ) [11]. При уровне АКТГ выше 10 пг/мл подтверждается АКТГ-зависимый эндогенный гиперкортицизм.
Дифференциальный диагноз АКТГ-зависимого ЭГ позволяют провести следующие тесты (табл. 3):
- большую пробу с дексаметазоном (БПД);
- периферическую пробу с кортиколиберином;
- анализ АКТГ крови в вечернее время (уровень более 110 пг/мл свидетельствует в пользу АКТГ-эктопированного синдрома);
- магнитно-резонансную томографию (МРТ) головного мозга;
- двусторонний селективный забор крови из нижних каменистых синусов (в том числе на фоне стимуляции кортиколиберином) [2].
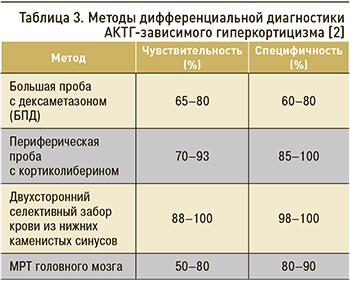 Биохимические тесты для дифференциальной диагностики АКТГ-зависимых форм гиперкортицизма основаны на допущении, что аденома гипофиза продолжает частично подчиняться принципу отрицательной обратной связи. Так, аденома гипофиза с большей вероятностью продемонстрирует подавление секреции АКТГ в ответ на большие дозы ГКС, а эктопическая опухоль, секретирующая АКТГ, чаще всего не обладает такими свойствами. БПД считается положительной (т.е. когда наиболее вероятна БИК) при подавлении уровня кортизола в сыворотке крови утром на 60% и более. Периферическая проба с кортиколиберином основана на стимуляции кортиколиберином секреции АКТГ гипофизом. Синтетический КРГ вводится внутривенно в дозе 100 мкг и определяется АКТГ и кортизол крови в течение 1 ч с 15-минутными интервалами. Проба считается положительной (наиболее вероятна БИК), если уровень АКТГ на 15–30-й минутах увеличивается как минимум на 35% от исходного уровня, а уровень кортизола – на 20%. МРТ отличается наибольшей чувствительностью при условии использования контрастного усиления. Однако в 20% случаев микроаденома не визуализируется на МРТ даже при ее наличии, а микроаденома менее 5–6 мм в диаметре может являться гормонально-неактивной. Таким образом, при дифференциально-диагностическом поиске может возникать трудность в оценке вероятности следующих событий: БИК с микроаденомой, которая не визуализируется на МРТ, или инциденталома гипофиза в сочетании с АКТГ-эктопией. При наличии аденомы гипофиза размером 6 мм и более целесообразно устанавливать диагноз БИК. При отсутствии визуализации аденомы гипофиза или при выявлении аденомы гипофиза менее 6 мм показано проведение БПД и других исследований для дифференциальной диагностики АКТГ-зависимого эндогенного гиперкортицизма [2].
Биохимические тесты для дифференциальной диагностики АКТГ-зависимых форм гиперкортицизма основаны на допущении, что аденома гипофиза продолжает частично подчиняться принципу отрицательной обратной связи. Так, аденома гипофиза с большей вероятностью продемонстрирует подавление секреции АКТГ в ответ на большие дозы ГКС, а эктопическая опухоль, секретирующая АКТГ, чаще всего не обладает такими свойствами. БПД считается положительной (т.е. когда наиболее вероятна БИК) при подавлении уровня кортизола в сыворотке крови утром на 60% и более. Периферическая проба с кортиколиберином основана на стимуляции кортиколиберином секреции АКТГ гипофизом. Синтетический КРГ вводится внутривенно в дозе 100 мкг и определяется АКТГ и кортизол крови в течение 1 ч с 15-минутными интервалами. Проба считается положительной (наиболее вероятна БИК), если уровень АКТГ на 15–30-й минутах увеличивается как минимум на 35% от исходного уровня, а уровень кортизола – на 20%. МРТ отличается наибольшей чувствительностью при условии использования контрастного усиления. Однако в 20% случаев микроаденома не визуализируется на МРТ даже при ее наличии, а микроаденома менее 5–6 мм в диаметре может являться гормонально-неактивной. Таким образом, при дифференциально-диагностическом поиске может возникать трудность в оценке вероятности следующих событий: БИК с микроаденомой, которая не визуализируется на МРТ, или инциденталома гипофиза в сочетании с АКТГ-эктопией. При наличии аденомы гипофиза размером 6 мм и более целесообразно устанавливать диагноз БИК. При отсутствии визуализации аденомы гипофиза или при выявлении аденомы гипофиза менее 6 мм показано проведение БПД и других исследований для дифференциальной диагностики АКТГ-зависимого эндогенного гиперкортицизма [2].
Надо признать, что наиболее чувствительным методом для дифференциального диагноза БИК и АКТГ-эктопии является двусторонний одномоментный селективный забор крови из нижних каменистых синусов (НКС): выполняется несколько заборов крови до введения кортиколиберина (или десмопрессина) и после введения стимуляционного агента. Селективный забор крови из НКС рекомендуется проводить в высокоспециализированном учреждении при отсутствии визуализации аденомы гипофиза на МРТ, размере аденомы гипофиза менее 6 мм в сочетании с отрицательной большой дексаметазоновой пробой и/или уровнем АКТГ в вечернее время более 110 пг/ мл. Подтверждение АКТГ-эктопированного синдрома диктует проведение поиска опухолевого образования, секретирующего АКТГ, с целью чего могут проводиться МСКТ, МРТ, радиоизотопные методы исследования, позитронно-эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ-КТ). Примерная схема первичной диагностики ЭГ представлена на рисунке.
ЛЕЧЕНИЕ ГИПЕРКОРТИЦИЗМА
Целью лечения гиперкортицизма является снижение повышенного уровня кортизола в крови. Вне зависимости от формы заболевания методом выбора является хирургическое лечение, направленное на устранение источника гиперпродукции АКТГ или кортизола: при БИК – нейрохирургическое удаление аденомы гипофиза через нос (трансназальная транссфеноидальная аденомэктомия), при кортизолпродуцирующей опухоли надпочечника или АКТГ-эктопии – удаление опухоли хирургом, специализирующимся на операциях в данной области тела. После хирургического лечения на какое-то время или пожизненно требуется заместительная терапия ГКС. Трансназальная аденомэктомия позволяет достичь ремиссии в 65–90% случаев [2, 12].
Лучевая терапия (конвенциональная лучевая терапия, стереотаксическая радиохирургия, стереотаксическая радиотерапия, брахитерапия) рассматривается у пациентов с БИК при невозможности хирургического лечения, при неполном удалении опухоли и отсутствии ремиссии заболевания, а также при возникновении рецидива [2, 13–14]. На аденому подается большая доза облучения таким образом, что окружающие здоровые ткани мозга получают минимальное количество радиации. Стереотаксические методы облучения являются методами выбора при лечении пациентов с инфильтративно растущими аденомами, которые распространяются на структуры хиазмально-селлярной области и основания черепа. Однако эффект от лучевого лечения наступает не раньше чем через полгода, поэтому до его наступления необходимо проведение медикаментозной терапии (табл. 4, 5).
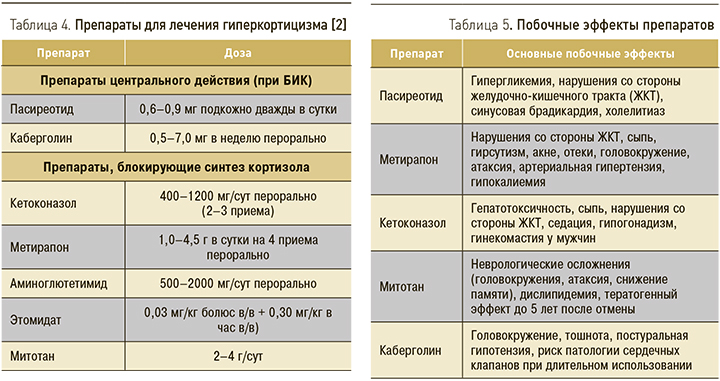
Консервативное лечение проводится также при неэффективности других методов лечения, невозможности их проведения или при отсутствии установленной причины гиперкортицизма.
Для медикаментозного лечения БИК зарегистрирован мультилигандный аналог соматостатина – пасиреотид, при недостаточной эффективности которого может рассматриваться назначение агонистов дофаминовых рецепторов (каберголин) вне зависимости от уровня пролактина. Пасиреотид применяется в виде подкожных инъекций, действие препарата опосредованно через рецепторы опухоли. Препарат рекомендуется пациентам старше 18 лет при неэффективности или невозможности проведения нейрохирургического лечения [13]. При любой форме эндогенного гиперкортицизма эффективны препараты, блокирующие производство кортизола надпочечниками (кетоконазол, метирапон, аминоглютетимид, этомидат, митотан). Блокаторы стероидогенеза – наиболее многочисленная группа препаратов, используемых для устранения симптомов ЭГ. Однако данные об их эффективности получены в ходе небольших наблюдательных исследований, поэтому официально зарегистрированных показаний препараты не имеют. Как правило, ингибиторы стероидогенеза используются для контроля симптомов заболевания при подготовке к нейрохирургическому или другим методам лечения [2, 13].
В случае невозможности установить причину эндогенного гиперкортицизма, отсутствия эффекта от всех доступных методов лечения или тяжелого гиперкортицизма (уровень кортизола в суточной моче более чем в 10 раз выше верхней границы референсных значений) с жизнеугрожающими осложнениями может быть рекомендовано удаление обоих надпочечников (двухсторонняя адреналэктомия). Метод быстро устраняет избыток кортизола, но требует пожизненной заместительной терапии ГКС и минералокортикоидами.
ВЫЯВЛЕНИЕ ОСЛОЖНЕНИЙ ГИПЕРПРОДУКЦИИ КОРТИЗОЛА И ИХ КОРРЕКЦИЯ
Гиперкортицизм, как правило, сопровождается следующими патологическими состояниями: дислипидемией, артериальной гипертензией, нарушением углеводного обмена, гипокалиемией, остеопорозом, инфекционными заболеваниями, нарушениями свертывающей системы крови, депрессией, эрозивно-язвенными поражениями ЖКТ. В зависимости от степени выраженности указанных нарушений показано назначение гиполипидемической терапии (статины, фибраты); комбинированной антигипертензивной терапии (возможно, применение α1-адреноблокаторов при резистентной гипертензии); сахароснижающих препаратов; калийсберегающих диуретиков и препаратов калия. При наличии низкотравматических переломов или при их высоком риске показано назначение препаратов для лечения стероидного остеопороза с предварительной компенсацией дефицита витамина D [2]. Рекомендуется проводить лечение депрессии и других аффективных расстройств у психиатра. Соответствующая симптоматическая терапия необходима и при инфекционных осложнениях и поражениях ЖКТ. Важно отметить, что назначение блокаторов протонной помпы несовместимо с кетоконазолом.
Последние научные работы говорят о значительно более высокой распространенности ЭГ, чем ожидалось, особенно в группах потенциального риска. А жалобы у таких пациентов могут быть совершенно разнообразными и затрагивать практически все органы и системы. Поэтому столь важно знать о наиболее ярких клинических проявлениях синдрома, тактике его диагностики и лечения.


