ВВЕДЕНИЕ
Проблемой терапии хронической обструктивной болезни легких (ХОБЛ) на современном этапе является тот факт, что эффективность лечения не удовлетворяет ни врачей, ни пациентов. Анализ данных литературы свидетельствует, что лечение статинами пациентов с ХОБЛ может помочь в решении проблемы замедления прогрессирования, улучшении прогноза заболевания, качества и увеличении продолжительности жизни больных, а также позволит снизить риск развития сердечно-сосудистых заболеваний (ССЗ) [3, 12, 25]. В современной медицине проблема терапевтического подхода с учетом основных патогенетических механизмов у пациентов с коморбидными состояниями, в частности ХОБЛ и ишемической болезнью сердца (ИБС), остается актуальной [4, 10, 11, 12, 25].
Известно, что при ХОБЛ происходят многокомпонентные патофизиологические нарушения, ключевым из которых является системное воспаление [5, 6]. Обнаружено снижение уровня госпитальной и 90-дневной смертности у пациентов, применявших длительное время статины и госпитализированных с обострением ХОБЛ [7].
В 2012 г. на основе Европейских рекомендаций разработаны Российские рекомендации по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза, в которых возможности оценки сердечно-сосудистого риска у пациентов с коморбидными заболеваниями и отягчающими клиническими состояниями существенно расширились [1, 2].
Терапия статинами остается основной для нормализации липидного обмена и достижения целевого уровня холестерина липопротеидов низкой плотности (ХС ЛПНП). В последние годы у статинов обнаружено множество новых терапевтических свойств, не связанных с их гиполипидемическим действием, так называемых плейотропных, т.е. дополнительных эффектов препаратов, не зависящих от их основного механизма действия [9, 13, 21, 23, 25, 28, 29]. Благодаря этим эффектам спектр изученных терапевтических возможностей статинов значительно расширился [8, 9, 14, 15, 28]. P.O. Bonetti и соавт. (2003), обобщившие липидонезависимые эффекты статинов [14], выделили главные из них: влияние на функциональное состояние эндотелия и факторы воспаления; антиишемическое и антиоксидантное действия [15]; воздействие на клеточные компоненты атеросклеротической бляшки, активацию макрофагов, клеточную пролиферацию и апоптоз; влияние статинов на гемостаз, ангиогенез, гипертрофию миокарда [12, 25, 28]. К эффектам, не доказанным в крупных исследованиях, относятся антиаритмическое действие, замедление прогрессирования болезни Альцгеймера и деменции, иммунносупрессивное действие, профилактика травматизма [6, 16, 17, 18] и положительное влияние на функцию легких [9, 13, 23, 25, 28].
 Цель исследования: изучить влияние 6-месячного лечения аторвастатином (Липримар, «Пфайзер») на показатели липидного спектра, выраженность субклинического воспаления, респираторную функцию легких и функцию эндотелия у пациентов с ХОБЛ, не имеющих ССЗ.
Цель исследования: изучить влияние 6-месячного лечения аторвастатином (Липримар, «Пфайзер») на показатели липидного спектра, выраженность субклинического воспаления, респираторную функцию легких и функцию эндотелия у пациентов с ХОБЛ, не имеющих ССЗ.
МАТЕРИАЛ И МЕТОДЫ
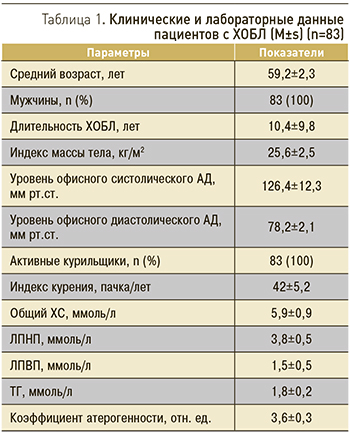
Объектом исследования послужила группа курящих мужчин (n=83) в возрасте от 43 до 65 лет (средний возраст 59,2±2,3 года) с наличием ХОБЛ 2-й стадии по GOLD [19]. Диагностика 2-й стадии ХОБЛ основывалась на постбронходилатационном значении 50% ≤ОФВ1 (объема форсированного выдоха за 1-ю секунду) <80% от должного и ЖЕЛ (жизненной емкости легких) ≤70%. Частота обострений ХОБЛ за 6 мес между изучаемыми группами пациентов не различалась.
Эффективность аторвастатина изучалась у пациентов с ХОБЛ 2-й стадии на фоне стабильной базисной бронхолитической терапии (тиотропиум бромид) и с отсутствием клинических проявлений ССЗ, в том числе отсутствием диагностированной ранее и на момент включения артериальной гипертензии. Всем больным осуществлялся расчет сердечно-сосудистого риска по шкале SCORE, среднее значение которого составило 8,31±4,0. Таким образом, больные ХОБЛ, включенные в исследование, имели высокий риск развития сердечно-сосудистых осложнений в ближайшие 10 лет (за счет мужского пола, курения, возраста и повышенного уровня холестерина). Критерием включения являлось наличие дислипидемии соответственно рекомендациям Всероссийского научного общества кардиологов по лечению дислипидемии (2012). С учетом категории риска уровень общего холестерина (ХС) составил ≥4–4,5 ммоль/л; ЛПНП ≥1,8–2,5 ммоль/л; холестерина липопротеидов высокой плотности (ХС-ЛПВП) – ≤ 1,0 ммоль/л; триглицеридов (ТГ) ≥ 1,7 ммоль/л. Критерии исключения: наличие сопутствующих заболеваний, таких как ИБС (стенокардия, инфаркт миокарда, сердечная недостаточность), гипертоническая болезнь, перенесенное острое нарушение мозгового кровообращения, сахарный диабет.
Исследование респираторной системы включало проведение спирометрии с регистрацией и анализом петли потока-объема. В ходе проведения теста определялись и оценивали форсированную ЖЕЛ (ФЖЕЛ), ОФВ1, индекс Тиффно. Оценивали результаты бодиплетизмографии с последующим определением ЖЕЛ, общей емкости легких) внутригрудного объема, резервного объема выдоха, остаточного объема легких, диффузионной способности легких (DLCO) методом однократной задержки дыхания. Все исследования респираторной функции легких (спирометрию, бодиплетизмографию, определение диффузионной способности легких) проводили на компьютеризированном диагностическом комплексе Elite Dl (Medical Graphics Corporation, США). Расчет показателей осуществлялся автоматически с помощью прилагаемой к оборудованию компьютерной программы Breeze Suite 6.2 по стандартному протоколу.
Оценку липидного профиля проводили на биохимическом анализаторе Architect – 8000 (Abbott, США). Реагенты для определения показателей липидного профиля использовались также фирмы Abbott.
Исследование было одобрено комитетом по этике и доказательности медицинских исследований ФГБОУ ВО «КемГМУ» Минздрава России и соответствовало этическим стандартам биоэтического комитета, разработанным в соответствии с Хельсинкской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2013 г. и Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава России от 19.06.2003 г. № 266. Включение в исследование проводилось после подписания пациентами информированного согласия.
Клиническая характеристика и лабораторные показатели включенных в исследование пациентов представлены в табл. 1.
Пациентам 1-й группы (n=42) был назначен аторвастатин в дозе 20 мг/сут в течение 6 мес, пациенты 2-й группы (n=41) относились к группе сравнения, которая была сформирована из пациентов, отказавшихся от постоянного приема статинов, несмотря на полученную информацию об их позитивном действии. Осуществлялась оценка липидного профиля: концентрация общего ХС, ТГ, ЛПНП и ЛПВП, величина коэффициента атерогенности. Согласно дизайну исследования, титрования дозы аторвастатина не проводилось. После завершения 6 мес исследования всем пациентам был рекомендован прием статинов.
Исследование вазорегулирующей функции эндотелия осуществлялось посредством пробы на реактивную гиперемию плечевой артерии, так как одним из патогенетических механизмов развития ХОБЛ является дисфункция эндотелия. Исследование выполнялось на ультразвуковом аппарате ALOCA 5500 линейным датчиком 7,5–10 МГц в режиме двухмерного ультразвукового сканирования. Плечевую артерию лоцировали в продольном и поперечном сечениях на 2–5 см проксимальнее локтевого сгиба. Измеряли диаметр плечевой артерии (D) после 10–15-минутного отдыха в фазу диастолы, автоматически синхронизируя изображение сосуда с зубцом R на электрокардиограмме. Отмечали изменения диаметра плечевой артерии и линейной скорости кровотока (VI) в ответ на прирост потока крови при проведении пробы с реактивной гиперемией (эндотелий-зависимая реакция) и изменения диаметра плечевой артерии в ответ на сублингвальный прием 500 мкг нитроглицерина (эндотелий-независимая реакция). Адекватной реакцией плечевой артерии на реактивную гиперемию считалось ее расширение более 10% и на 15–20% на фоне воздействия нитроглицерина. Меньшая вазодилатация или парадоксальная вазоконстрикция считались патологической реакцией, что указывало на наличие дисфункции эндотелия.
С помощью количественного метода твердофазного иммуноферментного анализа проводили исследование концентрации цитокинов: интерлейкин-6 (ИЛ-6), ИЛ-8, фактор некроза опухоли α (ФНО-α) и эндотелина-1 (ЭТ-1) в сыворотке крови с использованием наборов реактивов фирмы BIOSOURCE, Бельгия. Измерение осуществлялось на иммуноферментном планшетном ридере «Униплан» (фирма «ПИКОН», Москва). Для определения референсных значений биомаркеров воспаления и ЭТ-1 исследована кровь 20 здоровых добровольцев: ИЛ-6 – 3,31 (1,7–4,28) пг/мл, ИЛ-8 – 3,41 (2,94–4,3) пг/мл, ФНО-α – 2,31 (1,42–3,70) пг/мл, ЭТ-1 – 0,15 (0,10–0,24) фмоль/ мл. Через 6 мес всем пациентам проводили повторное обследование в том же объеме.
Статистическая обработка материала проводилась с использованием пакета прикладных программ Statistica № 8.0.360.0 компании StatSoft, Inc (США), SPSS Statistic версии 19 компании IBM (США) и JMP версии 8 компании SAS Institute Inc. (США). Для описания признаков с нормальным распределением использовали среднее (М) с указанием стандартного отклонения (s). Для признаков с распределением отличным от нормального указывали медиану (Med) и квартильное отклонение (Ме±Q). Для проверки гипотезы о нормальности распределения применялся критерий Колмогорова–Смирнова. Сравнение количественных признаков для двух независимых групп проводили по критерию Манна–Уитни. Для анализа связи между двумя признаками, анализа различий в частоте выявления неблагоприятных клинических признаков применялся непараметрический метод Спирмена. Результаты считались статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
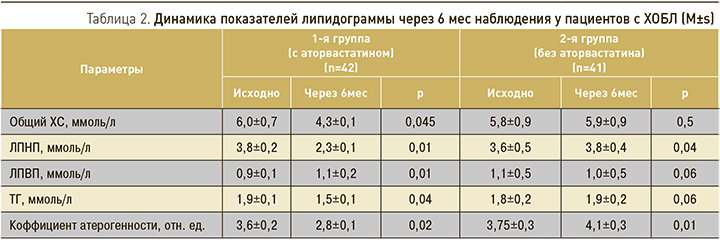
Исходно у большинства исследуемых пациентов 1-й и 2-й групп было выявлено повышение уровней общего ХС и ЛПНП, что составило 6,0±0,7 и 5,8±0,9; 3,8±0,2 и 3,6±0,5ммоль/л соответственно (табл. 2). Через 6 мес наблюдения у пациентов 1-й группы на фоне лечения аторвастатином в дозе 20 мг были достигнуты целевые уровни Х-ЛПНП (менее 2,5 ммоль/л). Отмечалось достоверное снижение уровня общего ХС (4,3±0,1; p=0,045), ЛПНП (2,3±0,1; p=0,01), ТГ (1,5±0,1; p=0,04) и повышение уровня ЛППВ (1,1±0,2; p=0,01). У пациентов 2-й группы, не принимающих аторвастатин, положительной динамики в показателях липидограммы выявлено не было.
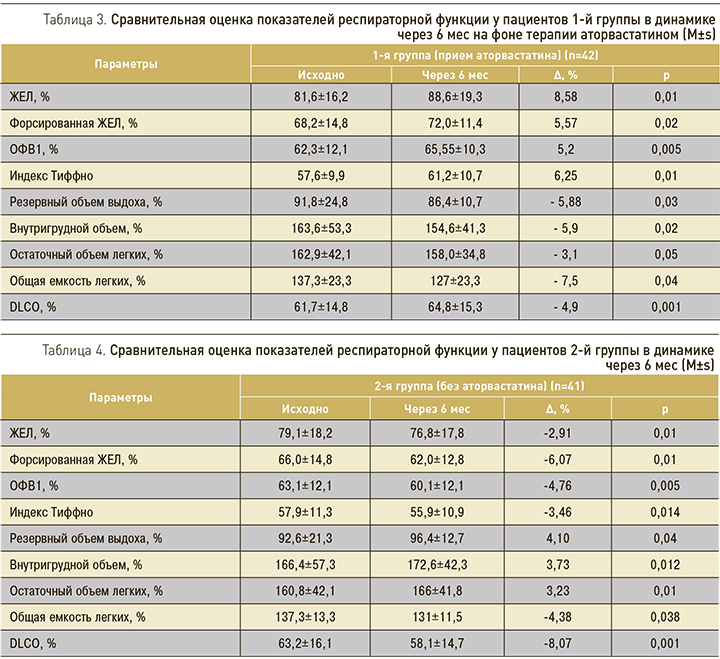
На фоне терапии аторвастатином у пациентов 1-й группы при оценке показателей респираторной функции отмечена достоверная положительная динамика объемов и диффузионной способности по результатам контрольной бодиплетизмографии: статистически значимое увеличение ЖЕЛ на 8,58% (р=0,01), ОФВ1 – на 5,2% (р=0,005), DLCO – на 4,9% (р=0,001) и индекса Тиффно (р=0,01) (табл. 3).
У пациентов 2-й группы, не принимающих аторвастатин, показатели респираторной функции на фоне стабильно сохраняющейся базисной медикаментозной терапии достоверно ухудшились: отмечено уменьшение ЖЕЛ на 2,91% (р=0,01), ОФВ1 – на 4,8%, (р=0,005), DLCO – на 8,07% (р=0,001), индекса Тиффно – на 3,46% (р=0,014) (табл. 4).
Таким образом, к концу 6-месячного периода наблюдения значение ОФВ1 составлял для пациентов на фоне терапии аторвастатином 65,55±10% против 60,1±12,1% для пациентов, не принимающих аторвастатин (p < 0,01).
При исследовании функции эндотелия у больных обеих групп в 74,7% случаев (n=62) было выявлено нарушение эндотелий-зависимой вазодилатации (ЭЗВД) плечевой артерии. У пациентов 1-й группы терапия аторвастатином сопровождалась улучшением функционального состояния эндотелия сосудов как при исходно сниженной, так и у больных с исходно сохраненной функцией эндотелия. Причем ЭЗВД значительно в большей степени возросла в группе больных, принимающих аторвастатин (рис. 1), у которых до начала терапии в пробе с реактивной гиперемией она была менее 10%, т.е. имела место дисфункция эндотелия по сравнению с пациентами с сохраненной эндотелиальной функцией (рис. 1, 2).
У пациентов 1-й группы до проведения терапии аторвастатином отмечался повышенный уровень ЭТ-1, что составило 1,87±0,4 фмоль/мл. На фоне 6-месячного приема аторвастатина выявлено статистически значимое (р=0,00001) снижение уровня ЭТ-1 до 0,84±0,2 фмоль/мл. Во 2-й группе отмечено снижение показателей при проведении пробы с реактивной гиперемией у пациентов с ЭЗВД <10% на 9,0% (р=0,01), а у пациентов с ЭЗВД > 10% отмечено снижение показателей на 6,8% (р < 0,05). Таким образом, у пациентов 2-й группы функция эндотелия достоверно ухудшилась. При корреляционном анализе была выявлена отрицательная связь между ОФВ1 и уровнем ЭТ-1 (r= -0,69; р=0,01), между ЖЕЛ и сывороточным уровнем ЭТ-1 (r= -0,53; p=0,02).
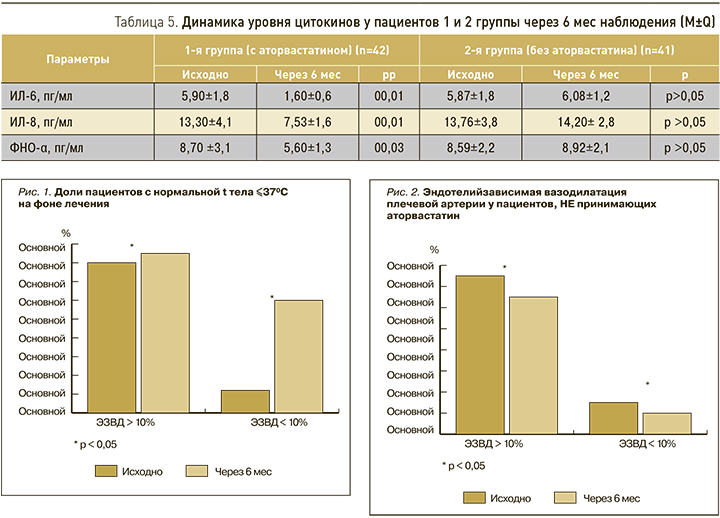
При оценке особенностей процессов субклинического воспаления в ходе нашей работы было выявлено, что в 1-й группе на фоне терапии аторвастатином концентрация провоспалительных цитокинов значительно снизилась (табл. 5): ИЛ-6 – в 3,7 раза (р=0,01), ИЛ-8 – на 49,4% (р=0,01), ФНО-α – на 35,7% (р=0,03). При этом обращает на себя внимание, что в группе пациентов, не принимающих аторвастатин, отмечалась тенденция к нарастанию показателей, отражающих процессы неспецифического воспаления.
При проведении корреляционного анализа показателей реактивной вазодилатации с уровнем сывороточной концентрации провоспалительных цитокинов была выявлена достоверная корреляционная связь ЭЗВД с ФНО-α (r= -0,76; р <0,01) и ИЛ-6 (r= -0,77; р <0,01).
ОБСУЖДЕНИЕ
Известно, что ЛПНП являются основной транспортной формой ХС, а их уровень в большей степени коррелирует с риском развития атеросклероза, чем уровень общего ХС и остальных параметров липидограммы [1]. У большинства исследуемых пациентов были выявлены отклонения в показателях липидограммы, при этом на фоне лечения аторвастатином в течение 6 мес были достигнуты целевые уровни ЛПНП в отличие от пациентов контрольной группы. Примечательно, что даже невысокая доза аторвастатина (20 мг/сут) оказала положительный эффект, способствуя не только нормализации липидного обмена, но и снижению сердечно-сосудистого риска.
Неуклонно прогрессирующее снижение показателей вентиляционной способности легких, характерное для ХОБЛ, является независимым прогностическим неблагоприятным фактором общей и сердечной смертности [20]. Прием статинов ингибирует процессы фиброобразования в легких, ведущих к фиброзу мелких дыхательных путей и необратимому ограничению воздушного потока [21]. На фоне терапии аторвастатином выявлена значимая положительная динамика ЖЕЛ и диффузионной способности по результатам контрольной бодиплетизмографии. Наряду с этим пациенты контрольной группы демонстрировали ухудшение показателей респираторной функции. Результаты экспериментальных исследований и клинических наблюдений демонстрируют снижение прогрессирования ХОБЛ и смертности от сердечно-сосудистых осложнений на фоне применения статинов. Так, J.I. Keddissi и соавт. (2007) показали положительное влияние статинов на ОФВ1 и форсированную ЖЕЛ [22]. В работе Е.И. Саморуковой и соавт. (2013) была отмечена способность розувастатина оказывать модулирующие эффекты на течение ХОБЛ – уменьшение числа обострений, улучшение легочной функции и оксигенации [24]. Однако следует признать, что работ, посвященных тщательному изучению плейотропных эффектов статинов у пациентов с ХОБЛ, по-прежнему крайне недостаточно.
В работе Н.А. Кузубовой и соавт. (2010) в группе пациентов с аналогичной патологией было выявлено уменьшение ЭЗВД у 60% [26]. В нашей работе эти данные подтвердились. Так, у 74,7% пациентов было выявлено нарушение эндотелий-зависимой вазодилатации (ЭЗВД) плечевой артерии. Терапия аторвастатином сопровождалась улучшением функционального состояния эндотелия сосудов независимо от исходного состояния функции эндотелия.
Одним из главных вазоконстрикторов, синтезируемых непосредственно в эндотелии, является пептид ЭТ-1, содержание которого повышено не только при выраженном атеросклерозе, но и на ранних его стадиях [5]. Нами продемонстрировано значимое снижение концентрации ЭТ-1 в плазме на фоне 6-месячной терапии аторвастатином, что свидетельствует о непосредственном влиянии аторвастатина на эндотелий сосудистой стенки. В работе Н.А. Кузубовой и соавт. (2010) также было установлено повышение концентрации ЭТ-1 в плазме больных ХОБЛ при стабильном течении уже при 2-й стадии патологического процесса. Авторы полагают, что повышение концентрации ЭТ-1 в плазме на 2-й стадии ХОБЛ может рассматриваться как признак возникновения дисфункции эндотелия, который опосредует один из механизмов раннего включения сосудистого фактора в патогенез этого заболевания и способствует развитию микроциркуляторных расстройств у пациентов уже со среднетяжелым течением болезни [26].
Интересные данные были представлены в ходе анализа Copenhagen General Population Study (2003–2008), в который были включены более 5 тыс. пациентов с ХОБЛ. На протяжении 3 лет наблюдения у больных регистрировали обострения ХОБЛ, требующие госпитализации или назначения системных кортикостероидов. Анализировали связь между терапией статинами и высоким уровнем С-реактивного белка (СРБ), а также влияние высокого уровня СРБ на риск обострений в течение наблюдения. Применение статинов ассоциировалось со снижением риска обострений ХОБЛ (р=0,01). В то же время в подгруппе пациентов с наиболее тяжелой ХОБЛ, не имеющих сопутствующих кардиоваскулярных заболеваний, связь между приемом статинов и риском обострений отсутствовала (р=0,83). Был сделан вывод, что, благодаря снижению уровня СРБ, статины способствуют уменьшению риска обострений ХОБЛ на 14% [27].
В ходе нашей работы было показано, что на фоне терапии аторвастатином концентрация провоспалительных цитокинов значительно снизилась в отличие от аналогичных показателей в контрольной группе пациентов. В работе R.P. Young и соавт. (2009) также продемонстрировано, что под действием статинов происходит торможение образования цитокинов, таких как ФНО-α, ИЛ-6, ИЛ-8, снижается степень инфильтрации нейтрофилов в легких и воспалительный ответ на легочную инфекцию [21, 28].
Выявленная корреляционная зависимость между величиной ЭЗВД и уровнем ФНО-α подтверждает, что нарастание содержания провоспалительных цитокинов в сыворотке крови оказывает влияние на формирование эндотелиальной дисфункции у больных ХОБЛ.
ЗАКЛЮЧЕНИЕ
Полученные нами данные свидетельствуют о том, что системное воспаление и его внелегочные проявления оказывают влияние на тяжесть течения ХОБЛ. У пациентов с ХОБЛ 2-й стадии, не имеющих ССЗ, 6-месячная терапия аторвастатином способствует статистически значимому снижению уровней ОХ, ЛПНП, ТГ, а также уменьшает концентрацию провоспалительных цитокинов, улучшает показатели респираторной функции легких и параметры эндотелиальной функции. Результаты полученных исследований, свидетельствующие в пользу плейотропных эффектов аторвастатина, могут лечь в основу первичной профилактики ССЗ у больных ХОБЛ.



